WikiDer > Никель Ренея
 Сухой активированный никель Ренея | |
| Идентификаторы | |
|---|---|
| UNII | |
| Характеристики | |
| Внешность | Светло-серый порошок |
| Опасности | |
| Пиктограммы GHS |    |
| H250, H317, H351, H372, H412 | |
| P210, P273, P280, P302 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Никель Ренея /ˈрeɪпяˈпɪkəl/, также называемый губчатый никель,[1] представляет собой мелкозернистое твердое вещество, состоящее в основном из никель полученный из никеля -алюминий сплав.[2][3] Известно несколько сортов, большинство из которых являются серыми твердыми веществами. Некоторые пирофорный, большинство из них используются в виде стабильных на воздухе суспензий. Никель Ренея используется в качестве реагента и катализатора в органическая химия. Он был разработан в 1926 году американским инженером. Мюррей Рэйни для гидрирование растительных масел.[4][5]
Номенклатура
Поскольку Raney является зарегистрированным товарным знаком компании В. Р. Грейс и компания, только те продукты, которые производит подразделение Grace, правильно называются «никелем Ренея». Более общие термины «скелетный катализатор» или «катализатор из губчатого металла» могут относиться к катализаторам с физическими и химическими свойствами, аналогичными свойствам никеля Ренея. Однако, поскольку сама компания Grace не использует общих названий для поставляемых катализаторов,[6] «Рэйни» может стать родовым под США закон о товарных знаках.[нужна цитата]
Подготовка
Подготовка сплава

Сплав Ni – Al получают растворением никеля в расплавленном алюминии с последующим охлаждением («закалкой»). В зависимости от соотношения Ni: Al, закалка дает ряд различных фаз. Во время закалки добавляют небольшие количества третьего металла, такого как цинк или хром, для повышения активности полученного катализатора. Этот третий металл называется "промоутер".[7] Промотор превращает смесь из бинарного сплава в трехкомпонентный, что может привести к различным свойствам закалки и выщелачивания во время активации.
Активация
В процессе активации сплав, обычно в виде мелкого порошка, обрабатывают концентрированным раствором едкий натр.[3] Упрощенная реакция выщелачивания дается следующим химическое уравнение:
- 2 Al + 2 NaOH + 6 H2O → 2 Na [Al (OH)4] + 3 H2
Формирование алюминат натрия (Na [Al (OH)4]) требует использования растворов гидроксида натрия с высокой концентрацией во избежание образования гидроксид алюминия, которые в противном случае выпали бы в виде байерит.[7] Следовательно, растворы гидроксида натрия с концентрацией до 5M используются.
Температура, используемая для выщелачивания сплава, оказывает заметное влияние на свойства катализатора. Обычно выщелачивание проводят при температуре от 70 до 100 ° C. Площадь поверхности никеля Ренея (и связанных с ним катализаторов в целом) имеет тенденцию к уменьшению с увеличением температуры выщелачивания.[8] Это связано с структурными перестройками внутри сплава, которые можно рассматривать как аналог спекание, где связки из сплава начнут слипаться друг с другом при более высоких температурах, что приведет к потере пористой структуры.[нужна цитата]
В процессе активации Al выщелачивается из NiAl.3 и Ni2Al3 фазы, которые присутствуют в сплаве, в то время как большая часть Ni остается в форме NiAl. Удаление Al из одних фаз, но не из других, известно как "селективное выщелачиваниеБыло показано, что фаза NiAl обеспечивает структурную и термическую стабильность катализатора. В результате, катализатор достаточно устойчив к разложению («разрушению», обычно известному как «старение»).[8] Это сопротивление позволяет хранить и повторно использовать никель Ренея в течение длительного периода; однако для лабораторного использования обычно предпочтительны свежие препараты.[9] По этой причине коммерческий никель Ренея доступен как в «активной», так и в «неактивной» формах.
Перед хранением катализатор можно промыть дистиллированной водой при температуре окружающей среды, чтобы удалить оставшийся алюминат натрия. Бескислородный (дегазированный) вода предпочтительна для хранения, чтобы предотвратить окисление катализатора, что ускорит процесс его старения и приведет к снижению каталитической активности.[7]
Характеристики
Макроскопически никель Ренея представляет собой мелкодисперсный серый порошок. Микроскопически каждая частица этого порошка представляет собой трехмерную сетка, с порами неправильного размера и формы, большая часть которых создается в процессе выщелачивания. Никель Ренея отличается термической и структурной стабильностью, а также большой Брунауэр-Эммет-Кассир (ДЕРЖАТЬ ПАРИ ) площадь поверхности. Эти свойства являются прямым результатом процесса активации и способствуют относительно высокой каталитической активности.[нужна цитата]
Площадь поверхности обычно определяется методом БЭТ с использованием газа, который предпочтительно адсорбируется на металлических поверхностях, таких как водород. Используя этот тип измерения, было показано, что почти вся открытая площадь частицы катализатора содержит Ni на своей поверхности.[7] Поскольку Ni является активным металлом катализатора, большая площадь поверхности Ni означает, что большая поверхность доступна для одновременного протекания реакций, что отражается в повышенной активности катализатора. Имеющийся в продаже никель Ренея имеет среднюю площадь поверхности Ni 100 мкм.2 на грамм катализатора.[7]
Высокая каталитическая активность в сочетании с тем, что водород поглощен в порах катализатора во время активации, делает никель Ренея полезным катализатором для многих гидрирование реакции. Его структурная и термическая стабильность (то есть, он не разлагается при высоких температурах) позволяет использовать его в широком диапазоне условий реакции.[10][11] Кроме того, растворимость никеля Ренея незначительно в большинстве обычных лабораторных растворителей, за исключением минеральные кислоты такой как соляная кислота, и ее относительно высокая плотность (около 6,5 г см−3)[1] также облегчает его отделение от жидкой фазы после завершения реакции.
Приложения
Никель Ренея используется в большом количестве промышленных процессов и в органический синтез из-за его стабильности и высокой каталитической активности при комнатной температуре.[7][12][13]
Промышленное применение
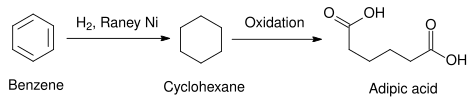
Практический пример использования никеля Ренея в промышленности показан в следующей реакции, где бензол является уменьшенный к циклогексан. Восстановление бензольного кольца очень трудно достичь другими химическими средствами, но его можно осуществить с помощью никеля Ренея. Другие гетерогенные катализаторы, например, использующие платиновая группа элементы, можно использовать вместо этого для аналогичного эффекта, но они, как правило, дороже в производстве, чем никель Ренея. Полученный таким образом циклогексан может быть использован в синтезе адипиновая кислота, сырье, используемое в промышленном производстве полиамиды например нейлон.[14]
Другие промышленные применения никеля Ренея включают преобразование:
- Декстроза к сорбитол;
- Нитросоединения к амины, например, 2,4-динитротолуол к 2,4-толуолдиамину;
- Нитрилы в амины, например, стеаронитрил в стеариламин и адипонитрил к гексаметилендиамин;
- Олефины к парафины, Например, сульфолен к сульфолан;
- Ацетилены к парафинам, например, 1,4-бутиндиол к 1,4-бутандиол.
Приложения в органическом синтезе
Обессеривание
Никель Ренея используется в органическом синтезе для обессеривание. Например, тиоацетали будет восстановлен до углеводородов на последнем этапе Редукция Мозинго:[14][15]
Тиолы,[16] и сульфиды[17] может быть удален из алифатический, ароматный, или гетероароматические соединения. Таким же образом никель Ренея удаляет серу из тиофен дать насыщенный алкан.[18]
Восстановление функциональных групп
Обычно он используется в снижение соединений с множественные облигации, Такие как алкины, алкены,[19] нитрилы,[20] диены, ароматика[21] и карбонил-содержащие соединения. Кроме того, никель Ренея восстанавливает связи гетероатом-гетероатом, такие как гидразины,[22] нитро группы и нитрозамины.[23] Он также нашел применение в восстановительном алкилирование из амины[24] и аминирование спиртов.
При восстановлении двойной связи углерод-углерод никель Ренея будет добавлять водород в син мода.[14]
Безопасность
Сухой активированный никель Ренея из-за своей большой площади поверхности и большого объема содержащегося в нем газообразного водорода пирофорный материал, требующий обработки под инертная атмосфера. Никель Ренея обычно поставляется в виде 50% суспензия в воде. Даже после реакции остаточный никель Ренея содержит значительное количество газообразного водорода и может самопроизвольно воспламениться при контакте с воздухом.[25]
Кроме того, острое воздействие никеля Ренея может вызвать раздражение дыхательных путей и носовых полостей, а также вызвать легочный фиброз при вдыхании. Проглатывание может вызвать судороги и кишечные расстройства. Он также может вызвать раздражение глаз и кожи. Хроническое воздействие может привести к пневмонит и другие признаки сенсибилизация никелю, например кожные высыпания («никелевый зуд»).[26]
| NFPA 704 огненный алмаз | |
|---|---|
Никель также считается возможным человеком. канцероген посредством МАИР (Группа 2Б, Категория ЕС 3) и тератоген, при вдыхании штрафа оксид алюминия частицы связаны с Болезнь Шейвера.
Разработка
Мюррей Рэйни окончил инженер-механик Университет Кентукки в 1909 году. В 1915 году он присоединился к Lookout Oil and Refining Company в Теннесси и отвечал за установку электролитические ячейки для производства водорода, который использовался в гидрирование растительных масел. В то время в промышленности использовался никелевый катализатор, приготовленный из оксид никеля (II). Полагая, что могут быть произведены более качественные катализаторы, примерно в 1921 году он начал проводить независимые исследования, все еще работая в Lookout Oil. В 1924 г. соотношение Ni /Si Был получен сплав, который после обработки гидроксидом натрия оказался в пять раз более активным, чем лучший катализатор, используемый при гидрировании хлопкового масла. Патент на это открытие был выдан в декабре 1925 года.[27]
Впоследствии Рэни произвел сплав Ni / Al 1: 1, следуя процедуре, аналогичной той, что использовалась для никель-кремниевого катализатора. Он обнаружил, что полученный катализатор был еще более активным, и подал заявку на патент в 1926 году.[28] В настоящее время это обычный состав сплава для современных никелевых катализаторов Ренея.[2] Другие распространенные составы сплавов включают 21:29 Ni / Al и 3: 7 Ni / Al. И активность, и протоколы приготовления для этих катализаторов различаются.[2][29]
После разработки никеля Ренея были рассмотрены другие системы сплавов с алюминием, из которых наиболее заметными являются медь, рутений и кобальт.[30] Дальнейшие исследования показали, что добавление небольшого количества третьего металла к бинарному сплаву будет способствовать активности катализатора. Некоторые широко используемые промоторы - цинк, молибден и хром. Альтернативный способ приготовления энантиоселективный Никель Ренея был изобретен поверхностным адсорбция из Винная кислота.[31]
Смотрите также
- Алюминид никеля
- Урушибара никель
- Рике никель
- Катализатор борида никеля
- Кобальт Ренея, аналогичный катализатор из сплава кобальта и алюминия, который иногда более селективен для определенных продуктов гидрирования (например, начальный амины через восстановление нитрила).[2]
Рекомендации
- ^ а б «Губчатый никель». Европейское космическое агентство.
- ^ а б c d Нисимура, Шигео (2001). Справочник по гетерогенному каталитическому гидрированию для органического синтеза (1-е изд.). Нью-Йорк: Wiley-Interscience. С. 7–19. ISBN 9780471396987.
- ^ а б Биллика, Гарри; Адкинс, Гомер (1949). «Катайлст, никель Ренея, W6 (с высоким содержанием алюминия и адсорбированного водорода)». Органический синтез. 29: 24. Дои:10.15227 / orgsyn.029.0024.; Коллективный объем, 3, п. 176
- ^ Видеть:
- Рэйни, Мюррей, «Способ получения мелкодисперсного никеля». Патент США 1628190 (подана: 14 мая 1926 г.; выдана: 10 мая 1927 г.).
- M. S. Wainwright, "3.2 Металлические катализаторы скелета" в: Gerhard Ertl, Helmut Knözinger, and Jens Weitkamp, ed.s, Препарат твердых катализаторов. (Вайнхайм, Федеративная Республика Германия: Wiley-VCH Verlag, 1999), страницы 28–29.
- ^ Ян, Тэн-Куэй; Ли, Донг-Шэн; Хаас, Джулия (2005). «Никель Ренея». Энциклопедия реагентов для органического синтеза. Нью-Йорк: Джон Уайли и сыновья. Дои:10.1002 / 047084289X.rr001.pub2.
- ^ «Специальные катализаторы и технологические процессы». Компания Грейс. Архивировано из оригинал 21 октября 2009 г.
- ^ а б c d е ж Эртль, Герхард; Knözinger, Гельмут (1997). Приготовление твердых катализаторов. Вайли. С. 30–34. ISBN 3-527-29826-6.
- ^ а б Smith, A.J .; Тримм, Д. (2005). «Приготовление скелетных катализаторов». Анну. Rev. Mater. Res. 35: 127. Дои:10.1146 / annurev.matsci.35.102303.140758.
- ^ М. Гуисне, изд. (1993). Гетерогенный катализ и тонкая химия III: материалы 3-го международного симпозиума. Эльзевир. п. 69. ISBN 0-444-89063-7.
- ^ Кроуфорд, Джеральд (апрель 2003 г.). «Экзотический сплав находит свою нишу». Журнал никель. Получено 19 декабря 2006.
- ^ Каррутерс, В. (1986). Некоторые современные методы органического синтеза. Издательство Кембриджского университета. С. 413–414. ISBN 0-521-31117-9.
- ^ Гауптман, Генрих; Вальтер, Вольфганг Фердинанд (1962). «Действие никеля Ренея на органические соединения серы». Chem. Ред. 62 (5): 347. Дои:10.1021 / cr60219a001.
- ^ «Использование никеля Ренея в органическом синтезе». 2005. Архивировано с оригинал 5 июня 2009 г.. Получено 1 августа 2009.
- ^ а б c Соломонс, Т. Грэм; Фрайл, Крейг Б. (2004). Органическая химия. Вайли. ISBN 0-471-41799-8.
- ^ Джонатан Клейден; Ник Гривз; Стюарт Уоррен (2012). Органическая химия (2-е изд.). Oxford University Press. ISBN 9780199270293.
- ^ Graham, A.R .; Миллидж, А. Ф .; Янг, Д. П. (1954). «Продукты окисления диизобутилена. Часть III. Продукты раскрытия цикла 1,2-эпокси-2,4,4-триметилпентана». Журнал химического общества (возобновлено): 2180. Дои:10.1039 / JR9540002180.
- ^ Gassman, P. G .; ван Берген, Т. Дж. (1988). «Индолы из анилинов: Этил 2-метилиндол-5-карбоксилат». Органический синтез. Дои:10.15227 / orgsyn.056.0072.; Коллективный объем, 6, п. 601
- ^ Хегберг, Ханс Эрик; Хеденстроем, Эрик; Фэгерхаг, Йонас; Серви, Стефано (1992). «Снижение тиофенепропеналя на пекарских дрожжах. Энантиоселективный синтез (S) -2-метил-1-алканолы посредством восстановления 2-метил-3- (2-тиофен) пропеналей с помощью пекарских дрожжей ». J. Org. Chem. 57 (7): 2052–2059. Дои:10.1021 / jo00033a028.
- ^ Пейдж, Г. А .; Тарбелл, Д. С. (1963). «β- (о-Карбоксифенил) пропионовая кислота ». Органический синтез. 34: 8. Дои:10.15227 / orgsyn.034.0008.; Коллективный объем, 4, п. 136
- ^ Robinson, H.C .; Снайдер, Х. Р. (1955). «β-Фенилэтиламин». Органический синтез. 23: 71. Дои:10.15227 / orgsyn.023.0071.; Коллективный объем, 3, п. 720
- ^ Schwenk, E .; Папа, Д .; Ханкин, H .; Гинзберг, Х. (1955). «γ-н-пропилбутиролактон и β- (тетрагидрофурил) пропионовая кислота». Органический синтез. 27: 68. Дои:10.15227 / orgsyn.027.0068.; Коллективный объем, 3, п. 742
- ^ Алексакис, Алекс; Ленсен, Натали; Mangeney, Пьер (1991). "Ультразвуковое расщепление N-N связей в гидразинах никелем Ренея". Synlett. 1991 (9): 625–626. Дои:10.1055 / с-1991-20818.
- ^ Эндерс, Д .; Pieter, R .; Renger, B .; Зеебах, Д. (1988). «Нуклеофильное α-втор-аминоалкилирование: 2- (дифенилгидроксиметил) пирролиден». Органический синтез. 58: 113. Дои:10.15227 / orgsyn.058.0113.; Коллективный объем, 6, п. 542
- ^ Rice, R.G .; Кон, Э. Дж. (1963). "N,N '-Диэтилбензиден ». Органический синтез. 36: 21. Дои:10.15227 / orgsyn.036.0021.; Коллективный объем, 4, п. 283
- ^ Броня, М.-А (2003). Руководство по утилизации опасных лабораторных химикатов. CRC Press. п. 331. ISBN 1-56670-567-3.
- ^ «Паспорт безопасности материалов на алюминид никеля» (PDF). Electronic Space Products International. 1994 г.. Получено 7 июля 2009.[постоянная мертвая ссылка]
- ^ США 1563587, Мюррей Рэйни, "Метод приготовления каталитического материала", выпущенный 01 декабря 1925 г. (Оригинальный никель-кремниевый катализатор Ренея)
- ^ США 1628190, Мюррей Рэни, "Метод производства тонкодисперсного никеля", выпущенный 10 мая 1927 г.
- ^ Урушибара, Ёсиюки; Нисимура, Шигео (1957). "Способ приготовления никелевого катализатора Ренея с большей активностью". Бык. Chem. Soc. Jpn. 30 (2): 199. Дои:10.1246 / bcsj.30.199.
- ^ Августин, Роберт Л. (1996). Гетерогенный катализ для химика-синтетика. CRC Press. С. 248–249. ISBN 0-8247-9021-9.
- ^ Баккер, М. Л .; Янг, Д. Дж .; Уэйнрайт, М. С. (1988). «Селективное выщелачивание NiAl.3 и Ni2Al3 интерметаллиды с образованием никелей Ренея ". J. Mater. Sci. 23 (11): 3921–3926. Дои:10.1007 / BF01106814.
внешняя ссылка
- Международная карта химической безопасности 0062
- Карманный справочник NIOSH по химической опасности
- Статья 1941 г., описывающая получение никеля Ренея марки W-2: Мозинго, Ральф (1941). "Катализатор, никель Ренея, W-2". Органический синтез. 21: 15. Дои:10.15227 / orgsyn.021.0015.