WikiDer > Тиосульфатдегидрогеназа
| Тиосульфатдегидрогеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Трехмерная структура тиосульфатдегидрогеназы с тиосульфатным субстратом, присутствующим в активном центре, что соответствует коду RCSB 4V2K | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.8.2.2 | ||||||||
| Количество CAS | 9076-88-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Тиосульфатдегидрогеназа (сокращенно Цда) (EC 1.8.2.2) является фермент который катализирует в химическая реакция:[1]
- 2 тиосульфат + 2 феррицитохрома с тетратионат + 2 ферроцитохрома с
Таким образом, два субстраты этого фермента тиосульфат и феррицитохром с, а его два товары находятся тетратионат и ферроцитохром с.
Гомологи тиосульфатдегидрогеназы были выделены из множества видов бактерий и незначительно отличаются по структуре, но имеют аналогичные функции и механизм окисления серы. Фермент похож по функциям и структуре на несколько ферментов, участвующих в пути окисления серы Sox.[2]
Номенклатура
Этот фермент принадлежит к семейству оксидоредуктазыособенно те, которые действуют на серную группу доноров с цитохромом в качестве акцептора. В систематическое название этого класса ферментов является тиосульфат: оксидоредуктаза феррицитохрома-с. Другие широко используемые названия включают тетратионатсинтазу, тиосульфатоксидазу, тиосульфат-окисляющий фермент и тиосульфат-акцепторную оксидоредуктазу.
Структура
Тиосульфатдегидрогеназа, выделенная из хорошо изученного штамма бактерий. Аллохроматиум виносум (Длина цепи пептида 253, 25,8 кДа) состоит из двух каталитических доменов, каждый из которых подобен цитохрому. c, связанных длинной неструктурированной пептидной цепью.[3] N-концевой домен структурно гомологичен семейству цитохромных ферментов SoxA, в то время как C-концевой домен является представителем стандартного митохондриального цитохрома. c семейная складка с высоким сходством с нитритредуктазой из P. haloplanktis.[4] Каждый домен содержит ковалентно связанную железосодержащую молекулу гема, разделенную небольшим расстоянием 8,1 Å, что способствует быстрому переносу электронов.[5] Оба N- и C-концевых домена содержат 4 α-спирали (окружающие гем в соответствующем домене) и двухцепочечный антипараллельный β-лист, что позволяет предположить, что фермент возник в результате дупликации гена.[6]
Единственный активный сайт фермента расположен между двумя доменами (ближе к С-концевому домену) рядом с центральным гемом железа.
Механизм
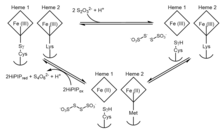
Существуют разногласия относительно точного механизма, который вызывает фермент, поэтому процесс остается неоднозначным. Кроме того, разнообразие ферментов тиосульфатдегидрогеназы среди видов бактерий предполагает несколько возможных механизмов активности.[5] Однако из-за поразительного сходства в структуре доменов тиосульфатдегидрогеназы с белком-переносчиком серы SoxYZ и цитохромом SoxAX можно вывести родственный механизм для реакции, катализируемой тиосульфатдегидрогеназой в A. vinosum. Общий обобщенный обзор предлагаемого механизма тиосульфатдегидрогеназы можно резюмировать с помощью следующих двух обратимых окислительно-восстановительных реакций:
Шаг 1 указывает на начальное связывание тиосульфата с необычным и реактивным цистеином. S-сульфановый аддукт, образующий S-тиосульфонатный аддукт. Шаг 2 следует с дополнительным тиосульфатом для последующего образования тетратионата при уменьшении обоих гемов и оставлении типичного остатка цистеина. В активном центре остаток цистеина, связанный с каталитическим гемом железа, важен для ферментативной активности, поскольку удаление этого остатка полностью устраняет способность фермента как окислять тиосульфат, так и восстанавливать тетратионат.[7] В A. vinosumНесмотря на то, что процесс обратим, реакция образования двух тиосульфат-ионов происходит намного медленнее, чем образование тетратионата, несмотря на восстановление тетратионата до тиосульфата, имеющего потенциал +198 мВ.[8]
Восстановление фермента приводит к переключению лиганда с Lys208 на Met209 во втором геме. Мутантные белки, которые заменяют Met209 аспарагином или глицином, имеют сходное сродство к субстрату с вариантом дикого типа, но имеют гораздо более низкие удельные активности, что позволяет предположить, что гем 2 является точкой выхода электрона на последних этапах механизма.[9] При восстановлении гема 2 и переключении лиганда окислительно-восстановительный потенциал увеличивается и препятствует обратной реакции с образованием тиосульфата. Здесь предполагается, что железо-серный белок с высоким потенциалом (HiPIP) служит акцептором электронов при окислении обоих гемов до их исходного состояния.
Функция
Окисление тиосульфата до тетратионата наблюдается у некоторых тиобацилл, фототрофов и гетеротрофов, поскольку тиосульфат и тетратионат играют роль донора электронов и акцептора электронов, соответственно, у многих видов бактерий.[10] Оба соединения являются промежуточными продуктами и играют важную роль в биогеохимическом цикле серы, процессе превращения сульфида в сульфат.[11] Таким образом, тиосульфатдегидрогеназа важна для превращения промежуточных продуктов в серном цикле.[12] Круговорот серы позволяет множеству бактерий использовать генерируемый тиосульфат в качестве донора электронов для аэробного роста и анаэробной фиксации диоксида углерода для фотосинтеза. Псевдомонады и Halomonas являются примерами многих тиобактерий, которые используют тиосульфатдегидрогеназу для получения энергии из тиосульфата в качестве дополнительного источника энергии.[13] Тетратионат может служить акцептором респираторных электронов во время анаэробного дыхания за счет восстановления тетратионата.
Промышленное применение
Тиобактерии, такие как Ацидитиобациллы феррооксиданы стали важными для промышленных применений биовыщелачивания, поскольку микроорганизмы способны окислять железо и серу из минералов железо-сера в качестве источников энергии, поддерживая свой собственный автотрофный рост при производстве трехвалентного железа и серной кислоты.[14] Таким образом, бактерии были выделены из месторождений полезных ископаемых и использованы для обработки упорных золотых и железных руд и обезвреживания промышленных отходов, сточных вод и почв, загрязненных тяжелыми металлами.[15]
Рекомендации
- ^ Лу В.П., Келли Д.П. (1988). «Расположение в клетке и частичная очистка« тиосульфатокисляющего фермента »и« тритионатгидролазы »из Thiobacillus tepidarius». Микробиология. 134 (4): 877–885. Дои:10.1099/00221287-134-4-877.
- ^ Бэмфорд, В. А. (2002). «Структурная основа окисления тиосульфата ферментом серного цикла». Журнал EMBO. 21 (21): 5599–5610. Дои:10.1093 / emboj / cdf566. ISSN 1460-2075. ЧВК 131063. PMID 12411478.
- ^ PDB: 4В2К; Грабарчик Д.Б., Чаппелл П.Е., Эйзель Б., Джонсон С., Ли С.М., Беркс Британская Колумбия (апрель 2015 г.). «Механизм окисления тиосульфата в семействе SoxA цитохромов, связанных с цистеином». Журнал биологической химии. 290 (14): 9209–21. Дои:10.1074 / jbc.M114.618025. ЧВК 4423706. PMID 25673696.
- ^ Грабарчик Д.Б., Чаппелл П.Е., Эйзель Б., Джонсон С., Ли С.М., Беркс BC (апрель 2015 г.). «Механизм окисления тиосульфата в семействе SoxA цитохромов, связанных с цистеином». Журнал биологической химии. 290 (14): 9209–21. Дои:10.1074 / jbc.M114.618025. ЧВК 4423706. PMID 25673696.
- ^ а б Курт Дж. М., Брито Дж. А., Рейтер Дж., Флеглер А., Кох Т., Франке Т., Кляйн Е. М., Роу С. Ф., Батт Дж. Н., Денкманн К., Перейра И. А., Арчер М., Даль С. (ноябрь 2016 г.). «Электроноакцепторные единицы цитохрома c TsdA дигема, бифункциональная тиосульфатдегидрогеназа / тетратионатредуктаза». Журнал биологической химии. 291 (48): 24804–24818. Дои:10.1074 / jbc.M116.753863. ЧВК 5122753. PMID 27694441.
- ^ Брито Дж. А., Денкманн К., Перейра И. А., Арчер М., Даль С. (апрель 2015 г.). «Тиосульфатдегидрогеназа (TsdA) из Allochromatium vinosum: структурные и функциональные сведения о окислении тиосульфата». Журнал биологической химии. 290 (14): 9222–38. Дои:10.1074 / jbc.M114.623397. ЧВК 4423707. PMID 25673691.
- ^ Денкманн К., Грейн Ф., Зиганн Р., Симен А., Бергманн Дж., Ван Хельмонт С., Николай А., Перейра И. А., Даль С. (октябрь 2012 г.). «Тиосульфатдегидрогеназа: широко распространенный необычный ацидофильный цитохром c-типа». Экологическая микробиология. 14 (10): 2673–88. Дои:10.1111 / j.1462-2920.2012.02820.x. PMID 22779704.
- ^ Курт Дж. М., Даль С., Батт Дж. Н. (октябрь 2015 г.). «Электрохимия каталитической белковой пленки обеспечивает прямое измерение потенциала восстановления тетратионата / тиосульфата». Журнал Американского химического общества. 137 (41): 13232–5. Дои:10.1021 / jacs.5b08291. PMID 26437022.
- ^ Брито Дж. А., Гутьеррес А., Денкманн К., Даль С., Арчер М. (октябрь 2014 г.). «Производство, кристаллизация и предварительный кристаллографический анализ тиосульфатдегидрогеназы Allochromatium vinosum TsdA, необычного ацидофильного цитохрома c-типа». Acta Crystallographica Раздел F. 70 (Пт 10): 1424–7. Дои:10.1107 / S2053230X14019384. ЧВК 4188095. PMID 25286955.
- ^ Келли Д.П., Вуд А.П. (1994). «Глава 36: Ферменты, участвующие в микробиологическом окислении тиосульфата и политионатов». В Peck HD, LeGall J (ред.). Метаболизм неорганической микробной серы. Методы в энзимологии. 243. С. 501–510. Дои:10.1016/0076-6879(94)43038-1. ISBN 978-0-12-182144-9.
- ^ Зопфи Дж, Фердельман Т.Г., Фоссинг Х. (2004). «Распределение и судьба промежуточных соединений серы - сульфита, тетратионата, тиосульфата и элементарной серы - в морских отложениях». In Amend JP, Edwards KJ, Lyons TW (ред.). Биогеохимия серы - прошлое и настоящее. 379. Геологическое общество Америки. С. 97–116. Дои:10.1130/0-8137-2379-5.97. ISBN 978-0-8137-2379-2.
- ^ Зиверт С., Киене Р., Шульц-Фогт Х (2007). "Серный цикл". Океанография. 20 (2): 117–123. Дои:10.5670 / oceanog.2007.55.
- ^ Подгорсек Л., Имхофф Дж. Ф. (1999). «Производство тетратионата сероокисляющими бактериями и роль тетратионата в круговороте серы в отложениях Балтийского моря» (PDF). Экология водных микробов. 17: 255–265. Дои:10.3354 / ame017255.
- ^ Босекер К. (1997). «Биовыщелачивание: солюбилизация металла микроорганизмами». Обзор микробиологии FEMS. 20 (3–4): 591–604. Дои:10.1111 / j.1574-6976.1997.tb00340.x.
- ^ Rawlings DE (май 2005 г.). «Характеристики и приспособляемость микроорганизмов, окисляющих железо и серу, используемых для извлечения металлов из минералов и их концентратов». Фабрики микробных клеток. 4 (1): 13. Дои:10.1186/1475-2859-4-13. ЧВК 1142338. PMID 15877814.