WikiDer > Сульфитоксидаза
| сульфитоксидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
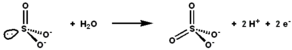 Сульфитоксидаза катализирует окислительно-восстановительную реакцию сульфита и воды с образованием сульфата. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.8.3.1 | ||||||||
| Количество CAS | 9029-38-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Сульфитоксидаза (EC 1.8.3.1) является фермент в митохондрии из всех эукариоты, за исключением дрожжей.[нужна цитата] Это окисляет сульфит к сульфат и через цитохром с, переносит образовавшиеся электроны в электронная транспортная цепь, позволяя генерировать АТФ в окислительного фосфорилирования.[5][6][7] Это последний этап метаболизма сера-содержащие соединения и сульфат выводится из организма.
Сульфитоксидаза - это металлофермент, который использует молибдоптерин кофактор и гем группа (в случае животных). Это один из цитохромы б5 и принадлежит к суперсемейству ферментов оксотрансферазы молибдена это также включает ДМСО редуктаза, ксантиноксидаза, и нитритредуктаза.
У млекопитающих уровни экспрессии сульфитоксидазы высоки в печени, почках и сердце и очень низки в селезенке, головном мозге, скелетных мышцах и крови.
Структура
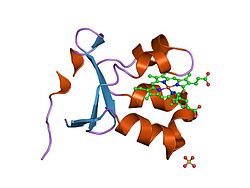
Как гомодимер, сульфитоксидаза содержит две идентичные субъединицы с N-концевой домен и C-терминал домен. Эти два домена соединены десятью аминокислоты образуя петлю. N-концевой домен имеет гем кофактор с тремя соседними антипараллельными бета-листы и пять альфа спирали. С-концевой домен содержит кофактор молибдоптерина, окруженный тринадцатью бета-листами и тремя альфа-спиралями. В молибдоптерин кофактор имеет центр Mo (VI), который связан с серой из цистеин, ен-дитиолат из пираноптерина и два концевых атома кислорода. Именно в этом центре молибдена происходит каталитическое окисление сульфита.
Активный сайт и механизм
Активный центр сульфитоксидазы содержит молибдоптерин кофактор и поддерживает молибден в его высшей степени окисления, +6 (MoVI). В окисленном состоянии фермента молибден координируется тиолатом цистеина, дитиолен группа молибдоптерина и два концевых атома кислорода (оксо). При реакции с сульфитом один атом кислорода превращается в сульфит с образованием сульфата, а центр молибдена восстанавливается на два электрона до MoIV. Затем вода вытесняет сульфат, и удаление двух протонов (H+) и два электрона (e−) возвращает активный сайт в исходное состояние. Ключевой особенностью этого фермента переноса атома кислорода является то, что переносимый атом кислорода возникает из воды, а не из дикислород (O2).
Дефицит
Сульфитоксидаза необходима для метаболизма серосодержащих аминокислот цистеина и метионин в продуктах питания. Недостаток функциональной сульфитоксидазы вызывает заболевание, известное как дефицит сульфитоксидазы. Это редкое, но смертельное заболевание вызывает неврологические расстройства, умственную отсталость, физические деформации, деградацию мозга и смерть. Причины отсутствия функциональной сульфитоксидазы включают: генетический дефект, приводящий к отсутствию молибдоптерин кофактор и точечные мутации в ферменте.[8] Мутация G473D нарушает димеризацию и катализ сульфитоксидазы человека.[9][10]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000139531 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000049858 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Д'Эррико Дж., Ди Салле А, Ла Кара Ф, Росси М., Каннио Р. (январь 2006 г.). «Идентификация и характеристика новой бактериальной сульфитоксидазы без гемсвязывающего домена из Deinococcus radiodurans». J. Bacteriol. 188 (2): 694–701. Дои:10.1128 / JB.188.2.694-701.2006. ЧВК 1347283. PMID 16385059.
- ^ Tan WH, Eichler FS, Hoda S, Lee MS, Baris H, Hanley CA, Grant PE, Krishnamoorthy KS, Shih VE (сентябрь 2005 г.). «Изолированная недостаточность сульфитоксидазы: случай с новой мутацией и обзор литературы». Педиатрия. 116 (3): 757–66. Дои:10.1542 / педс.2004-1897. PMID 16140720. S2CID 6506338.
- ^ Коэн Х. Дж., Бетчер-Ланге С., Кесслер Д. Л., Раджагопалан К. В. (декабрь 1972 г.). «Сульфитоксидаза печени. Конгруэнтность в митохондриях простетических групп и активность». J. Biol. Chem. 247 (23): 7759–66. PMID 4344230.
- ^ Каракас Э., Кискер С. (ноябрь 2005 г.). «Структурный анализ миссенс-мутаций, вызывающих изолированную недостаточность сульфитоксидазы». Dalton Transactions (21): 3459–63. Дои:10.1039 / b505789m. PMID 16234925.
- ^ Уилсон Х.Л., Уилкинсон С.Р., Раджагопалан К.В. (февраль 2006 г.). «Мутация G473D нарушает димеризацию и катализ сульфитоксидазы человека». Биохимия. 45 (7): 2149–60. Дои:10.1021 / bi051609l. PMID 16475804.
- ^ Фэн К., Толлин Г., Энемарк Дж. Х. (май 2007 г.). «Ферменты, окисляющие сульфит». Биохим. Биофиз. Acta. 1774 (5): 527–39. Дои:10.1016 / j.bbapap.2007.03.006. ЧВК 1993547. PMID 17459792.
дальнейшее чтение
- Kisker, C. «Сульфитоксидаза», Messerschimdt, A .; Huber, R .; Poulos, T .; Wieghardt, K .; ред. Справочник по металлопротеинам, том 2; John Wiley and Sons, Ltd: Нью-Йорк, 2002 г.
- Feng C, Wilson HL, Hurley JK и др. (2003). «Существенная роль консервативного аргинина 160 во внутримолекулярном переносе электронов в сульфитоксидазе человека». Биохимия. 42 (42): 12235–42. Дои:10.1021 / bi0350194. PMID 14567685.
- Ли ХФ, Мак Б.С., Чи С.С. и др. (2002). «Новая мутация в неонатальной изолированной недостаточности сульфитоксидазы». Нейропедиатрия. 33 (4): 174–9. Дои:10.1055 / с-2002-34491. PMID 12368985.
- Стейнберг К.К., Реллинг М.В., Галлахер М.Л. и др. (2007). «Генетические исследования группы случаев острого лимфобластного лейкоза в округе Черчилль, штат Невада». Environ. Перспектива здоровья. 115 (1): 158–64. Дои:10.1289 / ehp.9025. ЧВК 1817665. PMID 17366837.
- Кимура К., Вакамацу А., Сузуки Ю. и др. (2006). «Диверсификация транскрипционной модуляции: широкомасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека». Genome Res. 16 (1): 55–65. Дои:10.1101 / гр. 4039406. ЧВК 1356129. PMID 16344560.
- Уилсон Х.Л., Уилкинсон С.Р., Раджагопалан К.В. (2006). «Мутация G473D нарушает димеризацию и катализ в сульфитоксидазе человека». Биохимия. 45 (7): 2149–60. Дои:10.1021 / bi051609l. PMID 16475804.
- Хоффманн К., Бен-Зеев Б., Аникстер Ю. и др. (2007). «Магнитно-резонансная томография и магнитно-резонансная спектроскопия при дефиците изолированной сульфитоксидазы». J. Child Neurol. 22 (10): 1214–21. Дои:10.1177/0883073807306260. PMID 17940249. S2CID 24050167.
- Джонсон Дж. Л., Койн К. Э., Гарретт Р. М. и др. (2002). «Изолированная недостаточность сульфитоксидазы: выявление 12 новых мутаций SUOX у 10 пациентов». Гм. Мутат. 20 (1): 74. Дои:10.1002 / humu.9038. PMID 12112661. S2CID 45465780.
- Ву WH, Ян Х, Вонг КП, Холливелл Б. (2003). «Экспрессия гена сульфитоксидазы в мозге человека и в других тканях человека и крысы». Biochem. Биофиз. Res. Сообщество. 305 (3): 619–23. Дои:10.1016 / S0006-291X (03) 00833-7. PMID 12763039.
- Фен Ч., Уилсон Х. Л., Толлин Г. и др. (2005). «Патогенные мутанты сульфитоксидазы человека G473D и A208D обладают дефектом во внутримолекулярном переносе электронов». Биохимия. 44 (42): 13734–43. Дои:10.1021 / bi050907f. PMID 16229463.
- Tan WH, Eichler FS, Hoda S и др. (2005). «Изолированная недостаточность сульфитоксидазы: отчет о новой мутации и обзор литературы». Педиатрия. 116 (3): 757–66. Дои:10.1542 / пед.2004-1897. PMID 16140720. S2CID 6506338.
- Асташкин А.В., Джонсон-Винтерс К., Клейн Е.Л. и др. (2008). «Структурные исследования молибденового центра патогенного мутанта R160Q сульфитоксидазы человека методами импульсной ЭПР-спектроскопии и мечения 17O и 33S». Варенье. Chem. Soc. 130 (26): 8471–80. Дои:10.1021 / ja801406f. ЧВК 2779766. PMID 18529001.
- Дронов Р., Курт Д.Г., Мохвальд Х. и др. (2008). «Послойная организация за счет белок-белкового взаимодействия сульфитоксидазы и цитохрома с, катализирующих окисление сульфита». Варенье. Chem. Soc. 130 (4): 1122–3. Дои:10.1021 / ja0768690. PMID 18177044.
- Эдвардс М.С., Джонсон Дж. Л., Брак Б и др. (1999). «Изолированная недостаточность сульфитоксидазы: обзор двух случаев в одной семье». Офтальмология. 106 (10): 1957–61. Дои:10.1016 / S0161-6420 (99) 90408-6. PMID 10519592.
- Герхард Д.С., Вагнер Л., Фейнгольд Е.А. и др. (2004). «Статус, качество и расширение проекта NIH полноразмерной кДНК: Коллекция генов млекопитающих (MGC)». Genome Res. 14 (10B): 2121–7. Дои:10.1101 / гр.2596504. ЧВК 528928. PMID 15489334.
- Рудольф MJ, Джонсон JL, Раджагопалан KV, Кискер C (2003). «Структура 1.2A человеческого домена цитохрома b (5) сульфитоксидазы». Acta Crystallogr. D. 59 (Pt 7): 1183–91. Дои:10.1107 / S0907444903009934. PMID 12832761.
- Feng C, Wilson HL, Hurley JK и др. (2003). «Роль консервативного тирозина 343 во внутримолекулярном переносе электронов в сульфитоксидазе человека». J. Biol. Chem. 278 (5): 2913–20. Дои:10.1074 / jbc.M210374200. PMID 12424234.
- Нойман М, Леймкюлер С (2008). «Ионы тяжелых металлов ингибируют активность молибдоэнзима, связываясь с дитиоленовой составляющей молибдоптерина в Escherichia coli». FEBS J. 275 (22): 5678–89. Дои:10.1111 / j.1742-4658.2008.06694.x. PMID 18959753. S2CID 45452761.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2002). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (26): 16899–903. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Уилсон Х.Л., Раджагопалан К.В. (2004). «Роль тирозина 343 в связывании субстрата и катализе сульфитоксидазой человека». J. Biol. Chem. 279 (15): 15105–13. Дои:10.1074 / jbc.M314288200. PMID 14729666.
- Hakonarson H, Qu HQ, Bradfield JP и др. (2008). «Новый локус восприимчивости к диабету 1 типа на Chr12q13, идентифицированный в результате полногеномного исследования ассоциации». Сахарный диабет. 57 (4): 1143–6. Дои:10.2337 / db07-1305. PMID 18198356.
внешняя ссылка
- Сульфит + оксидаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Исследовательская деятельность Sarkar Group
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для сульфитоксидазы человека, митохондриальной