WikiDer > Ингибитор Β-лактамазы
Бета-лактамазы семья ферменты участвует в бактериальном сопротивление к бета-лактамные антибиотики. Они действуют, нарушая бета-лактам кольцо, которое позволяет пенициллин-как антибиотики работают. Стратегии борьбы с этой формой устойчивости включают разработку новых бета-лактамных антибиотиков, которые более устойчивы к расщеплению, и разработку класса антибиотиков. ингибиторы ферментов называется ингибиторы бета-лактамаз.[1] Хотя ингибиторы β-лактамаз обладают небольшой собственной антибиотической активностью,[2] они предотвращают бактериальную деградацию бета-лактамных антибиотиков и, таким образом, расширяют круг бактерий, против которых действуют лекарства.
Медицинское использование
Наиболее важное применение ингибиторов бета-лактамаз - это лечение инфекций, которые, как известно или предположительно, вызваны: грамотрицательные бактерии, поскольку продукция бета-лактамазы является важным фактором устойчивости к бета-лактамам у этих патогенов. Напротив, большая часть устойчивости к бета-лактамам у грамположительные бактерии связано с вариациями в пенициллин-связывающие белки что приводит к снижению связывания с бета-лактамом.[3][4] Грамположительный возбудитель Золотистый стафилококк продуцирует бета-лактамазы, но ингибиторы бета-лактамаз играют меньшую роль в лечении этих инфекций, потому что наиболее устойчивые штаммы (метициллин-устойчивый Золотистый стафилококк) также используют вариантные пенициллин-связывающие белки.[5][6]
Механизм действия
Система классификации Амблера группирует известные ферменты бета-лактамазы на четыре группы в соответствии с гомологией последовательностей и предполагаемыми филогенетическими связями. Классы A, C и D расщепляют бета-лактамы по многоступенчатому механизму, аналогичному механизму сериновые протеазы. При связывании гидроксильная группа серина в активном сайте бета-лактамазы образует временную ковалентную связь с карбонильной группой бета-лактамного кольца, расщепляя при этом бета-лактамное кольцо. На втором этапе нуклеофильная атака со стороны молекулы воды расщепляет ковалентную связь между ферментом и карбонильной группой бывшего бета-лактама. Это позволяет разложившемуся бета-лактаму диффундировать и высвобождает фермент для обработки дополнительных молекул бета-лактама.
Доступные в настоящее время ингибиторы бета-лактамаз эффективны против бета-лактамаз Ambler класса A (тазобактам, клавуланат и сульбактам) или против бета-лактамаз Ambler класса A, C и некоторых бета-лактамаз класса D (авибактам). Как и бета-лактамные антибиотики, они обрабатываются бета-лактамазами с образованием исходного ковалентного промежуточного соединения. В отличие от бета-лактамных антибиотиков, ингибиторы действуют как субстраты самоубийства (тазобактам и сульбактам), что в конечном итоге приводит к деградации бета-лактамазы.[7] С другой стороны, авибактам не содержит бета-лактамного кольца (не ингибитор бета-лактамной бета-лактамазы) и вместо этого связывает обратимо.[8][9]
Бета-лактамазы Ambler класса B расщепляют бета-лактамы по механизму, аналогичному механизму металлопротеазы. Поскольку ковалентный промежуточный продукт не образуется, механизм действия имеющихся на рынке ингибиторов бета-лактамаз неприменим. Таким образом, распространение бактериальных штаммов, экспрессирующих металло-бета-лактамазы, такие как Нью-Дели металло-бета-лактамаза 1 вызывает серьезную озабоченность.[10]
Обычно используемые агенты
Продаваемые в настоящее время ингибиторы β-лактамаз не продаются как отдельные препараты. Вместо этого они смешиваются с β-лактамным антибиотиком с аналогичным периодом полужизни в сыворотке. Это делается не только для удобства дозирования, но и для минимизации развития резистентности, которая может возникнуть в результате различного воздействия того или иного препарата. Основные классы β-лактамных антибиотиков, используемых для лечения грамотрицательных бактериальных инфекций, включают (в приблизительном порядке внутренней устойчивости к расщеплению β-лактамазами) пенициллины (особенно аминопенициллины и уреидопенициллины), цефалоспорины 3-го поколения и карбапенемы. Отдельные варианты β-лактамазы могут нацеливаться на один или многие из этих классов лекарственных средств, и только подмножество будет подавляться данным ингибитором β-лактамазы.[9] Ингибиторы β-лактамаз расширяют полезный спектр этих β-лактамных антибиотиков путем ингибирования ферментов β-лактамаз, продуцируемых бактериями, для их дезактивации.[11]
- Ингибиторы β-лактамаз с β-лактамным ядром:
- Тебипенем является первым карбапенемом, который вводится перорально в форме тебипенема-пивоксила. Структурные и кинетические исследования тебипенема доступны с М. туберкулез бета-лактамаза (BlaC).[12]
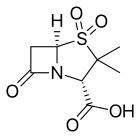
- Клавулановая кислота или клавуланат, обычно в сочетании с амоксициллин (Аугментин) или же тикарциллин (Тиментин)
- Сульбактам, обычно в сочетании с ампициллин (Unasyn) или же цефоперазон (Сульперазон)
- Тазобактам, обычно в сочетании с пиперациллин (Зосин и Тазоцин)
- Ингибиторы β-лактамаз без ядра β-лактама:
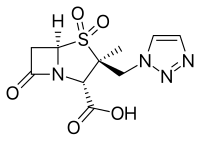
- Авибактам, одобрено в сочетании с цефтазидим (Avycaz), в настоящее время проходят клинические испытания для комбинации с цефтаролин
- Relebactam, используется в сочетании с имипенем / циластатин (Recarbrio).[13][14]
- Ваборбактам, используется в сочетании с меропенем (Vabomere)[15]
Бактерии, продуцирующие бета-лактамазы
Бактерии, которые могут продуцировать бета-лактамазы, включают, но не ограничиваются:
- Стафилококк
- MRSA(Метициллин-резистентный золотистый стафилококк)
- Энтеробактерии:
- Haemophilus influenzae
- Neisseria gonorrhoeae
- Синегнойная палочка
- Микобактерии туберкулеза
Исследование
Некоторые бактерии могут производить β-лактамазы расширенного спектра (БЛРС), что затрудняет лечение инфекции и придает дополнительную устойчивость пенициллины, цефалоспорины, и монобактамы.[16]Бороновая кислота производные в настоящее время проходят обширные и обширные исследования в качестве новых ингибиторов активного центра для бета-лактамаз, поскольку они содержат сайт, который имитирует переходное состояние, через которое проходят бета-лактамы при гидролизе с помощью бета-лактамаз. Было обнаружено, что они, как правило, хорошо вписываются в активный центр многих бета-лактамаз и обладают удобным свойством быть неспособными гидролизоваться и, следовательно, оказываются бесполезными. Это предпочтительный дизайн лекарств по сравнению со многими клинически используемыми конкурирующими агентами, потому что большинство из них, такие как клавулановая кислота, гидролизуются и, следовательно, могут использоваться только в течение ограниченного периода времени. Это обычно вызывает потребность в более высокой концентрации конкурентного ингибитора, чем это было бы необходимо для негидролизуемого ингибитора. Различные производные бороновой кислоты могут быть адаптированы ко многим различным изоформам бета-лактамаз и, следовательно, могут восстанавливать эффективность бета-лактамных антибиотиков.[17]
Рекомендации
- ^ Essack SY (октябрь 2001 г.). «Разработка бета-лактамных антибиотиков в ответ на эволюцию бета-лактамаз». Фармацевтические исследования. 18 (10): 1391–9. Дои:10.1023 / а: 1012272403776. PMID 11697463. S2CID 34318096.
- ^ «Ингибиторы бета-лактамаз». Отделение сестринского дела Государственный университет Форт-Хейса Колледж здоровья и наук о жизни. Октябрь 2000 г. Архивировано с оригинал на 2007-09-27. Получено 2007-08-17.
- ^ Georgopapadakou NH (октябрь 1993 г.). «Пенициллин-связывающие белки и устойчивость бактерий к бета-лактамам». Противомикробные препараты и химиотерапия. 37 (10): 2045–53. Дои:10.1128 / aac.37.10.2045. ЧВК 192226. PMID 8257121.
- ^ Запун А., Контрерас-Мартель С., Верне Т. (март 2008 г.). «Пенициллин-связывающие белки и устойчивость к бета-лактамам». Обзор микробиологии FEMS. 32 (2): 361–85. Дои:10.1111 / j.1574-6976.2007.00095.x. PMID 18248419.
- ^ Курелло Дж., Макдугалл С. (июль 2014 г.). «Помимо восприимчивости и устойчивости, Часть II: Лечение инфекций, вызванных грамотрицательными организмами, продуцирующими β-лактамазы расширенного спектра». Журнал детской фармакологии и терапии. 19 (3): 156–64. Дои:10.5863/1551-6776-19.3.156. ЧВК 4187532. PMID 25309145.
- ^ Wolter DJ, Lister PD (2013). «Механизмы устойчивости к β-лактамам синегнойной палочки». Текущий фармацевтический дизайн. 19 (2): 209–22. Дои:10.2174/13816128130203. PMID 22894618.
- ^ Патрик, Грэм Л. (2017). Введение в медицинскую химию (6-е изд.). Оксфорд, Великобритания. ISBN 9780198749691. OCLC 987051883.
- ^ Лахири С.Д., Мангани С., Дюран-Ревиль Т., Бенвенути М., Де Лука Ф., Саньял Дж., Докье Д. Д. (июнь 2013 г.). «Структурное понимание мощного ингибирования широкого спектра действия с обратимым механизмом рециклизации: авибактам в комплексе с CTX-M-15 и β-лактамазами AmpC Pseudomonas aeruginosa». Противомикробные препараты и химиотерапия. 57 (6): 2496–505. Дои:10.1128 / AAC.02247-12. ЧВК 3716117. PMID 23439634.
- ^ а б Drawz SM, Bonomo RA (январь 2010 г.). «Три десятилетия ингибиторов бета-лактамаз». Обзоры клинической микробиологии. 23 (1): 160–201. Дои:10.1128 / CMR.00037-09. ЧВК 2806661. PMID 20065329.
- ^ Биденбах Д., Бушильон С., Хакель М., Хобан Д., Казмерчак К., Хоузер С., Бадал Р. (февраль 2015 г.). «Распространение генов металло-β-лактамаз NDM среди клинических изолятов Enterobacteriaceae, собранных в ходе глобального надзорного исследования SMART с 2008 по 2012 год». Противомикробные препараты и химиотерапия. 59 (2): 826–30. Дои:10.1128 / AAC.03938-14. ЧВК 4335866. PMID 25403666.
- ^ Watson ID, Стюарт MJ, Platt DJ (сентябрь 1988 г.). «Клиническая фармакокинетика ингибиторов ферментов в антимикробной химиотерапии». Клиническая фармакокинетика. 15 (3): 133–64. Дои:10.2165/00003088-198815030-00001. PMID 3052984. S2CID 2388750.
- ^ Хазра С., Сюй Х, Бланшар Дж. С. (июнь 2014 г.). «Тебипенем, новый антибиотик карбапенема, представляет собой медленный субстрат, который ингибирует β-лактамазу из Mycobacterium tuberculosis». Биохимия. 53 (22): 3671–8. Дои:10.1021 / bi500339j. ЧВК 4053071. PMID 24846409.
- ^ «FDA одобрило новое лечение осложненных мочевыводящих путей и интраабдоминальных инфекций». Управление по контролю за продуктами и лекарствами. 17 июля 2019.
- ^ «Циластатин / имипенем / релебактам - AdisInsight». Springer International Publishing AG. Получено 29 апреля 2016.
- ^ «FDA одобрило новый антибактериальный препарат» (Пресс-релиз). Управление по контролю за продуктами и лекарствами. 29 августа 2017 года.
- ^ Ливермор DM (октябрь 1995 г.). «Бета-лактамазы в лабораторной и клинической резистентности». Обзоры клинической микробиологии. 8 (4): 557–84. Дои:10,1128 / см. 8.4.557. ЧВК 172876. PMID 8665470.
- ^ Леонард Д.А., Бономо Р.А., Пауэрс Р.А. (ноябрь 2013 г.). «Β-лактамазы класса D: переоценка через пять десятилетий». Отчеты о химических исследованиях. 46 (11): 2407–15. Дои:10.1021 / ar300327a. ЧВК 4018812. PMID 23902256.
внешняя ссылка
- Сюй Х., Хазра С., Бланшар Дж. С. (июнь 2012 г.). «NXL104 необратимо ингибирует β-лактамазу Mycobacterium tuberculosis». Биохимия. 51 (22): 4551–7. Дои:10.1021 / bi300508r. ЧВК 3448018. PMID 22587688.
- Курц С.Г., Вольф К.А., Хазра С., Бетел С.Р., Худжер А.М., Смит К.М., Сюй Й., Тремблей Л.В., Бланшар Д.С., Нгуен Л., Бономо Р.А. (декабрь 2013 г.). «Могут ли устойчивые к ингибитору замены β-лактамазы BlaC Mycobacterium tuberculosis привести к устойчивости к клавуланату?: Биохимическое обоснование использования комбинаций ингибиторов β-лактам-β-лактамаз». Противомикробные препараты и химиотерапия. 57 (12): 6085–96. Дои:10.1128 / AAC.01253-13. ЧВК 3837893. PMID 24060876.