WikiDer > Синдром передней мозговой артерии - Википедия
| Синдром передней мозговой артерии | |
|---|---|
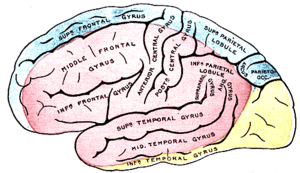 | |
| Наружная поверхность полушария головного мозга с участками, снабжаемыми артериями головного мозга. (Синий - это область, снабжаемая передней мозговой артерией.) | |
| Специальность | Неврология |
Синдром передней мозговой артерии это состояние, при котором кровоснабжение передняя мозговая артерия (ACA) ограничен, что приводит к снижению функции частей мозг снабжается этим сосудом: медиальные аспекты лобной и теменной долей, базальный ганглий, передний свод и передний мозолистое тело.[1]
В зависимости от области и степени окклюзии признаки и симптомы могут варьироваться в зависимости от популяции, пораженной синдромом ACA. Закупорка проксимального (A1) сегмента сосуда вызывает лишь незначительный дефицит из-за коллатерального кровотока из противоположного полушария через передняя соединительная артерия. Окклюзия дистальнее этого сегмента приведет к более тяжелому проявлению синдрома ACA. Контралатеральный гемипарез потеря полусенсора нижних конечностей является наиболее частым симптомом, связанным с синдромом ACA.[1]
Признаки и симптомы
- Гемипарез или же гемиплегия контралатерально, в первую очередь, нижние конечности и тазовое дно мускулатура
- Сенсорный дефицит на противоположной стороне, в первую очередь на ногу и промежность
- Апраксия (из-за ответвлений на дополнительная моторная зона и мозолистое тело)[1]
- Синдром отключения (из-за мозолистых ветвей)
- Аносмия (за счет ветвей обонятельной луковицы и обонятельного тракта)
- Недержание мочи[1]
- Хватательный рефлекс и или сосательный рефлекс контралатерально (если круг Уиллиса скомпрометирован)[1]
Диагностика
При подозрении на острый ишемический инсульт стандартная оценка включает выполнение рутинной оценки дыхательных путей, дыхания и кровообращения, проверку уровня глюкозы в крови, выполнение валидированной оценки по шкале тяжести инсульта и точный, сфокусированный сбор анамнеза относительно времени появления симптома или последнего хорошо известного или исходного уровня . Шкала инсульта Национального института здоровья (NIHSS) - это стандартизированный метод количественной оценки симптомов инсульта. Это предпочтительная система баллов, и баллы варьируются от 0 до 42. Пациент с более высоким баллом по этой шкале с большей вероятностью будет считаться инвалидом; однако определение «инвалидности» зависит от возраста, рода занятий, сопутствующих заболеваний, ограничивающих жизнь, и предварительных указаний.
Решающим шагом в оценке пациентов, перенесших инсульт, является получение изображений головного мозга для определения типа и характеристик инсульта. В связи с этим предпочтительным методом визуализации является неконтрастная компьютерная томография головы. Ишемические изменения можно разделить на острые, подострые и хронические, в зависимости от времени, в течение которого они проявляются после начала инсульта. Компьютерная томография также может исключить внутричерепное кровоизлияние [18]. Если присутствует внутричерепное кровоизлияние, следует исследовать разрыв аневризмы, учитывая его связь с артериальным вазоспазмом, приводящим к инсульту [3]. Удары передней мозговой артерии могут быть пропущены при визуализирующих исследованиях в зависимости от их расположения или размера. Одна серия случаев показала, что 37,5% (6 из 16) инфарктов ACA, оцененных с помощью КТ, были идентифицированы только после введения контрастного вещества или ангиографии. Если область гиподности мала и локализуется над бороздой, инфаркт можно не заметить. [1] [13] После неконтрастной КТ головы следует быстро провести КТ-ангиографию головы и шеи, чтобы ускорить выявление окклюзии внутричерепных крупных сосудов.
Обнаружение гиперплотного поражения в ПМА на компьютерной томографии помогает в диагностике инсульта в его острой фазе, особенно когда иначе его трудно установить. Частота этого признака при инфарктах ПМА аналогична таковой на территориях средней мозговой артерии и заднего кровообращения [19].
Как и при инсультах, затрагивающих другие области головного мозга, магнитно-резонансная томография также имеет решающее значение в диагностике инсультов ACA. МРТ с диффузионно-весовой визуализацией - очень полезный метод, который облегчает установление границ ишемии на территории ПМА. [3] [18] МР-ангиография может быть полезным дополнением при оценке механизмов инсульта. [7] Цель выполнения КТ или МРТ головы должна быть не более 25 минут до прибытия пациента.
Национальные институты неврологических расстройств и инсульта (NINDS) установили целевые временные рамки для оценки пациентов, перенесших инсульт: от двери к врачу менее 10 минут, от двери до команды инсульта менее 15 минут, от двери до КТ менее 25 минут, от двери до врача. препарат менее 60 мин. [20]
Наряду с точным анамнезом и ранней визуализацией, лабораторные исследования, включая определение уровня глюкозы в капиллярной крови, общий анализ крови с тромбоцитами, химический анализ, исследования коагуляции, гемоглобина A1c, липидная панель и маркеры гиперкоагуляции или воспаления, могут быть полезны для выявления факторов риска или установления этиологии инсульта. Контрольный список лекарств является неотъемлемой частью оценки, особенно недавнего использования антикоагулянтов, поскольку противопоказания к тромболитической терапии должны быть быстро оценены. Сердечные источники эмболии могут быть оценены в рамках исследования с помощью мониторинга ЭКГ и эхокардиограммы.
Управление
Пульсоксиметрия может помочь в использовании дополнительного кислорода для поддержания насыщения кислородом более 94%. Следует избегать гипероксии, поскольку она может быть опасной при инсульте. Гипертония часто встречается при остром ишемическом инсульте. Низкое АД встречается редко и может указывать на обострение симптомов предыдущего инсульта из-за плохой перфузии. Необходимо лечение артериального давления 220/120 мм рт. Ст. Существует консенсусный подход, разрешающий разрешающую гипертензию до 220/120 мм рт.ст. для пациентов, которые не являются кандидатами на тромболизис. [21]
Однако для пациента, который является потенциальным кандидатом на введение альтеплазы, попытка контролировать АД должна быть предпринята немедленно, поскольку целевое АД для инициации внутривенного введения альтеплазы составляет 185/110 мм рт. Обычно рекомендуются титруемые внутривенные гипотензивные препараты короткого действия, чтобы избежать слишком сильного падения АД, когда пациент достиг цели. Гипотензивные средства, которые могут быть вариантами, включают лабеталол, никардипин, клевидипин, гидралазин, эналаприлат. [21]
Пациентам, находящимся в терапевтическом окне, следует принять решение о лечении внутривенным введением рекомбинантного тканевого плазминогена (менее 4,5 часов от появления симптомов) или о эндоваскулярном лечении с помощью механической тромбэктомии. Начало внутривенного лечения альтеплазой в интервале от 3 до 4,5 часов является текущей рекомендацией для пациентов в возрасте до 80 лет, отсутствия в анамнезе как сахарного диабета, так и предшествующего инсульта, использования антикоагулянтов и оценки по шкале NIHSS менее 25. Только пациенты с симптомами инвалидности считаются подходящими для тромболитического лечения. Право на участие, а также абсолютные и относительные противопоказания должны пройти быструю оценку. Рандомизированные контролируемые исследования показали, что внутривенное введение рекомбинантного тканевого активатора плазминогена (альтеплазы) снижает функциональную инвалидность с абсолютным снижением риска на 7–13% по сравнению с плацебо. [21]
К сожалению, более половины пациентов прибывают после закрытия этого временного окна и не имеют права на тромболизис. Задержки в лечении могут быть следствием неспособности приписать симптомы инсульта пациенту, и, кроме того, риск причинения вреда увеличивается со временем, прошедшим с момента появления симптомов [21]. Эта ситуация может вызывать особую озабоченность при инсульте ACA, учитывая их иногда нетипичное проявление.
Эндоваскулярное лечение с механической тромбэктомией (МТ) - еще один проверенный метод лечения пациентов с острым инсультом, страдающих окклюзией большого сосуда, хотя эффективность лечения сильно зависит от времени. Процедура доступна в больницах третичного уровня, так как требует наличия инсультной бригады, обладающей опытом для своевременной визуализации и вмешательства. Одно исследование, оценивающее МТ у пациентов с инсультом ACA, показало, что, хотя частота реканализации была высокой, в остальном результаты были неудовлетворительными. Последнее было связано с увеличением объема инфаркта и продолжительностью реканализации [22] [23].
Новые руководящие принципы рекомендуют пациентам с острым ишемическим инсультом в течение 6–24 часов после последней известной скважины и у которых имеется окклюзия крупных сосудов в переднем отделе кровообращения, рекомендуется проведение КТР, DW-МРТ или перфузии МРТ для облегчения выбора для механической тромбэктомии. Однако это происходит только при строгом применении визуализации или других критериев отбора из РКИ, показывающих преимущества при отборе пациентов для МТ. В исследовании DAWN использовалось несоответствие клинической визуализации (визуализация с помощью CTP или DW-MRI и оценка по шкале NIHSS) в качестве критериев для отбора пациентов с передним кровообращением LVO для MT между 6 и 24 часами от последней известной скважины. Испытание продемонстрировало общее функциональное преимущество через 90 дней в группе лечения (оценка mRS от 0 до 2, 49% против 13%, скорректированная разница 33%, 95% ДИ, от 21 до 44; вероятность превосходства выше 0,999). В исследовании DEFUSE 3 в качестве критериев отбора пациента для МТ с ЛЖ в переднем кровотоке использовались несоответствие перфузионного ядра и максимальный размер ядра. Это испытание также показало улучшение результатов через 90 дней в группе лечения (оценка mRS от 0 до 2, 44,6% против 16,7%, ОР 2,67, 95% ДИ, 1,60–4,48, p больше 0,0001). DAWN и DEFUSE 3 - единственные испытания, демонстрирующие пользу механической тромбэктомии более чем через 6 часов с момента появления симптомов. Только критерии этих испытаний должны быть жизнеспособными для отбора пациентов, которым может помочь МТ. [21] Следует знать, что у большинства пациентов, участвовавших в исследованиях DAWN и DEFUSE 3, была окклюзия средней мозговой артерии.
Помимо неотложного лечения инсульта, для предотвращения рецидивов следует использовать гипотензивные средства, двойную антитромбоцитарную терапию, антикоагулянты, эндартерэктомию сонной артерии. Антиагрегантная терапия или антикоагулянты не рекомендуются в течение 24 часов после введения альтеплазы. Аспирин не рекомендуется в качестве замены других вмешательств при остром инсульте. Введение ингибитора рецепторов гликопротеина IIb / IIIa не рекомендуется, и недавний Кокрановский обзор показал, что эти агенты коррелируют с высоким риском внутричерепного кровоизлияния. Двойную антитромбоцитарную терапию (аспирин и клопидогрель) рекомендуется начинать в течение 24 часов в течение 21 дня пациентам с легким инсультом для ранней профилактики вторичного инсульта. Исследование CHANCE показало, что первичный результат повторного инсульта через 90 дней был в пользу двойной антитромбоцитарной терапии по сравнению с одним аспирином (HR 0,68; 95% ДИ, 0,57–0,81, p <0,0001). Тикагрелор перед аспирином при лечении острого инсульта не рекомендуется. Согласно исследованию SOCRATES с первичным результатом времени до комбинированной конечной точки инсульта, ИМ или смерти до 90 дней, тикагрелор не превосходил аспирин (HR 0,89, 95% ДИ 0,78–1,01; p = 0,07). . Однако тикагрелор является разумной альтернативой пациентам с противопоказаниями к аспирину. Эффективность тирофибана и эптифибатида в настоящее время неизвестна. [21] [20]
Оптимизация факторов риска имеет важное значение для вторичной профилактики инсульта, чтобы улучшить исходы основного события [21].
Рекомендации
1.Kubis N, Guichard JP, Woimant F. Изолированные инфаркты передней мозговой артерии: серия из 16 пациентов. Цереброваск. Dis. 1999 май-июнь; 9 (3): 185-7. [PubMed] 2. Чандра А., Ли В.А., Стоун С.Р., Гэн X, Дин Ю. Церебральное кровообращение и цереброваскулярные заболевания I: Анатомия. Brain Circ. 2017 апрель-июнь; 3 (2): 45-56. [Бесплатная статья PMC] [PubMed] 3.Кумрал Э., Баюлкем Г., Эвьяпан Д., Юнтен Н. Спектр инфаркта территории передней мозговой артерии: клинические данные и результаты МРТ. Евро. J. Neurol. 2002 ноя; 9 (6): 615-24. [PubMed] 4.Тойода К. Инфаркт передней мозговой артерии и артерии Хойбнера. Front Neurol Neurosci. 2012; 30: 120-2. [PubMed] 5.Кришнан М., Кумар С., Али С., Айер Р.С. Внезапный двусторонний инфаркт переднего мозга: необычный инсульт, связанный с необычными сосудистыми аномалиями. Postgrad Med J. 2013 февраль; 89 (1048): 120-1. [PubMed] 6.Arboix A, García-Eroles L, Sellarés N, Raga A, Oliveres M, Massons J. Инфаркт в области передней мозговой артерии: клиническое исследование 51 пациента. BMC Neurol. 2009 июл 09; 9:30. [Бесплатная статья PMC] [PubMed] 7. Кан С.Ю., Ким Дж. С.. Инфаркт передней мозговой артерии: механизм инсульта и клинико-визуализационное исследование у 100 пациентов. Неврология. 10 июня 2008 г .; 70 (24, п. 2): 2386-93. [PubMed] 8.Hensler J, Jensen-Kondering U, Ulmer S, Jansen O. Спонтанное расслоение передней мозговой артерии: метаанализ литературы и трех недавних случаев. Нейрорадиология. 2016 Октябрь; 58 (10): 997-1004. [PubMed] 9. Мохиндра С., Ковай П., Чабра Р. Смертельные двусторонние территориальные инфаркты ВСА после апоплексии гипофиза: отчет о болезни и обзор литературы. Основание черепа. 2010 июл; 20 (4): 285-8. [Бесплатная статья PMC] [PubMed] 10. Курре В., Форлендер К., Агилар-Перес М., Шмид Э., Безнер Х., Хенкес Х. Частота и актуальность эмболии передней мозговой артерии, вызванной механической тромбэктомией окклюзии средней мозговой артерии. AJNR Am J Neuroradiol. 2013 август; 34 (8): 1606-11. [PubMed] 11. Nagaratnam N, Davies D, Chen E. Клинические эффекты инфаркта передней мозговой артерии. J Stroke Cerebrovasc Dis. 1998 ноябрь-декабрь; 7 (6): 391-7. [PubMed] 12.Богоуславский Дж., Мартин Р., Мулен Т. Гомолатеральная атаксия и парез голени: синдром инфаркта территории передней мозговой артерии. J. Neurol. Нейрохирургия. Психиатрия. 1992 декабрь; 55 (12): 1146-9. [Бесплатная статья PMC] [PubMed] 13.Хониг А., Элиаху Р., Ауриэль Э. Ограниченный инфаркт передней мозговой артерии, проявляющийся в виде изолированной односторонней осевой слабости. J. Neurol. Sci. 2017 15 февраля; 373: 18-20. [PubMed] 14.Кобаяси С., Маки Т., Кунимото М. Клинические симптомы двустороннего инфаркта территории передней мозговой артерии. J Clin Neurosci. 2011 Февраль; 18 (2): 218-22. [PubMed] 15. Эдлоу Дж. А., Селим М. Х. Атипичные проявления острых цереброваскулярных синдромов. Lancet Neurol. 2011 июн; 10 (6): 550-60. [PubMed] 16. Нисида Ю., Ириока Т., Секигути Т., Мидзусава Х. Чистый сенсорный инфаркт в области передней мозговой артерии. Неврология. 20 июля 2010 г .; 75 (3): 287. [PubMed] 17. Бежот Й, Кайе М., Оссеби Г. В., Диди Р., Бен Салем Д., Моро Т., Жиру М. Непроизвольная мастурбация и гемибаллизм после двустороннего инфаркта передней мозговой артерии. Clin Neurol Neurosurg. 2008 Февраль; 110 (2): 190-3. [PubMed] 18.Биренбаум Д., Бэнкрофт Л.В., Фельсберг Г.Дж. Визуализация при остром инсульте. West J Emerg Med. 2011 Февраль; 12 (1): 67-76. [Бесплатная статья PMC] [PubMed] 19. Дженсен У.Р., Вайс М., Циммерманн П., Янсен О., Ридель С. Знак гиперплотной передней мозговой артерии (HACAS) как маркер компьютерной томографии для острой ишемии на территории передней мозговой артерии. Цереброваск. Dis. 2010; 29 (1): 62-7. [PubMed] 20. Джейуч Э. К., Савер Дж. Л., Адамс Х. П., Бруно А., Коннорс Дж. Дж., Демаршалк Б. М., Хатри П., Макмаллан П. У., Куреши А. И., Розенфилд К., Скотт П. А., Саммерс Д. Р., Ван Д. З., Винтермарк М., Йонас Х. , Совет по инсульту Американской кардиологической ассоциации. Совет по уходу за сердечно-сосудистыми заболеваниями. Совет по заболеваниям периферических сосудов. Совет по клинической кардиологии. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Гладить. 2013 Март; 44 (3): 870-947. [PubMed] 21. Пауэрс В.Дж., Рабинштейн А.А., Акерсон Т., Адеойе О.М., Бамбакидис Н.С., Беккер К., Биллер Дж., Браун М., Демаршалк Б.М., Хох Б., Джауч Е.С., Кидвелл С.С., Лесли-Мазви Т.М., Овбиагеле Б. PA, Sheth KN, Southerland AM, Summers DV, Tirschwell DL., Совет Американской кардиологической ассоциации по инсульту. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом 2018 г .: Руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Гладить. Март 2018; 49 (3): e46-e110. [PubMed] 22. Мусука Т.Д., Уилтон С.Б., Трабулси М., Хилл Мэриленд. Диагностика и лечение острого ишемического инсульта: скорость имеет решающее значение. CMAJ. 2015 8 сентября; 187 (12): 887-93. [Бесплатная статья PMC] [PubMed] 23. Юно Дж., Камеда К., Оцудзи Р., Рен Н., Нагаока С., Казуши М., Икай Й., Ги Х. Механическая тромбэктомия при острой окклюзии передней мозговой артерии. World Neurosurg. 2018 декабрь; 120: e957-e961. [PubMed] 24. Аллен СМ. Дифференциальный диагноз острого инсульта: обзор. JR Soc Med. 1984 Октябрь; 77 (10): 878-81. [Бесплатная статья PMC] [PubMed] 25. Гери Д., Онг Э., Нигхогосян Н. Обратимость акинетического мутизма после терапии L-допа при одностороннем инфаркте левой передней мозговой артерии. Нейроказ. 2017 Апрель; 23 (2): 171-172. [PubMed]
Рекомендации
внешняя ссылка
| Классификация |
|---|