WikiDer > Гидроксид бария
 | |
 | |
| Идентификаторы | |
|---|---|
| |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.037.470 |
| Номер ЕС |
|
| 846955 | |
PubChem CID | |
| Номер RTECS |
|
| UNII |
|
| |
| |
| Характеристики | |
| Ва (ОН)2 | |
| Молярная масса | 171,34 г / моль (безводный) 189,355 г / моль (моногидрат) 315,46 г / моль (октагидрат) |
| Внешность | белое твердое вещество |
| Плотность | 3,743 г / см3 (моногидрат) 2,18 г / см3 (октагидрат, 16 ° C) |
| Температура плавления | 78 ° С (172 ° F, 351 К) (октагидрат) 300 ° C (моногидрат) 407 ° C (безводный) |
| Точка кипения | 780 ° С (1440 ° F, 1050 К) |
| масса BaO (не Ba (OH)2): 1,67 г / 100 мл (0 ° С) 3,89 г / 100 мл (20 ° С) 4,68 г / 100 мл (25 ° С) 5,59 г / 100 мл (30 ° С) 8,22 г / 100 мл (40 ° С) 11,7 г / 100 мл (50 ° С) 20,94 г / 100 мл (60 ° С) 101,4 г / 100 мл (100 ° С)[нужна цитата] | |
| Растворимость в других растворителях | низкий |
| Основность (пKб) | 0,15 (первая OH–), 0,64 (второй OH–)[1] |
| -53.2·10−6 см3/ моль | |
| 1,50 (октагидрат) | |
| Структура | |
| восьмигранный | |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -944,7 кДж / моль |
| Опасности | |
| Паспорт безопасности | Видеть: страница данных |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H302, H314, H318, H332, H412 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой анионы | Оксид бария Перекись бария |
Другой катионы | Гидроксид кальция Гидроксид стронция |
| Страница дополнительных данных | |
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ |
| УФ, ИК, ЯМР, РС | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гидроксид бария это химическое соединение с химическая формула Ва (ОН)2(ЧАС2O)Икс. Моногидрат (x = 1), известный как барита или барита-вода, является одним из основных соединений барий. Этот белый гранулированный моногидрат это обычная коммерческая форма.
Подготовка и состав
Гидроксид бария можно получить растворением оксид бария (BaO) в воде:
- BaO + 9 H2О → Ва (ОН)2· 8H2О
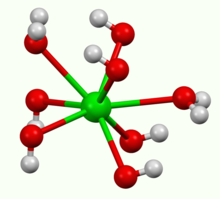
Он кристаллизуется в виде октагидрата, который при нагревании на воздухе превращается в моногидрат. При 100 ° C в вакууме моногидрат будет давать BaO и воду.[2] Моногидрат имеет слоистую структуру (см. Рисунок выше). Ба2+ центры принимают квадратную антипризматическую геометрию. Каждый Ба2+ центр связан двумя водными лигандами и шестью гидроксидными лигандами, которые соответственно дважды и трехкратно соединены мостиком с соседним Ba2+ сайты центра.[3] В октагидрате особь Ba2+ центры снова восьмикоординатные, но не имеют общих лигандов.[4]
Использует
В промышленности гидроксид бария используется в качестве предшественника других соединений бария. Моногидрат используется для обезвоживания и удаления сульфата из различных продуктов.[5] В этом приложении используется очень низкая растворимость сульфата бария. Это промышленное применение также применяется в лабораторных условиях.
Лаборатория использует
Гидроксид бария используется в аналитическая химия для титрование из слабые кислоты, особенно органические кислоты. Его прозрачный водный раствор гарантированно не содержит карбонатов, в отличие от едкий натр и гидроксид калия, в качестве карбонат бария не растворяется в воде. Это позволяет использовать такие индикаторы, как фенолфталеин или же тимолфталеин (со щелочным изменением цвета) без риска ошибок титрования из-за наличия карбонат ионы, которые являются гораздо менее основными.[6]
Гидроксид бария иногда используется в органический синтез как сильное основание, например, для гидролиза сложных эфиров[7] и нитрилы,[8][9][10] и как база в альдольные конденсации.
Он был использован для гидролиза одной из двух эквивалентных сложноэфирных групп в диметилхендекандиоате.[11]
Гидроксид бария также используется при декарбоксилировании аминокислот с высвобождением карбоната бария в процессе.[12]
Он также используется при приготовлении циклопентанон,[13] диацетоновый спирт[14] и D-гулоновый γ-лактон.[15]
Реакции
Гидроксид бария разлагается до оксид бария при нагревании до 800 ° С. Реакция с углекислый газ дает карбонат бария. Его водный раствор, будучи сильно щелочным, вступает в реакцию нейтрализации кислотами. Таким образом, формируется сульфат бария и фосфат бария с серной и фосфорной кислотами соответственно. Реакция с сероводород производит сульфид бария. Осаждение многих нерастворимых или менее растворимых солей бария может быть результатом реакции двойного замещения, когда водный раствор гидроксида бария смешивают со многими растворами солей других металлов.[16]
Реакции гидроксида бария с аммоний соли сильно эндотермический. Реакция октагидрата гидроксида бария с хлорид аммония[17][18] или же[19] тиоцианат аммония[19][20] часто используется в качестве демонстрации химии в классе, обеспечивая достаточно низкую температуру, чтобы заморозить воду, и достаточное количество воды для растворения полученной смеси.
Безопасность
Гидроксид бария представляет те же опасности, что и другие сильные основы и, как и другие водорастворимые соединения бария: он агрессивен и токсичен.[нужна цитата]
Смотрите также
Рекомендации
- ^ "Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. - Das Periodensystem online" (на немецком).
- ^ (1960). Gmelins Handbuch der anorganischen Chemie (8. Aufl.), Weinheim: Verlag Chemie, стр. 289.
- ^ Kuske, P .; Engelen, B .; Henning, J .; Lutz, H.D .; Fuess, H .; Грегсон, Д. "Нейтронографическое исследование Sr (OH)"2(ЧАС2O) и бета-Ba (OH)2*(ЧАС2O) "Zeitschrift für Kristallographie (1979-2010) 1988, т. 183, стр. 319-стр. 325.
- ^ Manohar, H .; Рамашешан, С. "Кристаллическая структура октагидрата гидроксида бария Ba (OH)"2(ЧАС2O)8"Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1964. Vol. 119, p357-p374.
- ^ Роберт Кресс, Ульрих Баудис, Пауль Йегер, Х. Герман Рихерс, Хайнц Вагнер, Йохен Винклер, Ханс Уве Вольф, «Барий и соединения бария» в Энциклопедии промышленной химии Ульмана, 2007 Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a03_325.pub2
- ^ Mendham, J .; Denney, R.C .; Barnes, J.D .; Томас, М. Дж. К. (2000), Количественный химический анализ Фогеля (6-е изд.), Нью-Йорк: Prentice Hall, ISBN 0-582-22628-7
- ^ Мейер, К .; Блох, Х.С. (1945). "Нафторезорцин". Орг. Synth. 25: 73; Coll. Vol. 3: 637.
- ^ Браун, Г. Б. (1946). "Метил янтарная кислота". Орг. Synth. 26: 54; Coll. Vol. 3: 615.
- ^ Форд, Джаред Х. (1947). "β-аланин". Орг. Synth. 27: 1; Coll. Vol. 3: 34.
- ^ Anslow, W. K .; King, H .; Ортен, Дж. М .; Хилл, Р. М. (1925). "Глицин". Орг. Synth. 4: 31; Coll. Vol. 1: 298.
- ^ Durham, L.J .; McLeod, D. J .; Кейсон, Дж. (1958). "Метилгидрид хендекандиоат". Орг. Synth. 38:55; Coll. Vol. 4:635.
- ^ [1]
- ^ Thorpe, J. F .; Кон, Г. А. Р. (1925). "Циклопентанон". Орг. Synth. 5: 37; Coll. Vol. 1: 192.
- ^ Conant, J. B .; Таттл, Ниль. (1921). "Диацетоновый спирт". Орг. Synth. 1: 45; Coll. Vol. 1: 199.
- ^ Карабинос, Дж. В. (1956). "гамма-лактон". Орг. Synth. 36: 38; Coll. Vol. 4: 506.
- ^ Прадёт Патнаик. Справочник неорганических химикатов. Макгроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ «Эндотермические реакции гидратированного гидроксида бария и хлорида аммония». Калифорнийский университет в Сан-Диего. Получено 2 апреля 2014.
- ^ Эндотермические реакции твердое тело-твердое тело
- ^ а б Лагерь, Эрик. «Эндотермическая реакция». Универтист Вашингтона. Получено 2 апреля 2014.
- ^ «Эндотермические твердотельные реакции» (PDF). Демонстрации классической химии. Королевское химическое общество. Архивировано из оригинал (PDF) 7 апреля 2014 г.. Получено 2 апреля 2014.