WikiDer > Циклол - Википедия
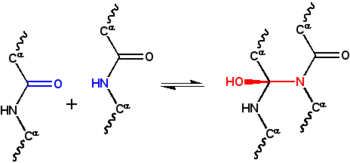
В гипотеза циклола это первый структурная модель из сложенный, шаровидный белок.[1] Он был разработан Дороти Ринч в конце 1930-х годов и основывался на трех предположениях. Во-первых, гипотеза предполагает, что два пептидные группы может быть сшит циклоловая реакция (Рисунок 1); эти сшивки ковалентный аналоги нековалентный водородные связи между пептидными группами. Эти реакции наблюдались в эргопептиды и другие соединения. Во-вторых, предполагается, что при некоторых условиях аминокислоты естественным образом образуют максимально возможное количество циклольных поперечных связей, что приводит к молекулы циклола (Рисунок 2) и циклол ткани (Рисунок 3). Эти молекулы циклола и ткани никогда не наблюдались. Наконец, гипотеза предполагает, что глобулярные белки обладают третичная структура соответствующий Платоновы тела и полуправильные многогранники сформированы из ткани цикол без свободных краев. Таких «замкнутых циклолов» молекул тоже не наблюдается.
Хотя более поздние данные показали, что эта оригинальная модель для структура глобулярных белков требовалось внести поправки, были проверены несколько элементов модели циклола, такие как сама реакция циклола и гипотеза о том, что гидрофобные взаимодействия несут основную ответственность за сворачивание белка. Гипотеза циклола стимулировала многих ученых к исследованию вопросов структуры и химии белков и явилась предшественником более точных моделей, предложенных для Двойная спираль ДНК и вторичная структура белка. Предложение и тестирование модели циклола также является прекрасной иллюстрацией эмпирический фальсифицируемость действуя как часть научный метод.
Исторический контекст
К середине 1930-х гг. аналитическое ультрацентрифугирование исследования Теодор Сведберг показали, что белки имеют четко определенную химическую структуру и не являются скоплениями небольших молекул.[2] Те же исследования показали, что молекулярная масса белков делится на несколько четко определенных классов, связанных целыми числами,[3] Такие как Mш = 2п3q Да, куда п и q неотрицательные целые числа.[4] Однако было трудно определить точную молекулярную массу и количество аминокислот в белке. Сведберг также показал, что изменение условий раствора может привести к разложению белка на мелкие субъединицы, что теперь известно как изменение четвертичная структура.[5]
В химическая структура из белки в то время все еще обсуждался.[6] Наиболее принятая (и в конечном итоге верная) гипотеза заключалась в том, что белки линейны. полипептиды, т.е. неразветвленные полимеры из аминокислоты связаны пептидные связи.[7][8] Однако типичный белок очень длинный - сотни аминокислотные остатки- и несколько выдающихся ученых не были уверены в том, что такой длинный, линейный макромолекулы может быть стабильным в растворе.[9][10] Дальнейшие сомнения по поводу полипептидная природа белков возникла потому, что некоторые ферменты наблюдалось расщепление белков, но не пептидов, тогда как другие ферменты расщепляют пептиды, но не свернутые белки.[11] Попытки синтезировать белки в пробирке не увенчались успехом, в основном из-за хиральность аминокислот; природные белки состоят только из левша аминокислоты. Таким образом, были рассмотрены альтернативные химические модели белков, такие как дикетопиперазиновая гипотеза Эмиль Абдерхалден.[12][13] Однако ни одна альтернативная модель еще не объяснила, почему белки дают только аминокислоты и пептиды при гидролизе и протеолизе. Как пояснил Linderstrøm-Lang,[14] эти данные протеолиза показали, что денатурированные белки были полипептидами, но данных о структуре свернутых белков еще не было; таким образом, денатурация может включать химическое изменение, которое превращает свернутые белки в полипептиды.
Процесс протеина денатурация (в отличие от коагуляция) был открыт в 1910 г. Харриетт Чик и Чарльз Мартин,[15] но природа его оставалась загадочной. Тим Энсон и Альфред Мирский показали, что денатурация была обратимый процесс с двумя состояниями[16] в результате многие химические группы становятся доступными для химических реакций, включая расщепление ферментами.[17] В 1929 г. Сянь Ву правильно предположили, что денатурация соответствует разворачиванию белка, чисто конформационному изменению, которое привело к воздействию растворителя на боковые цепи аминокислот.[18] Гипотеза Ву также независимо была выдвинута в 1936 году Мирским и Линус Полинг.[19] Тем не менее, ученые-белки не могли исключить возможность того, что денатурация соответствовала химический изменение структуры белка,[17] гипотеза, которая считалась (отдаленной) возможностью до 1950-х годов.[20][21]
Рентгеновская кристаллография как дисциплина только зародилась в 1911 году и относительно быстро продвинулась от кристаллов простых солей до кристаллов сложных молекул, таких как холестерин. Однако даже самые маленькие белки содержат более 1000 атомов, что значительно усложняет определение их структуры. В 1934 г. Дороти Кроуфут Ходжкин взял кристаллографические данные о структуре небольшого белка, инсулин, хотя структура этого и других белков не была решена до конца 1960-х годов. Однако новаторские рентгеновский снимок дифракция волокна данные были собраны в начале 1930-х годов для многих естественных волокнистые белки такие как шерсть и волосы Уильям Эстбери, предложившие элементарные модели вторичная структура такие элементы, как альфа спираль и бета-лист.
С структура белка был настолько плохо изучен в 1930-х годах, что физические взаимодействия, ответственные за стабилизацию этой структуры, также были неизвестны. Astbury предположили, что структура волокнистые белки был стабилизирован водородные связи в β-листах.[22][23] Идея, что глобулярные белки также стабилизируются водородными связями. Дороти Джордан Ллойд[24][25] в 1932 г., а позже отстаивал Альфред Мирский и Линус Полинг.[19] На лекции Эстбери в Оксфордском младшем научном обществе в 1933 г., физик Фредерик Франк предположили, что волокнистый белок α-кератин может быть стабилизирован с помощью альтернативного механизма, а именно: ковалентный сшивание пептидные связи по указанной выше реакции циклола.[26] Сшивка с циклолом сближает две пептидные группы; атомы N и C разделены расстоянием ~ 1.5Å, а их разделяет ~ 3Å в типичном водородная связь. Идея заинтриговала Дж. Д. Бернал, который подсказал это математику Дороти Ринч как возможно полезно для понимания структуры белка.
Основная теория
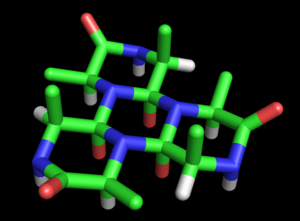
Wrinch развили это предложение в полноценную модель структура белка. Базовая модель циклола была изложена в ее первой статье (1936 г.).[27] Она отметила возможность того, что полипептиды может циклизоваться с образованием замкнутых колец (истинный) и что эти кольца могут образовывать внутренние поперечные связи в результате реакции циклона (также верно, хотя и редко). Предполагая, что цикольная форма пептидная связь может быть более стабильной, чем амидная форма, Рринч пришел к выводу, что определенные циклические пептиды естественно сделать максимальное количество циклольных связей (таких как циклол 6, Фигура 2). Такие молекулы циклола имели бы гексагональную симметрию, если бы химические связи были взяты одинаковой длины, примерно 1,5Å; для сравнения, связи N-C и C-C имеют длину 1,42 Å и 1,54 Å соответственно.
Эти кольца можно бесконечно расширять, образуя циклол ткань (Рисунок 3). Такие ткани демонстрируют дальний квазикристаллический порядок, который, по мнению Ринча, вероятно, был в белках, поскольку они должны плотно упаковывать сотни остатков. Еще одна интересная особенность таких молекул и тканей заключается в том, что их аминокислота боковые цепи направлены в осевом направлении вверх только с одной стороны; противоположная грань не имеет боковых цепей. Таким образом, одно лицо полностью не зависит от первичная последовательность пептида, который, как предположил Уринч, может объяснять независимые от последовательности свойства белков.
В своей первоначальной статье Ринч ясно заявила, что модель циклола была просто рабочая гипотеза, потенциально допустимая модель белков, которую необходимо проверить. Ее цели в этой статье и ее последователях заключались в том, чтобы предложить четко определенную тестируемую модель, проработать последствия ее предположений и сделать прогнозы, которые можно было бы проверить экспериментально. В этих целях ей это удалось; однако в течение нескольких лет эксперименты и дальнейшее моделирование показали, что гипотеза циклола не может служить моделью для глобулярных белков.
Стабилизирующие энергии

В двух тандемных письмах в редакцию (1936),[28][29] Ринч и Франк рассмотрели вопрос, действительно ли циклольная форма пептидной группы более стабильна, чем амидная форма. Относительно простой расчет показал, что форма циклона значительно меньше стабильнее, чем амидная форма. Следовательно, от модели циклона придется отказаться, если не будет выявлен компенсирующий источник энергии. Первоначально Франк предположил, что форма циклола может быть стабилизирована за счет лучшего взаимодействия с окружающим растворителем; позже Ринч и Ирвинг Ленгмюр выдвинули гипотезу, что гидрофобная ассоциация неполярных боковых цепей обеспечивает стабилизирующую энергию для преодоления энергетических затрат циклольных реакций.[30][31]
Лабильность циклольной связи рассматривалась как преимущество модели, поскольку она давала естественное объяснение свойствам денатурация; превращение циклольных связей в их более стабильную амидную форму открыло бы структуру и позволило бы атаковать эти связи протеазы, в соответствии с экспериментом.[32][33] Ранние исследования показали, что белки денатурированный к давление часто находятся в другом состоянии, чем те же белки, денатурированные высоким температура, что было интерпретировано как возможное поддержание циклольной модели денатурации.[34]
Гипотеза Ленгмюра-Уринча о гидрофобной стабилизации разделяла крах модели циклона, в основном из-за влияния Линус Полинг, который поддерживал гипотезу о том, что структура белка стабилизируется водородные связи. Прошло еще двадцать лет, прежде чем гидрофобные взаимодействия были признаны главной движущей силой сворачивания белков.[35]
Стерическая дополнительность
В своей третьей статье о циклолах (1936 г.)[36] Ринч отметил, что многие «физиологически активные» вещества, такие как стероиды состоят из конденсированных гексагональных колец атомов углерода и, таким образом, могут быть стерически дополняющий перед лицом молекул циклола без аминокислота боковые цепи. Ринч предположил, что стерическая комплементарность была одним из главных факторов, определяющих, будет ли небольшая молекула связываться с белком.
Ринч предположил, что белки несут ответственность за синтез всех биологических молекул. Отметив, что клетки переваривают свои белки только в условиях крайнего голода, Ринч далее предположил, что жизнь не могла бы существовать без белков.
Гибридные модели
С самого начала циклоловая реакция рассматривалась как ковалентный аналог реакции водородная связь. Поэтому было естественно рассмотреть гибридные модели с обоими типами связей. Это было предметом четвертой статьи Ринча о циклольной модели (1936).[37] написано вместе с Дороти Джордан Ллойд, который первым предположил, что глобулярные белки стабилизируются водородными связями.[24] В 1937 году была написана следующая статья, в которой упоминались другие исследователи водородных связей в белках, такие как Морис Лоял Хаггинс и Линус Полинг.[38]
Ринч также написал статью с Уильям Эстбери, отмечая возможность кето-енольной изомеризации> CαЧАСα и амидкарбонильная группа> C = O, образуя поперечную связь> Cα-С (ОНα) <и снова превращая кислород в гидроксильную группу.[39] Такие реакции могут давать пятичленные кольца, тогда как классическая гипотеза циклолов дает шестичленные кольца. Эта гипотеза сшивки кето-енолом не получила дальнейшего развития.[40]
Ткани, закрывающие пространство

В своей пятой статье о циклолах (1937 г.)[41] Ринч определил условия, при которых две плоские ткани из циклона могут быть соединены таким образом, чтобы образовать угол между их плоскостями при соблюдении углов химической связи. Она определила математическое упрощение, в котором неплоские шестичленные кольца атомов могут быть представлены плоскими «срединными шестиугольниками», образованными из середин химических связей. Это представление "среднего шестиугольника" позволило легко увидеть, что плоскости ткани цикол могут быть правильно соединены, если двугранный угол между плоскостями равен тетраэдрическому валентному углу δ = arccos (-1/3) ≈ 109,47 °.
Можно построить большое разнообразие замкнутых многогранников, удовлетворяющих этому критерию, простейшими из которых являются усеченный тетраэдр, то усеченный октаэдр, а октаэдр, которые Платоновы тела или же полуправильные многогранники. Рассматривая первую серию «замкнутых циклов» (смоделированных на усеченном тетраэдре), Уринч показал, что количество их аминокислот увеличился квадратично как 72п2, куда п - индекс замкнутого циклола Cп. Таким образом C1 циклол имеет 72 остатка, C2 циклол имеет 288 остатков и т. д. Предварительное экспериментальное подтверждение этого прогноза получено из Макс Бергманн и Карл Ниманн,[4] чей аминокислотный анализ показал, что белки состоят из целых чисел, кратных 288 аминокислота остатки (п= 2). В более общем плане циклоловая модель глобулярных белков объясняет ранний аналитическое ультрацентрифугирование Результаты Теодор Сведберг, что предполагает, что молекулярная масса белков попали в несколько классов, связанных целыми числами.[2][3]
Модель циклола соответствовала общим свойствам, которые тогда приписывались свернутым белкам.[42] (1) Исследования центрифугирования показали, что свернутые белки были значительно плотнее воды (~ 1,4грамм/мл) и, таким образом, плотно упакованы; Ринч предположил, что плотная упаковка должна означать обычный упаковка. (2) Несмотря на свой большой размер, некоторые белки легко кристаллизуются в симметричные кристаллы, что согласуется с идеей симметричных граней, которые совпадают при ассоциации. (3) Белки связывают ионы металлов; поскольку участки связывания металлов должны иметь специфическую геометрию связи (например, октаэдрическую), было правдоподобно предположить, что весь белок также имел аналогичную кристаллическую геометрию. (4) Как описано выше, модель циклола обеспечивает простую химический объяснение денатурация и сложность расщепления свернутых белков протеазами. (5) Предполагалось, что белки несут ответственность за синтез всех биологических молекул, включая другие белки. Ринч отметил, что фиксированная единообразная структура может быть полезна для белков при моделировании их собственного синтеза, аналогично Watson-Фрэнсис Крик концепция ДНК, шаблонизирующая собственную репликацию. Учитывая, что многие биологические молекулы, такие как сахара и стеролы имеют гексагональную структуру, можно было предположить, что синтезируемые ими белки также имели гексагональную структуру. Ринч резюмировала свою модель и подтверждающие экспериментальные данные по молекулярной массе в трех обзорных статьях.[43]
Прогнозируемые белковые структуры
Предложив модель глобулярных белков, Ринч исследовал, согласуется ли она с доступными структурными данными. Она предположила, что белок туберкулина крупного рогатого скота (523) был C1 замкнутый циклол, состоящий из 72 остатков[44] и что пищеварительный фермент пепсин был C2 замкнутый циклол из 288 остатков.[45][46] Эти предсказания количества остатков было трудно проверить, поскольку методы, доступные тогда для измерения массы белков, были неточными, например аналитическое ультрацентрифугирование и химические методы.
Ринч также предсказал, что инсулин был C2 замкнутый циклол, состоящий из 288 остатков. Для инсулина были доступны ограниченные рентгеновские кристаллографические данные, которые Ринч интерпретировала как «подтверждающие» ее модель.[47] Однако это толкование вызвало довольно резкую критику как преждевременное.[48] Тщательное изучение диаграмм Паттерсона инсулина, взятых Дороти Кроуфут Ходжкин показали, что они примерно соответствовали модели циклола; однако совпадения было недостаточно, чтобы утверждать, что модель циклола была подтверждена.[49]
Несостоятельность модели
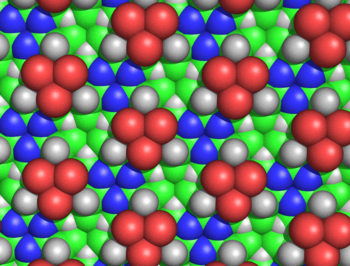
Циклоловая ткань оказалась неправдоподобной по нескольким причинам. Ганс Нейрат и Генри Булл показали, что плотная упаковка боковых цепей в ткани циклола несовместима с экспериментальной плотностью, наблюдаемой в белковых пленках.[50] Морис Хаггинс подсчитали, что несколько несвязанных атомов циклольной ткани будут сближаться ближе, чем допускается их радиусы Ван-дер-Ваальса; например, внутренний Hα и Cα атомы лакуны были бы разделены всего 1,68Å (Рисунок 5).[51] Хауровиц химически показал, что вне белков не может быть большого количества гидроксильных групп, что является ключевым предсказанием модели циклона.[52] тогда как Мейер и Хохенемзер показали, что циклольные конденсации аминокислот не существуют даже в незначительных количествах в качестве переходного состояния.[53] Более общие химические аргументы против модели циклола были даны Бергманном и Ниманом.[54] и по Neuberger.[55][56] Данные инфракрасной спектроскопии показали, что количество карбонильных групп в белке не изменяется при гидролизе.[57] и что неповрежденные свернутые белки имеют полный набор амид карбонильных групп;[58] оба наблюдения противоречат гипотезе циклола о том, что такие карбонилы превращаются в гидроксильные группы в свернутых белках. Наконец, было известно, что белки содержат пролин в значительных количествах (обычно 5%); поскольку пролину не хватает амидного водорода, а его азот уже образует три ковалентные связи, пролин, по-видимому, неспособен к реакции циклона и встраиваться в ткань циклола. Энциклопедическое резюме химических и структурных доказательств против модели циклона было дано Полингом и Ниманом.[59] Более того, подтверждающее свидетельство - результат того, что все белки содержат целое число, кратное 288 аминокислота остатки[4]- в 1939 году также было показано, что это неверно.[60]
Ринч ответил на критические замечания по поводу стерического столкновения, свободной энергии, химического состава и числа остатков в отношении модели циклола. Что касается стерических столкновений, она отметила, что небольшие деформации валентных углов и длин связей позволили бы уменьшить эти стерические столкновения или, по крайней мере, уменьшить их до разумного уровня.[61] Она отметила, что расстояния между несвязанными группами в одной молекуле могут быть короче, чем ожидалось из их радиусы Ван-дер-Ваальса, например, 2,93Å расстояние между метильными группами в гексаметилбензоле. Что касается штрафа свободной энергии для реакции циклона, Ринч не согласился с расчетами Полинга и заявил, что слишком мало известно о внутримолекулярных энергиях, чтобы исключить модель циклона только на этом основании.[61] В ответ на химическую критику, Уринч предположил, что модельные соединения и изученные простые бимолекулярные реакции не обязательно должны относиться к циклольной модели, и что стерические препятствия могли помешать взаимодействию поверхностных гидроксильных групп.[62] Что касается критики числа остатков, Ринч расширила свою модель, чтобы учесть другие числа остатков. В частности, она произвела «минимальный» замкнутый циклол всего из 48 остатков,[63] и на этом (неверном) основании, возможно, был первым, кто предположил, что инсулин мономер имел молекулярную массу примерно 6000Да.[64][65]
Таким образом, она утверждала, что циклоловая модель глобулярных белков все еще потенциально жизнеспособна.[66][67] и даже предложили ткань цикол в качестве компонента цитоскелет.[68] Однако большинство ученых-протеинов перестали в это верить, и Ринч обратила свое научное внимание на математические проблемы в Рентгеновская кристаллография, чему она внесла значительный вклад. Единственным исключением был физик. Глэдис Энслоу, Коллега Ринча в Смит-колледж, которые изучили ультрафиолетовый поглощение спектры белков и пептидов в 1940-х годах и позволили циклолам интерпретировать ее результаты.[69][70] Поскольку последовательность инсулина стали определяться Фредерик Сэнгер, Анслоу опубликовал трехмерную модель циклона с боковыми цепями,[71] основан на основе модели "минимального циклона" Уринча 1948 года.[63]
Частичное погашение

Крах общей модели циклола в целом привел к отказу от ее элементов; одно заметное исключение было Дж. Д. Берналнедолговечное принятие гипотезы Ленгмюра-Ринча о том, что сворачивание белка управляется гидрофобной ассоциацией.[73] Тем не менее, циклольные связи были идентифицированы в небольших естественных циклические пептиды в 1950-е гг.
Уместно уточнить современную терминологию. Классическая циклоловая реакция - это добавление NH-амина из пептидная группа к карбонильной группе C = O другого; полученное соединение теперь называется азациклол. По аналогии оксациклол образуется, когда гидроксильная группа ОН добавляется к пептидилкарбонильной группе. Точно так же тиациклол образуется путем добавления SH-тиольного фрагмента к пептидилкарбонильной группе.[74]
Оксациклол алкалоид эрготамин от грибок Claviceps purpurea был первым идентифицированным циклолом.[75] Циклический депсипептид серратамолид также образуется в результате реакции оксациклола.[76] Получены также химически аналогичные циклические тиациклолы.[77] Классические азациклолы наблюдались в небольших молекулах.[78] и трипептиды.[79] Пептиды естественным образом производятся путем превращения азацилолов,[80] ключевой прогноз модели циклола. В настоящее время идентифицированы сотни молекул циклола, несмотря на Линус Полинграсчет, что такие молекулы не должны существовать из-за их неблагоприятно высокого энергия.[59]
После долгого перерыва, во время которого она занималась в основном математикой Рентгеновская кристаллографияРинч отреагировал на эти открытия с новым энтузиазмом по поводу модели циклола и ее значимости в биохимии.[81] Она также опубликовала две книги, описывающие теорию циклолов и небольшие пептиды в целом.[82][83]
Иллюстрация научного метода
Циклоловая модель структуры белка является примером эмпирический фальсифицируемость действуя как часть научный метод. Оригинальный гипотеза сделано с учетом необъяснимых экспериментальных наблюдений; последствия этой гипотезы прорабатываются, приводя к предсказаниям, которые проверяются экспериментально. В этом случае ключевая гипотеза заключалась в том, что циклольная форма пептидной группы может иметь преимущество перед амидной формой. Эта гипотеза привела к предсказаниям молекулы cyclol-6 и ткани cyclol, которые, в свою очередь, предложили модель полурегулярных полиэдров для глобулярных белков. Ключевым проверенным предсказанием было то, что карбонильные группы свернутого белка должны в значительной степени превращаться в гидроксильные группы; однако спектроскопические и химические эксперименты показали, что это предсказание неверно. Модель циклола также предсказывает высокую латеральную плотность аминокислот в свернутых белках и пленках, что не согласуется с экспериментом. Следовательно, от модели циклона можно было отказаться и начать поиск новых гипотез структура белка, например, модели альфа спираль предложенный в 1940-1950-х гг.
Иногда утверждают, что гипотеза циклола никогда не должна была выдвигаться,[84][85] из-за его априори недостатки, например, его стерические противоречия, его неспособность приспособить пролин, и высокий свободная энергия неблагоприятная реакция на циклол как таковой. Хотя такие недостатки сделали гипотезу циклола неправдоподобный, они не сделали это невозможно. Модель циклола была первой четко определенной структурой, предложенной для глобулярных белков, и тогда было слишком мало известно о внутримолекулярных силах и структуре белка, чтобы немедленно ее отвергнуть. Он четко объяснил некоторые общие свойства белков и объяснил аномальные экспериментальные наблюдения. Хотя в целом это неверно, некоторые элементы теории циклолов были в конечном итоге проверены, например, реакции циклолов и роль гидрофобные взаимодействия в сворачивание белка. Полезное сравнение - Модель Бора из водород атом, который с самого начала считался неправдоподобным даже его создателем,[86] но привел к окончательно верной теории квантовая механика. По аналогии, Линус Полинг предложила четкую модель ДНК[87] это тоже было неправдоподобно, но наводило на размышления других исследователей.[88][89]
И наоборот, модель циклола является примером неправильной научной теории великих симметрия и Красота, два качества, которые можно рассматривать как признаки «заведомо верных» научных теорий. Например, Watson-Крик двойная спираль модель ДНК[89] иногда называют "очевидным" из-за его правдоподобия водородная связь и симметрия; тем не менее, другие, менее симметричные структуры ДНК предпочтительны в других условиях.[90] Точно так же прекрасная теория общая теория относительности был рассмотрен Альберт Эйнштейн как не нуждающиеся в экспериментальной проверке; но даже эта теория потребует пересмотра для согласования с квантовая теория поля.[91]
Рекомендации
- ^ Тиселиус, А (1939). «Химия белков и аминокислот». Ежегодный обзор биохимии. 8: 155–184. Дои:10.1146 / annurev.bi.08.070139.001103.
- ^ а б Сведберг, Т (1929). «Масса и размер белковых молекул». Природа. 123 (3110): 871. Bibcode:1929Натура.123..871С. Дои:10.1038 / 123871a0. S2CID 4068088.
- ^ а б Сведберг, Т (1934). «Осаждение молекул в центробежных полях». Химические обзоры. 14: 1–15. Дои:10.1021 / cr60047a001.
- ^ а б c Бергманн, М; Ниманн C (1937). «О структуре белков: гемоглобина крупного рогатого скота, яичного альбумина, фибрина крупного рогатого скота, желатина». Журнал биологической химии. 118: 301–314.
- ^ Сведберг, Т (1930). «Области устойчивости белков к pH». Труды общества Фарадея. 26: 741–744. Дои:10.1039 / TF9302600737.
- ^ Фрутон, Дж. С. (1979). «Ранние теории строения белков». Летопись Нью-Йоркской академии наук. 325 (1): 1–18. Bibcode:1979НЯСА.325 .... 1Ф. Дои:10.1111 / j.1749-6632.1979.tb14125.x. PMID 378063. S2CID 39125170.
- ^ Хофмайстер, Ф (1902 г.). "Über Bau und Gruppierung der Eiweisskörper". Ergebnisse der Physiologie. 1: 759–802. Дои:10.1007 / BF02323641. S2CID 101988911.
- ^ Фишер, Э (1902 г.). «Убер умирают гидролизеры протеинстоффе». Chemiker Zeitung. 26: 939–940.
- ^ Фишер, Э (1913). "Synthese von Depsiden, Flechtenstoffen und Gerbstoffen". Berichte der Deutschen Chemischen Gesellschaft. 46 (3): 3253–3289. Дои:10.1002 / cber.191304603109.
- ^ Соренсен, SPL (1930). «Строение растворимых белков как обратимо диссоциируемых компонентных систем». Comptes Rendus des Travaux du Laboratoire Carlsberg. 18: 1–124.
- ^ Фрутон, Дж.С. (1999). Белки, ферменты, гены: взаимодействие химии и биологии. Нью-Хейвен, Коннектикут: Издательство Йельского университета. ISBN 0-585-35980-6.
- ^ Абдерхалден, Э (1924). «Дикетопиперазины». Naturwissenschaften. 12 (36): 716–720. Bibcode:1924NW ..... 12..716A. Дои:10.1007 / BF01504819. S2CID 29012795.
- ^ Абдерхалден, Э; Комм Э (1924). "Убер умирают ангидридструктура дер протеина". Zeitschrift für Physiologische Chemie. 139 (3–4): 181–204. Дои:10.1515 / bchm2.1924.139.3-4.181.
- ^ Линдерстрём-Ланг, K; Hotchkiss RD; Йохансен Г (1938). «Пептидные связи в глобулярных белках». Природа. 142 (3605): 996. Bibcode:1938Натура.142..996L. Дои:10.1038 / 142996a0. S2CID 4086716.
- ^ Цыпленок, H; Мартин CJ (1910). «О« тепловой »коагуляции белков». Журнал физиологии. 40 (5): 404–430. Дои:10.1113 / jphysiol.1910.sp001378. ЧВК 1533708. PMID 16993016.
Цыпленок, H; Мартин CJ (1911). «О« тепловой »коагуляции белков. II. Действие горячей воды на яичный белок и влияние кислоты и солей на скорость реакции». Журнал физиологии. 43 (1): 1–27. Дои:10.1113 / jphysiol.1911.sp001456. ЧВК 1512746. PMID 16993081.
Цыпленок, H; Мартин CJ (1912). «О« тепловой »коагуляции белков. III. Влияние щелочи на скорость реакции». Журнал физиологии. 45 (1–2): 61–69. Дои:10.1113 / jphysiol.1912.sp001535. ЧВК 1512881. PMID 16993182.
Цыпленок, H; Мартин CJ (1912). «О« тепловой »коагуляции белков. IV. Условия, контролирующие агглютинацию белков, на которые уже воздействовала горячая вода». Журнал физиологии. 45 (4): 261–295. Дои:10.1113 / jphysiol.1912.sp001551. ЧВК 1512885. PMID 16993156. - ^ Энсон, ML; Мирский А.Е. (1929). «Свертывание белков и ее обращение». Журнал общей физиологии. 13 (2): 121–132. Дои:10.1085 / jgp.13.2.121. ЧВК 2141032. PMID 19872511.
- ^ а б Энсон, ML (1945). «Денатурация белков и свойства групп белков». Достижения в химии белков. 2: 361–386. Дои:10.1016 / S0065-3233 (08) 60629-4. ISBN 978-0-12-034202-0.
- ^ Ву, H (1931). «Исследования денатурации белков. XIII. Теория денатурации». Китайский журнал физиологии. 5: 321–344. Предварительные отчеты были представлены на XIII Международном физиологическом конгрессе в Бостоне (19–24 августа 1929 г.) и в октябрьском выпуске журнала 1929 г. Американский журнал физиологии.
- ^ а б Мирский А Э; Полинг Л (1936). «О структуре нативных, денатурированных и коагулированных белков» (PDF). Труды Национальной академии наук Соединенных Штатов Америки. 22 (7): 439–447. Bibcode:1936ПНАС ... 22..439М. Дои:10.1073 / pnas.22.7.439. ЧВК 1076802. PMID 16577722.
- ^ Neurath, H; Гринштейн JP; Putnam FW; Эриксон Джо (1944). «Химия денатурации белков». Химические обзоры. 34 (2): 157–265. Дои:10.1021 / cr60108a003.
- ^ Putnam, F (1953). «Денатурация белка». Белки (Х. Нейрат и К. Бейли, ред.). 1B: 807–892.
- ^ Эстбери, штат Вашингтон; Вудс HJ (1931). «Молекулярный вес белков». Природа. 127 (3209): 663–665. Bibcode:1931Натура.127..663А. Дои:10.1038 / 127663b0. S2CID 4133226.
- ^ Эстбери, штат Вашингтон (1933). «Некоторые проблемы рентгенологического анализа структуры шерсти животных и других белковых волокон». Труды общества Фарадея. 29 (140): 193–211. Дои:10.1039 / tf9332900193.
- ^ а б Джордан Ллойд, D (1932). «Коллоидная структура и ее биологическое значение». Биологические обзоры. 7 (3): 254–273. Дои:10.1111 / j.1469-185x.1962.tb01043.x. S2CID 84286671.
- ^ Джордан Ллойд, D; Марриотт (1933). «Название неизвестно». Труды общества Фарадея. 29: 1228. Дои:10.1039 / tf9332901228.
- ^ Эстбери, штат Вашингтон (1936). «Неизвестный титул». Журнал Текстильного института. 27: 282–?.
- ^ Wrinch, DM (1936). «Узор белков». Природа. 137 (3462): 411–412. Bibcode:1936Натура.137..411Вт. Дои:10.1038 / 137411a0. S2CID 4140591.
- ^ Wrinch, DM (1936). «Энергия образования молекул циклона». Природа. 138 (3484): 241–242. Bibcode:1936Натура.138..241Вт. Дои:10.1038 / 138241a0. S2CID 4103892.
- ^ Фрэнк, ФК (1936). «Энергия образования молекул циклона». Природа. 138 (3484): 242. Bibcode:1936г. Природа.138..242F. Дои:10.1038 / 138242a0. S2CID 4065283.
- ^ Ленгмюр, я; Wrinch DM (1939). «Природа Cyclol Bond». Природа. 143 (3611): 49–52. Bibcode:1939Натура.143 ... 49л. Дои:10.1038 / 143049a0. S2CID 4056966.
- ^ Ленгмюр, я (1939). «Строение белков». Труды физического общества. 51 (4): 592–612. Bibcode:1939ПС .... 51..592Л. Дои:10.1088/0959-5309/51/4/305.
- ^ Wrinch, DM (1938). «О гидратации и денатурации белков». Философский журнал. 25: 705–739.
- ^ Wrinch, DM (1936). «Гидратация и денатурация белков». Природа. 142 (3588): 260. Bibcode:1938Натура.142..259.. Дои:10.1038 / 142259a0.
- ^ Доу, РБ; Мэтьюз Дж. Э .; Младший и Торп WTS (1940). «Влияние лечения высоким давлением на физиологическую активность инсулина». Американский журнал физиологии. 131 (2): 382–387. Дои:10.1152 / ajplegacy.1940.131.2.382.
- ^ Каузманн, В (1959). «Некоторые факторы в интерпретации денатурации белков». Достижения в химии белков. 14: 1–63. Дои:10.1016 / S0065-3233 (08) 60608-7. ISBN 978-0-12-034214-3. PMID 14404936.
- ^ Wrinch, DM (1936). «Строение белков и некоторых физиологически активных соединений». Природа. 138 (3493): 651–652. Bibcode:1936Натура.138..651Вт. Дои:10.1038 / 138651a0. S2CID 4108696.
- ^ Wrinch, DM; Джордан Ллойд Д. (1936). «Водородная связь и структура белков». Природа. 138 (3496): 758–759. Bibcode:1936Натура.138..758Вт. Дои:10.1038 / 138758a0. S2CID 4096438.
- ^ Wrinch, DM (1937). «Природа связи в белках». Природа. 139 (3521): 718. Bibcode:1937Натура.139..718Вт. Дои:10.1038 / 139718a0. S2CID 4116000.
- ^ Эстбери, штат Вашингтон; Wrinch DM (1937). «Внутримолекулярное сворачивание белков путем обмена кето-енолом». Природа. 139 (3523): 798. Bibcode:1937Натура.139..798А. Дои:10.1038 / 139798a0. S2CID 41311699.
- ^ Винч, D. "Тканевая теория структуры белка". Философский журнал. 30: 64–67.
- ^ Wrinch, DM (1937). «Циклоловая теория и« шаровидные »белки». Природа. 139 (3527): 972–973. Bibcode:1937Натура.139..972Вт. Дои:10.1038 / 139972a0. S2CID 4066210.
- ^ Wrinch, DM (1947). «Родной белок». Наука. 106 (2743): 73–76. Bibcode:1947 г., наука ... 106 ... 73 Вт. Дои:10.1126 / science.106.2743.73. PMID 17808858.
- ^ Wrinch, DM (1937). «По образцу белков». Труды Королевского общества. A160: 59–86.
Wrinch, DM (1937). "Циклоловая гипотеза и" глобулярные "белки". Труды Королевского общества. A161: 505–524.
Wrinch, DM (1938). «О молекулярных массах глобулярных белков». Философский журнал. 26: 313–332. - ^ Wrinch, DM (1939). «Туберкулиновый белок TBU-Bovine (523)». Природа. 144 (3636): 77. Bibcode:1939 Натур.144 ... 77 Вт. Дои:10.1038 / 144077a0. S2CID 4113033.
- ^ Wrinch, DM (1937). «О структуре пепсина». Философский журнал. 24: 940.
- ^ Wrinch, DM (1938). «Структура пепсина». Природа. 142 (3587): 217. Bibcode:1938Натура.142..215.. Дои:10.1038 / 142215a0.
- ^ Wrinch, DM (1937). «О структуре инсулина». Наука. 85 (2215): 566–567. Bibcode:1937Sci .... 85..566W. Дои:10.1126 / science.85.2215.566. PMID 17769864.
Wrinch, DM (1937). «О структуре инсулина». Труды общества Фарадея. 33: 1368–1380. Дои:10.1039 / tf9373301368.
Wrinch, DM (1938). «Строение молекулы инсулина». Журнал Американского химического общества. 60 (8): 2005–2006. Дои:10.1021 / ja01275a514.
Wrinch, DM (1938). «Строение молекулы инсулина». Наука. 88 (2276): 148–149. Bibcode:1938Sci .... 88..148W. Дои:10.1126 / science.88.2276.148-а. PMID 17751525.
Wrinch, DM; Ленгмюр I (1938). «Строение молекулы инсулина». Журнал Американского химического общества. 60 (9): 2247–2255. Дои:10.1021 / ja01276a062.
Ленгмюр, я; Wrinch DM (1939). «Заметка о структуре инсулина». Труды физического общества. 51 (4): 613–624. Bibcode:1939ПС .... 51..613Л. Дои:10.1088/0959-5309/51/4/306. - ^ Брэгг, WL (1939). "Диаграммы Паттерсона в анализе кристаллов". Природа. 143 (3611): 73–74. Bibcode:1939 г.Натура.143 ... 73Б. Дои:10.1038 / 143073a0. S2CID 4063833.
Бернал, JD (1939). «Векторные карты и гипотеза циклона». Природа. 143 (3611): 74–75. Bibcode:1939 г.Натура.143 ... 74Б. Дои:10.1038 / 143074a0. S2CID 4108005.
Робертсон, JM (1939). «Векторные карты и тяжелые атомы в анализе кристаллов и структуре инсулина». Природа. 143 (3611): 75–76. Bibcode:1939Натура.143 ... 75р. Дои:10.1038 / 143075a0. S2CID 4053119. - ^ Райли, DP; Фанкучен I (1939). "Производный анализ Паттерсона скелета Cyclol C2 Молекула ». Природа. 143 (3624): 648–649. Bibcode:1939Натура.143..648R. Дои:10.1038 / 143648a0. S2CID 4086672.
Wrinch, DM (1940). "Проекция Паттерсона скелетов структуры, предложенной для молекулы инсулина". Природа. 145 (3687): 1018. Bibcode:1940Натура.145.1018W. Дои:10.1038 / 1451018a0. S2CID 4119581.
Райли, Д. (1940). "Анализ Паттерсона, полученный на основе Cyclol C2 Скелет ». Природа. 146 (3694): 231. Bibcode:1940Натура.146..231R. Дои:10.1038 / 146231a0. S2CID 4111977. - ^ Neurath, H; Бык HB (1938). «Поверхностная активность белков». Химические обзоры. 23 (3): 391–435. Дои:10.1021 / cr60076a001.
- ^ Хаггинс, М (1939). «Строение белков». Журнал Американского химического общества. 61 (3): 755. Дои:10.1021 / ja01872a512.
- ^ Haurowitz, F (1938). "Die Anordnung der Peptidketten в Sphäroprotein-Molekülen". Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 256: 28–32. Дои:10.1515 / bchm2.1938.256.1.28.
- ^ Meyer, KH; Hohenemser W (1938). «Возможность образования циклов из простых пептидов». Природа. 141 (3582): 1138–1139. Bibcode:1938Натура.141.1138М. Дои:10.1038 / 1411138b0. S2CID 4097115.
- ^ Бергманн, М; Ниманн C (1938). «Химия аминокислот и белков». Ежегодный обзор биохимии. 7 (2): 99–124. Дои:10.1146 / annurev.bi.07.070138.000531. ЧВК 537431.
- ^ Нойбергер, А (1939). «Химическая критика циклола и частотная гипотеза структуры белка». Труды Королевского общества. 170: 64–65.
- ^ Нойбергер, А (1939). «Химические аспекты гипотезы циклола». Природа. 143 (3620): 473. Bibcode:1939Натура.143..473Н. Дои:10.1038 / 143473a0. S2CID 4102966.
- ^ Haurowitz, F; Аструп Т. (1939). «Ультрафиолетовое поглощение настоящего и гидролизованного протеина». Природа. 143 (3612): 118–119. Bibcode:1939Натура.143..118H. Дои:10.1038 / 143118b0. S2CID 4078416.
- ^ Klotz, IM; Грисволд П. (1949). «Инфракрасные спектры и амидная связь в нативном глобулярном белке». Наука. 109 (2830): 309–310. Bibcode:1949Научный ... 109..309K. Дои:10.1126 / science.109.2830.309. PMID 17782718.
- ^ а б Полинг, Л.; Ниманн C (1939). «Строение белков». Журнал Американского химического общества. 61 (7): 1860–1867. Дои:10.1021 / ja01876a065.
- ^ Гочкис, RD (1939). «Определение пептидных связей в кристаллическом лактоглобулине». Журнал биологической химии. 131: 387–395.
- ^ а б Wrinch, DM (1941). «Геометрическая атака на структуру белка». Журнал Американского химического общества. 63 (2): 330–33. Дои:10.1021 / ja01847a004.
- ^ Wrinch, DM (1940). «Циклоловая гипотеза». Природа. 145 (3678): 669–670. Bibcode:1940 Натур.145..669 Вт. Дои:10.1038 / 145669a0. S2CID 4065545.
- ^ а б Wrinch, DM (1948). «Природные белки как поликонденсации аминокислот». Наука. 107 (2783): 445–446. Bibcode:1948Научный ... 107R.445W. Дои:10.1126 / science.107.2783.445-а. PMID 17844448.
- ^ Wrinch, DM (1948). «Скелетные единицы в белковых кристаллах». Наука. 115 (2987): 356–357. Bibcode:1952 г., наука ... 115..356Вт. Дои:10.1126 / science.115.2987.356. PMID 17748855.
- ^ Wrinch, DM (1948). «Молекулы структуры инсулина». Наука. 116 (3021): 562–564. Bibcode:1952 г., наука ... 116..562 Вт. Дои:10.1126 / science.116.3021.562. PMID 13015111.
- ^ Wrinch, DM (1939). «Структура глобулярных белков». Природа. 143 (3620): 482–483. Bibcode:1939Натура.143..482Вт. Дои:10.1038 / 143482a0. S2CID 5362977.
- ^ Wrinch, DM (1939). «Циклоловая теория и структура инсулина». Природа. 143 (3627): 763–764. Bibcode:1939 г., природа. 143..763 Вт. Дои:10.1038 / 143763a0. S2CID 4063795.
- ^ Wrinch, DM (1939). «Нативные белки, гибкие каркасы и цитоплазматическая организация». Природа. 150 (3800): 270–271. Bibcode:1942 г.Натура.150..270Вт. Дои:10.1038 / 150270a0. S2CID 4085657.
- ^ Анслоу, Джорджия (1942). «Связанные энергии в некоторых белковых тканях и боковых цепях». Физический обзор. 61 (7–8): 547. Bibcode:1942ПхРв ... 61..541.. Дои:10.1103 / PhysRev.61.541.
- ^ Анслоу, Джорджия (1945). «Ультрафиолетовые спектры биологически важных молекул». Журнал прикладной физики. 16 (1): 41–49. Bibcode:1945JAP .... 16 ... 41A. Дои:10.1063/1.1707499.
- ^ Анслоу, Джорджия (1953). «Сайты аминокислотных остатков на циклольной модели инсулина». Журнал химической физики. 21 (11): 2083–2084. Bibcode:1953ЖЧФ..21.2083А. Дои:10.1063/1.1698765.
- ^ Guedez, T; Núñez A; Tineo E; Нуньес О (2002). «Эффект конфигурации размера кольца и трансаннулярные собственные скорости в макроциклах бислактама». Журнал химического общества, Perkin Transactions 2. 2002 (12): 2078–2082. Дои:10.1039 / b207233e.
- ^ Бернал, JD (1939). «Структура белков». Природа. 143 (3625): 663–667. Bibcode:1939 г.Натура.143..663Б. Дои:10.1038 / 143663a0. S2CID 46327591.
- ^ Виланд Т. и Бодански М., Мир пептидов, Springer Verlag, стр. 193–198. ISBN 0-387-52830-X
- ^ Хофманн, А; Ott H; Griot R; Stadler PA; Фрей AJ (1963). "Синтез фон Эрготамин". Helvetica Chimica Acta. 46: 2306–2336. Дои:10.1002 / hlca.19630460650.
- ^ Шемякин, ММ; Антонов В.К .; Шкроб А.М. (1963). «Активация амидной группы ацилированием». Peptides, Proc. 6-й европ. Pept. Symp., Афины: 319–328.
- ^ Zanotti, G; Pinnen F; Lucente G; Cerrini S; Федели В; Mazza F (1984). «Тиациклолы пептидов. Синтез и структурные исследования». J. Chem. Soc. Перкин Транс. 1: 1153–1157. Дои:10.1039 / п19840001153.
- ^ Грио, Р.Г.; Фрей AJ (1963). «Образование циклолов из N-гидроксиациллактамов». Тетраэдр. 19 (11): 1661–1673. Дои:10.1016 / S0040-4020 (01) 99239-7.
- ^ Lucente, G; Ромео А (1971). «Синтез циклолов из небольших пептидов посредством амид-амидной реакции». Chem. Сообщество. ?: 1605–1607. Дои:10.1039 / c29710001605.
Rothe M, Schindler W., Pudill R, Kostrzewa U, Theyson R и Steinberger R. (1971) "Zum Problem der Cycloltripeptidsynthese", Peptides, Proc. 11-й европ. Pept. Symp., Вена, 388–399.
Rothe M и Roser KL. (1988) «Конформационная гибкость циклических трипептидов», Abstr. 20-й европ. Pept. Symp. Тюбинген, п. 36. - ^ Виланд Т. и Мор Х. (1956) "Диациламид als energiereiche Verbindungen. Диглицилимид", Liebigs Ann. Chem., 599, 222–232.
Виланд Т. и Урбах Х. (1958) "Weitere Di-Aminoacylimide und ihre intramolekulare Umlagerung", Liebigs Ann. Chem., 613, 84–95.
Бреннер, М. (1958). Wolstenholme GEW; О'Коннор CM (ред.). «Аминоацильная вставка». Симпозиум Ciba Foundation по аминокислотам и пептидам с антиметаболической активностью. - ^ Wrinch, DM (1957). «Структура бацитрацина А». Природа. 179 (4558): 536–537. Bibcode:1957 г., природа 179..536 Вт. Дои:10.1038 / 179536a0. S2CID 4154444.
Wrinch, DM (1957). «Подход к синтезу полициклических пептидов». Природа. 180 (4584): 502–503. Bibcode:1957 Натур.180..502Вт. Дои:10.1038 / 180502b0. S2CID 4289278.
Wrinch, DM (1962). «Некоторые вопросы молекулярной биологии и последние достижения в органической химии малых пептидов». Природа. 193 (4812): 245–247. Bibcode:1962Натура.193..245Вт. Дои:10.1038 / 193245a0. PMID 14008494. S2CID 4252124.
Wrinch, DM (1963). «Последние достижения в химии циклов». Природа. 199 (4893): 564–566. Bibcode:1963 Натур.199..564 Вт. Дои:10.1038 / 199564a0. S2CID 4177095.
Wrinch, DM (1965). «Современная картина химических аспектов структур полипептидных цепей и некоторых проблем молекулярной биологии». Природа. 206 (4983): 459–461. Bibcode:1965Натура.206..459Вт. Дои:10.1038 / 206459a0. PMID 5319104. S2CID 4190760. - ^ Wrinch, DM (1960). Химические аспекты структур малых пептидов: введение. Копенгаген: Мунксгаард.
- ^ Wrinch, DM (1965). Химические аспекты структур полипептидных цепей и теория циклолов. Нью-Йорк: Пленум Пресс.
- ^ Каузманн, В (1993). «Воспоминания из жизни в физической химии белков». Белковая наука. 2 (4): 671–691. Дои:10.1002 / pro.5560020418. ЧВК 2142355. PMID 8518739.
- ^ Танфорд, C; Рейнольдс Дж (2001). Роботы природы: история белков. Оксфорд: Издательство Оксфордского университета. ISBN 0-19-850466-7.
- ^ Пайс, А (1986). Внутренняя связь: материи и сил в физическом мире. Издательство Оксфордского университета. ISBN 0-19-851971-0.
Бор, N (1913). «О строении атомов и молекул (Часть 1 из 3)». Философский журнал. 26: 1–25. Bibcode:1913ПМаг ... 26 .... 1Б. Дои:10.1080/14786441308634955. Архивировано из оригинал на 2007-07-04.
Бор, N (1913). «О строении атомов и молекул, часть II. Системы, содержащие только одно ядро». Философский журнал. 26 (153): 476–502. Bibcode:1913ПМаг ... 26..476Б. Дои:10.1080/14786441308634993.
Бор, N (1913). «О строении атомов и молекул, часть III». Философский журнал. 26: 857–875. Bibcode:1913ПМаг ... 26..857Б. Дои:10.1080/14786441308635031.
Бор, N (1914). «Спектры гелия и водорода». Природа. 92 (2295): 231–232. Bibcode:1913Натура..92..231Б. Дои:10.1038 / 092231d0. S2CID 11988018. - ^ Полинг, Л.; Кори РБ (1953). «Предлагаемая структура нуклеиновых кислот». Труды Национальной академии наук. 39 (2): 84–97. Bibcode:1953ПНАС ... 39 ... 84П. Дои:10.1073 / pnas.39.2.84. ЧВК 1063734. PMID 16578429.
- ^ Франклин, RE; Гослинг Р (1953). «Молекулярная конфигурация тимонуклеата натрия». Природа. 171 (4356): 740–741. Bibcode:1953 г., природа, 171..740F. Дои:10.1038 / 171740a0. PMID 13054694. S2CID 4268222.
- ^ а б Уотсон, JD; Крик Ф (1953). «Молекулярная структура нуклеиновых кислот: структура дезоксирибонуклеиновой кислоты». Природа. 171 (4356): 737–738. Bibcode:1953 г., природа. 171..737 Вт. Дои:10.1038 / 171737a0. PMID 13054692. S2CID 4253007.
- ^ Saenger, W (1988). Принципы структуры нуклеиновых кислот. Springer Verlag. ISBN 0-387-90762-9.
- ^ Пайс, А. (1982). Тонкость - это Господь: наука и жизнь Альберта Эйнштейна. Издательство Оксфордского университета. ISBN 0-19-853907-X.
дальнейшее чтение
- «Белковые единицы, помещенные в графическую клетку»'", Нью-Йорк Таймс, п. 14, 19 апреля 1940 г..
- "Вафельная теория белков", Нью-Йорк Таймс, п. E9, 2 февраля 1947 г..
- Сенешаль, Марджори, изд. (1980), Структуры материи и закономерности в науке, вдохновленные работой и жизнью Дороти Ринч, 1894–1976: Материалы симпозиума, состоявшегося в Смит-колледже, Нортгемптон, Массачусетс, 28–30 сентября 1977 г., Издательство "Шенкман".
- "Избранные статьи Дороти Ринч из собрания Софии Смит", в Структуры материи и закономерности в науке.
- Сенешаль, Марджори (2013), Я умерла за красоту: Дороти Ринч и культура науки, Oxford University Press.