WikiDer > Глутаматкарбоксипептидаза II
| глутаматкарбоксипептидаза II | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Схема реакции деградации NAAG под действием GCPII: GCPII + NAAG → комплекс GCPII-NAAG → глутамат + NAA | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.17.21 | ||||||||
| Количество CAS | 111070-04-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Глутаматкарбоксипептидаза II (GCPII), также известен как N-ацетил-L-аспартил-L-глутаматпептидаза I (NAALADase I), Пептидаза NAAG, или простатоспецифический мембранный антиген (PSMA) является фермент что у людей кодируется FOLH1 (фолат гидролаза 1) ген.[3] GCPII человека содержит 750 аминокислот и весит приблизительно 84 кДа.[4]
GCPII - это цинк металлофермент который находится в мембранах. Большая часть фермента находится во внеклеточном пространстве. GCPII - это мембрана класса II гликопротеин. Катализирует гидролиз N-ацетиласпартилглутамат (NAAG) в глутамат и N-ацетиласпартат (НАА) по схеме реакции справа.[5][6]
Нейробиологи в основном используют термин NAALADase в своих исследованиях, те, кто изучает метаболизм фолиевой кислоты, используют фолатгидролазу, а те, кто изучает рак простаты или онкологию, - PSMA. Все они относятся к одной и той же протеин глутаматкарбоксипептидазе II.
Открытие
GCPII в основном экспрессируется в четырех тканях тела, включая эпителий простаты, проксимальные канальцы почек, щеточную кайму тощей кишки тонкой кишки и ганглии нервной системы.[4][7][8]
Действительно, первоначальное клонирование кДНК, кодирующей ген, экспрессирующий PSMA, было выполнено с помощью РНК из линии клеток опухоли простаты, LNCaP.[9] PSMA имеет гомологию с рецептором трансферрина и подвергается эндоцитозу, но лиганд, индуцирующий интернализацию, не идентифицирован.[10] Было обнаружено, что PSMA был таким же, как мембранный белок в тонком кишечнике, ответственный за удаление гамма-связанных глутаматов из полигаммаглутамат фолиевой кислоты. Это позволяет высвобождать фолиевую кислоту, которая затем может транспортироваться в организм для использования в качестве витамина. Это привело к клонированному геномному обозначению PSMA как FOLH1 для фолатгидролазы.[11]
ПСМА (FOLH1) + фолат-полигаммаглутамат (n 1-7) ---> PSMA (FOLH1) + фолат (поли) гаммаглутамат (n-1) + глутамат, продолжая до высвобождения фолиевой кислоты.
Структура
Три домены внеклеточной части GCPII - протеаза, апикальный и С-концевой домены - взаимодействуют в распознавании субстрата.[6] Протеазный домен представляет собой центральный семицепочечный смешанный β-лист. Β-лист окружен 10 α-спиралями. Апикальный домен расположен между первой и второй цепями центрального β-листа протеазного домена. Апикальный домен создает карман, который облегчает связывание субстрата. С-концевой домен представляет собой пучок с четырьмя спиралями вверх-вниз-вверх-вниз.
Центральный карман имеет глубину примерно 2 нанометра и открывается из внеклеточного пространства в активный центр.[6] Этот активный центр содержит два иона цинка. Во время ингибирования каждый действует как лиганд кислорода в 2-PMPA или фосфате. Есть также один ион кальция, координированный в GCPII, далеко от активного центра. Было высказано предположение, что кальций удерживает вместе протеазный и апикальный домены.[6] Кроме того, человеческий GCPII имеет десять сайтов потенциальных гликозилирование, и многие из этих сайтов (в том числе некоторые далеко от каталитического домена) влияют на способность GCPII гидролизовать NAAG.[4]
Ген FOLH1 имеет несколько потенциальных стартовых сайтов и форм сплайсинга, что приводит к различиям в структуре мембранного белка, локализации и активности карбоксипептидазы в зависимости от исходной ткани.[4][12]
Кинетика ферментов
Гидролиз NAAG GCPII подчиняется Кинетика Михаэлиса – Ментен рассчитали константу связывания (Kм) для NAAG примерно 130 нМ, а константа оборота (kКот) примерно как 4 с−1.[6] Кажущаяся константа скорости второго порядка составляет примерно 3 × 107 (РС)−1.
Роль в раке
Человеческий PSMA сильно экспрессируется в простате, примерно в сто раз больше, чем в большинстве других тканей. При некоторых формах рака предстательной железы PSMA является вторым по активности генным продуктом с повышением в 8–12 раз по сравнению с уровнями в доброкачественных клетках простаты.[13] Из-за этой высокой экспрессии PSMA развивается как потенциальный биомаркер для терапии и визуализации некоторых видов рака.[14] При раке простаты человека опухоли с более высокой степенью экспрессии связаны с более быстрым прогрессированием и большим процентом пациентов, страдающих рецидивом.[15][16] В пробирке исследования с использованием клеточных линий рака простаты и груди со сниженным уровнем PSMA показали значительное снижение пролиферации, миграции, инвазии, адгезии и выживаемости клеток.[17]
Изображения
PSMA является целью нескольких ядерная медицина агенты для визуализации рака простаты. Выражение PSMA можно отобразить с помощью галлий-68 ПСМА или фтор-18 PSMA для позитронно-эмиссионная томография.[18][19][20] При этом используется небольшая молекула с радиоактивной меткой, которая с высокой аффинностью связывается с внеклеточным доменом рецептора PSMA. Ранее антитело, нацеленное на внутриклеточный домен (индий-111 капромабпентид, продаваемый как простаскинт),[21] хотя уровень обнаружения был низким.
В 2020 году результаты рандомизированного исследования фазы 3 («Исследование ProPSMA»)[22] было опубликовано сравнение ПЭТ / КТ Галлия-68 PSMA со стандартными изображениями (КТ и сканирование костей). Это исследование на 300 пациентов, проведенное в 10 исследованиях, продемонстрировало превосходную точность ПЭТ / КТ ПСМА (92% против 65%), более высокие значимые изменения в лечении (28% против 15%), менее двусмысленные / неопределенные результаты визуализации (7% против 23%). и меньшая лучевая нагрузка (10 мЗв против 19 мЗв). В исследовании сделан вывод, что ПЭТ / КТ с ПСМА является подходящей заменой традиционной визуализации, обеспечивая превосходную точность комбинированных результатов КТ и сканирования костей. Эта новая технология в настоящее время оценивается для утверждения FDA.[23]
Терапия
PSMA также может быть использован экспериментально в качестве мишени для лечения в лучевая терапия с открытым источником. Лютеций-177 это бета-излучатель которые можно комбинировать с молекулами, нацеленными на PSMA, для лечения опухолей простаты.[24] Перспектива фаза II исследования продемонстрировал ответ (определяемый снижением уровня ПСА на 50% и более) у 64% мужчин.[25] Общие побочные эффекты включают сухость во рту, сухую усталость, тошноту, сухость глаз и тромбоцитопению (снижение тромбоцитов). Ожидаются результаты рандомизированных исследований, включая фаза III VISION испытание.[26][27]
Деградация нейротрансмиттера
Для тех, кто изучает заболевания нервной системы, NAAG является одним из трех наиболее распространенных нейротрансмиттеров, обнаруженных в центральной нервной системе.[28] и когда он катализирует реакцию с образованием глутамата, он также производит другой нейротрансмиттер.[6] Глутамат является распространенным возбуждающим нейромедиатором в центральной нервной системе; однако, если происходит слишком большая передача глутамата, это может убить или, по крайней мере, повредить нейроны и было связано со многими неврологическими заболеваниями и расстройствами.[28] поэтому баланс, в который вносит вклад пептидаза NAAG, очень важен.
Возможные терапевтические применения
Функция в мозге
Было показано, что GCPII как косвенно, так и прямо увеличивает концентрацию глутамата во внеклеточном пространстве.[28] GCPII напрямую расщепляет NAAG на NAA и глутамат.[5][6] Было показано, что NAAG в высокой концентрации косвенно ингибирует высвобождение нейротрансмиттеров, таких как ГАМК и глутамат. Это происходит за счет взаимодействия и активации пресинаптических mGluR группы II.[28] Таким образом, в присутствии пептидазы NAAG, концентрация NAAG контролируется, а глутамат и ГАМК, среди других нейромедиаторов, не ингибируются.
Исследователи смогли показать, что эффективные и селективные ингибиторы GCPII способны снижать уровень глутамата в мозге и даже обеспечивать защиту от апоптоза или деградации нейронов мозга во многих моделях инсульта, бокового амиотрофического склероза и нейропатической боли на животных.[6] Считается, что это ингибирование этих пептидаз NAAG, иногда называемых NP, обеспечивает эту защиту от апоптоза или деградации нейронов головного мозга за счет повышения концентрации NAAG в синапсах нейронов.[28] Затем NAAG снижает высвобождение глутамата, одновременно стимулируя высвобождение некоторых трофических факторов из глиальных клеток в центральной нервной системе, что приводит к защите от апоптоза или деградации нейронов мозга.[28] Однако важно отметить, что эти ингибиторы NP не оказывают никакого влияния на нормальную функцию глутамата.[28] Ингибирование NP может улучшить естественную регуляцию вместо активации или ингибирования рецепторов, которые нарушили бы этот процесс.[28] Исследования также показали, что низкомолекулярные ингибиторы NP полезны на животных моделях, имеющих отношение к нейродегенеративным заболеваниям.[28] Некоторые конкретные применения этого исследования включают невропатическую и воспалительную боль, черепно-мозговую травму, ишемический инсульт, шизофрению, диабетическую невропатию, боковой амиотрофический склероз, а также наркоманию.[28] Предыдущие исследования показали, что препараты, снижающие передачу глутамата, могут облегчить невропатическую боль, хотя возникающие побочные эффекты ограничивают их клиническое применение.[29] Таким образом, похоже, что, поскольку GCPII задействуется исключительно с целью обеспечения источника глутамата при гиперглутаматергических и эксайтотоксических состояниях, это может быть альтернативой предотвращению этих побочных эффектов.[29] Другие результаты исследований показали, что гидролиз NAAG нарушается при шизофрении, и они показали, что определенные анатомические области мозга могут даже демонстрировать дискретные отклонения в синтезе GCP II, поэтому NP также могут быть терапевтическими для пациентов, страдающих шизофренией.[30] Одним из основных препятствий при использовании многих мощных ингибиторов GCPII, которые были приготовлены на сегодняшний день, являются, как правило, высокополярные соединения, что вызывает проблемы, потому что они не проникают легко через гематоэнцефалический барьер.[31]
Возможное использование ингибиторов пептидазы NAAG
Глутамат - это «первичный возбуждающий нейромедиатор нервной системы человека»,[28] участвует во множестве функций мозга. Чрезмерная стимуляция и активация рецепторов глутамата, а также «нарушения клеточных механизмов, которые защищают от неблагоприятных последствий активации физиологических рецепторов глутамата»[31] известно, что они вызывают повреждение и смерть нейронов, которые были связаны с множеством неврологических заболеваний.[28]
Из-за диапазона функции и присутствия глутамата было трудно создать глутаматергические препараты, которые не влияли бы отрицательно на другие необходимые функции и не вызывали бы нежелательных побочных эффектов.[32] Ингибирование пептидазы NAAG открыло возможность для нацеливания на конкретное лекарство.
Специфические ингибиторы
Ингибиторы пептидазы NAAG широко создавались и изучались, поскольку они были перспективны для лечения возможных неврологических заболеваний и нацеливания на конкретные лекарственные препараты. Вот несколько примеров малых молекул:[28]
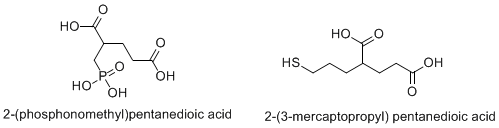
- 2-ПМПА и аналоги
- Производные тиола и индола тиола
- Производные гидроксамата
- Конформационно сжатые дипептидные миметики
- Ингибиторы на основе PBDA и мочевины.
Другие возможные терапевтические применения
Невропатическая и воспалительная боль
Боль, вызванная повреждением ЦНС или ПНС, была связана с увеличением концентрации глутамата. Ингибирование NAAG снижает присутствие глутамата и, таким образом, может уменьшить боль.[28] (Neale JH et al., 2005). Nagel et al.[32] использовали ингибитор 2-PMPA, чтобы продемонстрировать анальгетический эффект ингибирования пептидазы NAAG. За этим исследованием последовало исследование Chen et al.,[33] который показал аналогичные результаты.[32]
Повреждение головы
Тяжелая травма головы (SHI) и черепно-мозговая травма (TBI) широко распространены и имеют огромное влияние. «Они являются основной причиной смерти детей и молодых людей (<25 лет) и составляют четверть всех смертей в возрастной группе от 5 до 15 лет».[34] После первоначального воздействия уровни глутамата повышаются и вызывают эксайтотоксическое повреждение в процессе, который хорошо охарактеризован.[28] Обладая способностью снижать уровень глутамата, ингибирование NAAG показало себя многообещающим в предотвращении неврологических повреждений, связанных с SHI и TBI.
Инсульт
По данным Национальной ассоциации инсульта,[35] Инсульт является третьей по значимости причиной смерти и основной причиной инвалидности взрослых. Считается, что уровни глутамата вызывают основное ишемическое повреждение во время инсульта, и, таким образом, ингибирование NAAG могло бы уменьшить это повреждение.[28]
Шизофрения
Шизофрения это психическое расстройство, которым страдает 1% людей во всем мире.[36] Его можно смоделировать с помощью PCP на лабораторных животных, и было показано, что агонисты mGluR снижают эффекты препарата. Таким образом, NAAG является агонистом mGluR. Таким образом, ингибирование фермента, который снижает концентрацию NAAG, пептидазы NAAG, может обеспечить практическое лечение для уменьшения симптомов шизофрении.[28]
Диабетическая невропатия
Сахарный диабет может привести к повреждению нервов, потере чувствительности, боли или, если вегетативные нервы связаны, к повреждению кровеносной, репродуктивной или пищеварительной систем, среди прочего. Считается, что более 60% пациентов с диабетом страдают той или иной формой невропатии,[28] однако серьезность разнится. Невропатия не только напрямую причиняет вред и ущерб, но также может косвенно привести к таким проблемам, как диабетические язвы, которые, в свою очередь, могут привести к ампутации. Фактически, более половины всех ампутаций нижних конечностей в США приходится на пациентов с диабетом.[37]
Посредством использования ингибитора пептидазы NAAG 2-PMPA, расщепление NAAG было ингибировано и с его помощью запрограммирована гибель нейронных клеток DRG в присутствии высоких уровней глюкозы.[38] Исследователи предположили, что причиной этого является агонистическая активность NAAG в отношении mGluR3. Кроме того, NAAG также «предотвращал индуцированное глюкозой ингибирование роста нейритов» (Berent-Spillson, et al. 2004). В целом, это делает ингибирование GCPIII четкой модельной мишенью для борьбы с диабетической невропатией.
Наркотическая зависимость
Шизофрения, как описано ранее, обычно моделируется в лаборатории с помощью животной модели PCP. Поскольку в этой модели было показано, что ингибирование GCPIII может ограничивать шизофреническое поведение,[28] это говорит о том, что ингибирование GCPIII, таким образом, снижает эффект PCP. Кроме того, было доказано, что вознаграждающее действие многих лекарств (кокаина, PCP, алкоголя, никотина и т. Д.) Связано с уровнями глутамата, на которые NAAG и GCPIII могут оказывать регулирующее действие.[28]
Таким образом, результаты нескольких исследований лекарственных средств позволяют сделать вывод, что:[28]
- Система NAAG / NP может быть задействована в нейронных механизмах, регулирующих индуцированную сигналом тягу к кокаину, развитие киндлинга кокаиновых припадков и управление опиоидной зависимостью и потреблением алкоголя. Следовательно, ингибиторы NP могут предоставить новую терапию для таких состояний.
Прочие болезни и расстройства
Ингибирование NAAG также изучалось как средство лечения рака простаты, БАС и других нейродегенеративных заболеваний, таких как болезнь Паркинсона и болезнь Хантингтона.[28]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000086205 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ O'Keefe DS, Su SL, Bacich DJ, Horiguchi Y, Luo Y, Powell CT и др. (Ноябрь 1998 г.). «Картирование, геномная организация и анализ промотора гена человеческого простатоспецифического мембранного антигена». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1443 (1–2): 113–27. Дои:10.1016 / s0167-4781 (98) 00200-0. PMID 9838072.
- ^ а б c d Баринка С., Саха П., Скленар Дж., Ман П., Безуска К., Слушер Б.С., Конвалинка Дж. (Июнь 2004 г.). «Идентификация сайтов N-гликозилирования на глутаматкарбоксипептидазе II, необходимых для протеолитической активности». Белковая наука. 13 (6): 1627–35. Дои:10.1110 / пс 04622104. ЧВК 2279971. PMID 15152093.
- ^ а б Рохас С., Фрейзер С.Т., Флэнари Дж., Слашер Б.С. (ноябрь 2002 г.). «Кинетика и ингибирование глутаматкарбоксипептидазы II с использованием анализа на микропланшете». Аналитическая биохимия. 310 (1): 50–4. Дои:10.1016 / S0003-2697 (02) 00286-5. PMID 12413472.
- ^ а б c d е ж г час Mesters JR, Barinka C, Li W, Tsukamoto T., Majer P, Slusher BS и др. (Март 2006 г.). «Структура глутаматкарбоксипептидазы II, лекарственной мишени при повреждении нейронов и раке простаты». Журнал EMBO. 25 (6): 1375–84. Дои:10.1038 / sj.emboj.7600969. ЧВК 1422165. PMID 16467855.
- ^ Sácha P, Zámecník J, Barinka C, Hlouchová K, Vícha A, Mlcochová P и др. (Февраль 2007 г.). «Экспрессия глутаматкарбоксипептидазы II в мозге человека». Неврология. 144 (4): 1361–72. Дои:10.1016 / j.neuroscience.2006.10.022. PMID 17150306. S2CID 45351503.
- ^ Mhawech-Fauceglia P, Zhang S, Terracciano L, Sauter G, Chadhuri A, Herrmann FR, Penetrante R (март 2007 г.). «Экспрессия белка простатоспецифического мембранного антигена (PSMA) в нормальных и неопластических тканях и его чувствительность и специфичность при аденокарциноме простаты: иммуногистохимическое исследование с использованием метода микроматрицы множественной [sic] опухолевой ткани». Гистопатология. 50 (4): 472–83. Дои:10.1111 / j.1365-2559.2007.02635.x. PMID 17448023. S2CID 23454712.
- ^ Израильская RS, Пауэлл, Коннектикут, Ярмарка WR, Хестон, WD (январь 1993 г.) «Молекулярное клонирование комплементарной ДНК, кодирующей специфический мембранный антиген простаты». Исследования рака. 53 (2): 227–30. PMID 8417812.
- ^ Гудман О.Б., Барве С.П., Риттер Б., Макферсон П.С., Васько А.Дж., Кин Дж.Х. и др. (Ноябрь 2007 г.). «Взаимодействие простатоспецифического мембранного антигена с клатрином и адаптерным белковым комплексом-2». Международный журнал онкологии. 31 (5): 1199–203. Дои:10.3892 / ijo.31.5.1199. PMID 17912448.
- ^ Пинто Дж. Т., Суффолетто Б. П., Берзин Т. М., Цяо С. Н., Лин С., Тонг В. П. и др. (Сентябрь 1996 г.). «Простатоспецифический мембранный антиген: новая фолат-гидролаза в клетках карциномы предстательной железы человека». Клинические исследования рака. 2 (9): 1445–51. PMID 9816319.
- ^ О'Киф Д. С., Бэчич Д. Д., Хестон В. Д. (2001). «Простатоспецифический мембранный антиген». В Simons JW, Chung LW, Isaacs WB (ред.). Рак простаты: биология, генетика и новые методы лечения. Тотова, Нью-Джерси: Humana Press. С. 307–326. ISBN 978-0-89603-868-4.
- ^ О'Киф Д. С., Бэчич Д. Д., Хестон В. Д. (февраль 2004 г.). «Сравнительный анализ простатоспецифического мембранного антигена (PSMA) по сравнению с простатоспецифическим мембранным антигеноподобным геном». Простаты. 58 (2): 200–10. Дои:10.1002 / pros.10319. PMID 14716746. S2CID 25780520.
- ^ Ван X, Инь Л., Рао П., Стейн Р., Харш К. М., Ли З., Хестон В. Д. (октябрь 2007 г.). «Адресное лечение рака простаты». Журнал клеточной биохимии. 102 (3): 571–9. Дои:10.1002 / jcb.21491. PMID 17685433. S2CID 46594564.
- ^ Пернер С., Хофер, доктор медицины, Ким Р., Шах Р. Б., Ли Х., Мёллер П. и др. (Май 2007 г.). «Экспрессия простатоспецифического мембранного антигена как предиктор прогрессирования рака простаты». Патология человека. 38 (5): 696–701. Дои:10.1016 / j.humpath.2006.11.012. PMID 17320151.
- ^ Росс Дж. С., Шихан К. Э., Фишер Х. А., Кауфман Р. П., Каур П., Грей К. и др. (Декабрь 2003 г.). «Корреляция экспрессии первичного опухолевого простатоспецифического мембранного антигена с рецидивом рака простаты». Клинические исследования рака. 9 (17): 6357–62. PMID 14695135.
- ^ Zhang Y, Guo Z, Du T, Chen J, Wang W, Xu K и др. (Июнь 2013). «Простатоспецифический мембранный антиген (PSMA): новый модулятор p38 для пролиферации, миграции и выживания в клетках рака простаты». Простаты. 73 (8): 835–41. Дои:10.1002 / pros.22627. PMID 23255296. S2CID 35257177.
- ^ Маурер Т., Эйбер М., Швайгер М., Гшвенд Дж. Э. (апрель 2016 г.). «Текущее использование PSMA-PET в лечении рака простаты». Обзоры природы. Урология. 13 (4): 226–35. Дои:10.1038 / nrurol.2016.26. PMID 26902337. S2CID 2448922.
- ^ Фендлер В.П., Эйбер М., Бехешти М., Боманджи Дж., Сеси Ф., Чо С. и др. (Июнь 2017). «68Ga-PSMA PET / CT: Совместное руководство по процедурам EANM и SNMMI для визуализации рака простаты: версия 1.0» (PDF). Европейский журнал ядерной медицины и молекулярной визуализации. 44 (6): 1014–1024. Дои:10.1007 / s00259-017-3670-z. PMID 28283702. S2CID 5882407.
- ^ Ekmekcioglu Ö, Busstra M, Klass ND, Verzijlbergen F (октябрь 2019 г.). «Преодоление разрыва в визуализации: ПЭТ / КТ с ПСМА оказывает большое влияние на планирование лечения пациентов с раком простаты с биохимическим рецидивом - обзор литературы». Журнал ядерной медицины. 60 (10): 1394–1398. Дои:10.2967 / jnumed.118.222885. PMID 30850500.
- ^ Virgolini I, Decristoforo C, Haug A, Fanti S, Uprimny C (март 2018 г.). «Современное состояние тераностики при раке простаты». Европейский журнал ядерной медицины и молекулярной визуализации. 45 (3): 471–495. Дои:10.1007 / s00259-017-3882-2. ЧВК 5787224. PMID 29282518.
- ^ Hofman MS, Lawrentschuk N, Francis RJ, Tang C, Vela I, Thomas P и др. (Апрель 2020 г.). «ПЭТ-КТ с простатеспецифическим мембранным антигеном у пациентов с раком простаты высокого риска перед лечебной операцией или лучевой терапией (проПСМА): проспективное рандомизированное многоцентровое исследование» (PDF). Ланцет. 395 (10231): 1208–1216. Дои:10.1016 / S0140-6736 (20) 30314-7. PMID 32209449. S2CID 214609500.
- ^ «ПСМА ПЭТ-КТ точно определяет распространение рака простаты». Национальный институт рака. 11 мая 2020.
- ^ Эмметт Л., Уиллоусон К., Вайолет Дж., Шин Дж., Бланксби А., Ли Дж. (Март 2017 г.). «177 Радионуклидная терапия ПСМА для мужчин с раком простаты: обзор современной литературы и обсуждение практических аспектов терапии». Журнал медицинских радиационных наук. 64 (1): 52–60. Дои:10.1002 / jmrs.227. ЧВК 5355374. PMID 28303694.
- ^ Вайолет Дж., Сандху С., Иравани А., Фердинандус Дж., Тханг С.П., Конг Дж. И др. (Июнь 2020 г.). «177Lu-PSMA-617 Тераностика при метастатическом устойчивом к кастрации раке простаты». Журнал ядерной медицины. 61 (6): 857–865. Дои:10.2967 / jnumed.119.236414. ЧВК 7262220. PMID 31732676.
- ^ Номер клинического исследования NCT03511664 для "VISION: Международное, проспективное, открытое, многоцентровое, рандомизированное исследование фазы 3 177Lu-PSMA-617 в лечении пациентов с прогрессирующим PSMA-положительным метастатическим устойчивым к кастрации раком простаты (mCRPC)" ClinicalTrials.gov
- ^ Вестер HJ, Schottelius M (июль 2019 г.). «Радиофармацевтические препараты, нацеленные на ПСМА, для визуализации и терапии». Семинары по ядерной медицине. 49 (4): 302–312. Дои:10.1053 / j.semnuclmed.2019.02.008. PMID 31227053.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v Чжоу Дж., Нил Дж. Х., Помпер М. Г., Козиковски А. П. (декабрь 2005 г.). «Ингибиторы пептидазы NAAG и их потенциал для диагностики и терапии». Обзоры природы. Открытие наркотиков. 4 (12): 1015–26. Дои:10.1038 / nrd1903. PMID 16341066. S2CID 21807952.
- ^ а б Чжан В., Муракава Ю., Возняк К.М., Слушер Б., Сыма А.А. (сентябрь 2006 г.). «Профилактические и терапевтические эффекты ингибирования GCPII (NAALADase) на болезненную и сенсорную диабетическую невропатию». Журнал неврологических наук. 247 (2): 217–23. Дои:10.1016 / j.jns.2006.05.052. PMID 16780883. S2CID 11547550.
- ^ Ghose S, Weickert CS, Colvin SM, Coyle JT, Herman MM, Hyde TM, Kleinman JE (январь 2004 г.). «Экспрессия гена глутаматкарбоксипептидазы II в лобной и височной долях человека при шизофрении». Нейропсихофармакология. 29 (1): 117–25. Дои:10.1038 / sj.npp.1300304. PMID 14560319.
- ^ а б Козиковски А.П., Нан Ф., Конти П., Чжан Дж., Рамадан Э., Бздега Т. и др. (Февраль 2001 г.). «Разработка удивительно простых, но эффективных ингибиторов глутаматкарбоксипептидазы II (NAALADase) на основе мочевины». Журнал медицинской химии. 44 (3): 298–301. Дои:10.1021 / jm000406m. PMID 11462970.
- ^ а б c Нагель Дж., Белозерцева И., Греко С., Кашкин В., Малышкин А., Джиргенсонс А. и др. (Декабрь 2006 г.). «Эффекты ингибитора пептидазы NAAG 2-PMPA в модели хронической боли - зависимость от концентрации в мозге». Нейрофармакология. 51 (7–8): 1163–71. Дои:10.1016 / j.neuropharm.2006.07.018. PMID 16926034. S2CID 21499770.
- ^ Чен С.Р., Возняк К.М., Слушер Б.С., Пан Х.Л. (февраль 2002 г.). «Влияние 2- (фосфоно-метил) -пентандиовой кислоты на аллодинию и афферентные эктопические разряды в модели нейропатической боли на крысах». Журнал фармакологии и экспериментальной терапии. 300 (2): 662–7. Дои:10.1124 / jpet.300.2.662. PMID 11805230.
- ^ Толиас С., Вассерберг Дж. (2002). «Принятие критических решений при лечении тяжелых травм головы». Травма. 4 (4): 211–221. Дои:10.1191 / 1460408602ta246oa. S2CID 72178402.
- ^ "Что такое инсульт". Национальная ассоциация инсульта. Архивировано из оригинал на 2006-05-16. Получено 2009-01-15.
- ^ "Шизофрения". Национальный информационный центр психического здоровья. Архивировано из оригинал на 2009-03-20. Получено 2009-01-15.
- ^ «Диабетические невропатии: повреждение нервов при диабете». Национальный институт диабета, болезней органов пищеварения и почек, Национальные институты здравоохранения. 2009. Архивировано с оригинал на 2005-01-13. Получено 2009-01-15.
- ^ Берент-Спилсон А., Робинсон А.М., Головой Д., Слашер Б., Рохас С., Рассел Дж. В. (апрель 2004 г.). «Защита от индуцированной глюкозой гибели нейронов с помощью NAAG и ингибирования GCP II регулируется mGluR3» (PDF). Журнал нейрохимии. 89 (1): 90–9. Дои:10.1111 / j.1471-4159.2003.02321.x. HDL:2027.42/65724. PMID 15030392. S2CID 7892733.
внешние ссылки
- В МЕРОПЫ онлайн-база данных пептидаз и их ингибиторов: M20.001
- Банк данных белков: Банк данных белков
- Глутамат + карбоксипептидаза + II в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt: Q04609 (Глутаматкарбоксипептидаза 2) на PDBe-KB.