WikiDer > Глицерин-3-фосфатдегидрогеназа
| Глицерин-3-фосфатдегидрогеназа (НАД+) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллографическая структура глицерин-3-фосфатдегидрогеназы человека 1.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.1.1.8 | ||||||||
| Количество CAS | 9075-65-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Глицерин-3-фосфатдегидрогеназа (хинон) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.1.5.3 | ||||||||
| Количество CAS | 9001-49-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| N-конец NAD-зависимой глицерин-3-фосфатдегидрогеназы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура n- (1-d-карбоксилэтил) -1-норвалиндегидрогеназы из Arthrobacter sp. штамм 1c | |||||||||
| Идентификаторы | |||||||||
| Символ | NAD_Gly3P_dh_N | ||||||||
| Pfam | PF01210 | ||||||||
| Pfam клан | CL0063 | ||||||||
| ИнтерПро | IPR011128 | ||||||||
| PROSITE | PDOC00740 | ||||||||
| SCOP2 | 1 мин. 66 / Объем / СУПФАМ | ||||||||
| |||||||||
| НАД-зависимая глицерин-3-фосфатдегидрогеназа С-конец | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура глицерин-3-фосфатдегидрогеназы из archaeoglobus fulgidus | |||||||||
| Идентификаторы | |||||||||
| Символ | NAD_Gly3P_dh_C | ||||||||
| Pfam | PF07479 | ||||||||
| Pfam клан | CL0106 | ||||||||
| ИнтерПро | IPR006109 | ||||||||
| PROSITE | PDOC00740 | ||||||||
| SCOP2 | 1 мин. 66 / Объем / СУПФАМ | ||||||||
| |||||||||
Глицерин-3-фосфатдегидрогеназа (GPDH) является фермент который катализирует обратимое окислительно-восстановительное превращение дигидроксиацетонфосфат (он же глицеронфосфат, устаревший) на sn-глицерин 3-фосфат.[2]
Глицерин-3-фосфатдегидрогеназа служит основным связующим звеном между углеводный обмен и липидный обмен. Это также основной вклад электронов в электронная транспортная цепь в митохондрии.
Более старые термины для глицерин-3-фосфатдегидрогеназы включают: альфа-глицерин-3-фосфатдегидрогеназа (alphaGPDH) и глицеролфосфатдегидрогеназа (GPDH). Однако глицерин-3-фосфатдегидрогеназа - это не то же самое, что глицеральдегид-3-фосфатдегидрогеназа (GAPDH), субстратом которого является альдегид не алкоголь.
Метаболическая функция
GPDH играет важную роль в липидном биосинтез. За счет сокращения дигидроксиацетонфосфат в глицерин 3-фосфат, GPDH позволяет запрашивать дефосфорилирование из глицерин 3-фосфат в глицерин.[3] Кроме того, GPDH является одним из ферментов, участвующих в поддержании окислительно-восстановительный потенциал через внутренняя митохондриальная мембрана.[3]
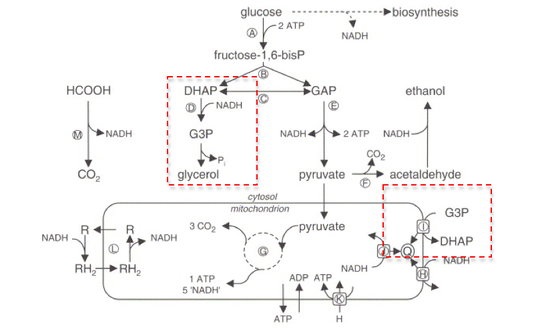
Реакция
В НАД +/НАДН кофермент пара действует как электронный резервуар для метаболических редокс реакции, переносящие электроны от одной реакции к другой.[5] Большинство этих метаболических реакций происходит в митохондрии. Возродить НАД + для дальнейшего использования, НАДН бассейны в цитозоль необходимо повторно окислить. Поскольку митохондриальная внутренняя мембрана непроницаем для обоих НАДН и НАД +, ими нельзя свободно обмениваться между цитозоль и митохондриальный матрикс.[4]
Один из способов перенести этот восстанавливающий эквивалент через мембрану - через Глицерин-3-фосфатный челнок, в котором используются две формы GPDH:
- Цитозольный GPDH, или GPD1, локализован на внешней мембране митохондрий, обращенной к цитозоль, и катализирует снижение дигидроксиацетонфосфат в глицерин-3-фосфат.
- Вместе с тем митохондриальный GPDH или GPD2 встраивается на внешнюю поверхность внутренняя митохондриальная мембрана, с видом на цитозоль, и катализирует окисление глицерин-3-фосфат к дигидроксиацетонфосфат.[6]
Реакции, катализируемые цитозольным (растворимым) и митохондриальным GPDH, следующие:
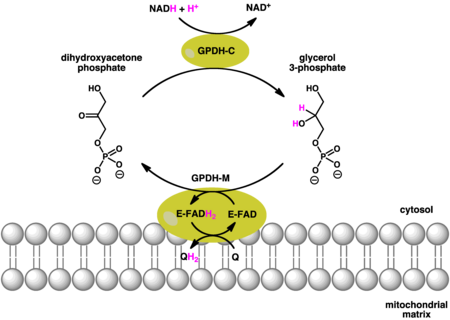 Сопряженные реакции, катализируемые цитозольной (GPDH-C) и митохондриальной (GPDH-M) формами глицерин-3-фосфатдегидрогеназы.[7] Использование GPDH-C и GPDH-M НАДН и хинол (QH) как доноры электронов соответственно. ГПДХ-М дополнительно использует FAD как сопутствующий фактор. |
Варианты
Есть две формы GPDH:
| Фермент | Протеин | Ген | |||||
|---|---|---|---|---|---|---|---|
| Номер ЕС | имя | Донор / Акцептор | имя | Субклеточное расположение | Сокращение | имя | Символ |
| 1.1.1.8 | глицерин-3-фосфатдегидрогеназа | НАДН / НАД+ | Глицерин-3-фосфатдегидрогеназа [НАД+] | цитоплазматический | GPDH-C | глицерин-3-фосфатдегидрогеназа 1 (растворимая) | GPD1 |
| 1.1.5.3 | глицерин-3-фосфатдегидрогеназа | хинол / хинон | Глицерин-3-фосфатдегидрогеназа | митохондриальный | ГПДХ-М | глицерин-3-фосфатдегидрогеназа 2 (митохондриальная) | GPD2 |
Следующие гены человека кодируют белки с ферментативной активностью GPDH:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
GPD1
Цитозольная глицерин-3-фосфатдегидрогеназа (GPD1) представляет собой НАД +-зависимый фермент[8] что уменьшает дигидроксиацетонфосфат к глицерин-3-фосфат. Одновременно, НАДН окисляется до НАД + в следующей реакции:
Как результат, НАД + регенерируется для дальнейшей метаболической активности.
GPD1 состоит из двух субъединиц,[9] и реагирует с дигидроксиацетонфосфат и НАД + хотя следующее взаимодействие:
Рисунок 4. Предполагаемый активный сайт. Фосфатная группа DHAP наполовину окружена боковой цепью Arg269 и взаимодействует с Arg269 и Gly268 непосредственно за счет водородных связей (не показаны). Консервативные остатки Lys204, Asn205, Asp260 и Thr264 образуют стабильную сеть водородных связей. Другая сеть водородных связей включает остатки Lys120 и Asp260, а также упорядоченную молекулу воды (с B-фактором 16,4 Å2), которая связывается водородом с Gly149 и Asn151 (не показано). В этих двух электростатических сетях только ε-NH3+ Группа Lys204 является ближайшей к атому C2 DHAP (3,4 Å).[1]
GPD2
Митохондриальная глицерин-3-фосфатдегидрогеназа (GPD2), катализирует необратимое окисление глицерин-3-фосфат к дигидроксиацетонфосфат и одновременно переносит два электрона из FAD к электронная транспортная цепь. GPD2 состоит из 4 идентичных субъединиц.[10]
Ответ на стрессы окружающей среды
- Исследования показывают, что на GPDH в основном не влияют pH изменения: ни GPD1, ни GPD2 не одобряются некоторыми pH условия.
- При высоких концентрациях соли (например, NaCl) Активность GPD1 усиливается по сравнению с GPD2, так как увеличение солености среды приводит к накоплению глицерин в ответ.
- Изменения температуры, похоже, не в пользу ни GPD1, ни GPD2.[11]
Глицерин-3-фосфатный челнок
Цитозоль вместе с митохондриальной глицерин-3-фосфатдегидрогеназой работают согласованно. Окисление цитоплазмы НАДН цитозольной формой фермента создает глицерин-3-фосфат из дигидроксиацетонфосфата. Как только глицерин-3-фосфат прошел через внешняя митохондриальная мембрана затем он может быть окислен отдельной изоформой глицерин-3-фосфатдегидрогеназы, которая использует хинон как окислитель и FAD как сопутствующий фактор. В результате возникает чистая потеря энергии, сравнимая с одной молекулой АТФ.[7]
Комбинированное действие этих ферментов поддерживает НАД +/НАДН соотношение, которое обеспечивает непрерывную работу метаболизма.
Роль в болезни
Фундаментальная роль GDPH в поддержании НАД +/НАДН потенциал, а также его роль в липидный обмен, делает GDPH фактором заболеваний липидного дисбаланса, таких как ожирение.
- Повышенная активность GPDH, особенно GPD2, приводит к увеличению глицерин производство. поскольку глицерин это главный подразделение в липидный обмен, его обилие легко может привести к увеличению триглицерид накопление на клеточном уровне. В результате появляется тенденция к образованию жировая ткань приводя к накоплению жир это благоприятствует ожирение.[12]
- Было также установлено, что GPDH играет роль в Синдром Бругада. Мутации в ген кодирование GPD1, как было доказано, вызывает дефекты в электронная транспортная цепь. Этот конфликт с НАД +/НАДН считается, что уровни в клетке способствуют дефектам сердечной ионный канал натрия регулирования и может привести к летальному исходу аритмия в младенчестве.[13]
Фармакологическая мишень
Считается, что митохондриальная изоформа дегидрогеназы G3P ингибируется метформин, препарат первой линии для диабет 2 типа.[14]
Биологические исследования
Саркофага барбата был использован для изучения окисления L-3-глицерофосфата в митохондриях. Установлено, что L-3-глицерофосфат не проникает в матрикс митохондрий, в отличие от пирувата. Это помогает найти L-3-глицерофосфат-флавопротеин оксидоредуктазу, которая находится на внутренней мембране митохондрий.
Структура
Глицерин-3-фосфатдегидрогеназа состоит из двух белковые домены. В N-концевой домен является НАД-binding домен, а C-конец действует как субстрат-связывающий домен.[15] Однако димерные и тетрамерные интерфейсные остатки участвуют в связывании GAPDH-РНК, поскольку GAPDH может проявлять несколько «подработок», включая модуляцию связывания и / или стабильности РНК.[16]
Смотрите также
- страницы-подложки: глицерин 3-фосфат, дигидроксиацетонфосфат
- похожие темы: глицеринфосфатный челнок, креатинкиназа, гликолиз, глюконеогенез
использованная литература
- ^ а б PDB: 1X0V; Оу Х, Джи Си, Хан Х, Чжао Х, Ли Х, Мао И, Вонг Л.Л., Бартлам М., Рао З. (март 2006 г.). «Кристаллические структуры человеческой глицерин-3-фосфатдегидрогеназы 1 (GPD1)». Журнал молекулярной биологии. 357 (3): 858–69. Дои:10.1016 / j.jmb.2005.12.074. PMID 16460752.
- ^ Оу Х, Джи Си, Хан Х, Чжао Х, Ли Х, Мао И, Вонг Л.Л., Бартлам М., Рао З. (март 2006 г.). «Кристаллические структуры человеческой глицерин-3-фосфатдегидрогеназы 1 (GPD1)». Журнал молекулярной биологии. 357 (3): 858–69. Дои:10.1016 / j.jmb.2005.12.074. PMID 16460752.
- ^ а б Harding JW, Pyeritz EA, Copeland ES, White HB (январь 1975 г.). «Роль глицерин-3-фосфатдегидрогеназы в метаболизме глицеридов. Влияние диеты на активность ферментов в куриной печени». Биохимический журнал. 146 (1): 223–9. Дои:10.1042 / bj1460223. ЧВК 1165291. PMID 167714.
- ^ а б Гертман Дж. М., ван Марис А. Дж., Ван Дейкен Дж. П., Пронк Дж. Т. (ноябрь 2006 г.). «Физиологическая и генная инженерия цитозольного окислительно-восстановительного метаболизма в Saccharomyces cerevisiae для улучшения производства глицерина». Метаболическая инженерия. 8 (6): 532–42. Дои:10.1016 / j.ymben.2006.06.004. PMID 16891140.
- ^ Анселл Р., Гранат К., Хоманн С., Тевелейн Дж. М., Адлер Л. (май 1997 г.). «Два изофермента дрожжевой НАД + -зависимой глицерин-3-фосфатдегидрогеназы, кодируемой GPD1 и GPD2, играют разные роли в осмоадаптации и окислительно-восстановительной регуляции». Журнал EMBO. 16 (9): 2179–87. Дои:10.1093 / emboj / 16.9.2179. ЧВК 1169820. PMID 9171333.
- ^ Кота В., Рай П., Вейцель Дж. М., Миддендорф Р., Бханде СС, Шиваджи С. (сентябрь 2010 г.). «Роль глицерин-3-фосфатдегидрогеназы 2 в емкости спермы мышей». Молекулярное воспроизводство и развитие. 77 (9): 773–83. Дои:10.1002 / mrd.21218. PMID 20602492. S2CID 19691537.
- ^ а б Страйер, Люберт; Берг, Джереми Марк; Тимочко, Джон Л. (2002). "Глава 18.5: Глицерин-3-фосфатный шаттл". Биохимия. Сан-Франциско: W.H. Фримен. ISBN 0-7167-4684-0.
- ^ Гуиндалини С., Ли К.С., Андерсен М.Л., Сантос-Силва Р., Биттенкур Л.Р., Туфик С. (январь 2010 г.). «Влияние обструктивного апноэ во сне на экспрессию гена глицерин-3-фосфатдегидрогеназы 1». Экспериментальная биология и медицина. 235 (1): 52–6. Дои:10.1258 / ebm.2009.009150. PMID 20404019. S2CID 207194967. Архивировано из оригинал на 2011-07-24. Получено 2011-05-16.
- ^ Bunoust O, Devin A, Avéret N, Camougrand N, Rigoulet M (февраль 2005 г.). «Конкуренция электронов за вход в дыхательную цепь: новый регуляторный механизм окислительного метаболизма у Saccharomyces cerevisiae». Журнал биологической химии. 280 (5): 3407–13. Дои:10.1074 / jbc.M407746200. PMID 15557339.
- ^ Кота В., Дхопл В.М., Шиваджи С. (апрель 2009 г.). «Тирозинфосфопротеом сперматозоидов хомяка: роль глицерин-3-фосфатдегидрогеназы 2 в емкости сперматозоидов». Протеомика. 9 (7): 1809–26. Дои:10.1002 / pmic.200800519. PMID 19333995. S2CID 9248320.
- ^ Кумар С., Кальянасундарам Г. Т., Гуммади С. Н. (февраль 2011 г.). «Дифференциальный ответ каталазы, супероксиддисмутазы и глицерин-3-фосфатдегидрогеназы на различные стрессы окружающей среды у Debaryomyces nepalensis NCYC 3413». Современная микробиология. 62 (2): 382–7. Дои:10.1007 / s00284-010-9717-z. PMID 20644932. S2CID 41613712.
- ^ Сюй С.П., Мао XY, Рен Ф.З., Че Х.Л. (февраль 2011 г.). «Ослабляющее действие гликомакропептида казеина на пролиферацию, дифференцировку и накопление липидов в преадипоцитах крыс линии Sprague-Dawley in vitro». Журнал молочной науки. 94 (2): 676–83. Дои:10.3168 / jds.2010-3827. PMID 21257036.
- ^ Ван Норстранд DW, Вальдивия CR, Tester DJ, Ueda K, London B, Makielski JC, Ackerman MJ (ноябрь 2007 г.). «Молекулярная и функциональная характеристика мутаций нового гена, подобного глицерин-3-фосфатдегидрогеназе 1 (GPD1-L), при синдроме внезапной детской смерти». Тираж. 116 (20): 2253–9. Дои:10.1161 / CIRCULATIONAHA.107.704627. ЧВК 3332545. PMID 17967976.
- ^ Ферраннини Э (октябрь 2014 г.). «Мишень метформина при диабете 2 типа». Медицинский журнал Новой Англии. 371 (16): 1547–8. Дои:10.1056 / NEJMcibr1409796. PMID 25317875.
- ^ Суреш С., Терли С., Оппердоус Ф. Р., Михелс П. А., Хол РГ (май 2000 г.). «Потенциальный целевой фермент для трипаноцидных препаратов, выявленный кристаллической структурой НАД-зависимой глицерин-3-фосфатдегидрогеназы из Leishmania mexicana». Структура. 8 (5): 541–52. Дои:10.1016 / s0969-2126 (00) 00135-0. PMID 10801498.
- ^ Уайт М.Р., Хан М.М., Дередж Д., Росс С.Р., Квинтин Р., Цуккони Б.Е., Высоцкий В.Х., Винтроде П.Л., Уилсон Г.М., Гарсин Е.Д. (январь 2015 г.). «Мутация интерфейса димера в глицеральдегид-3-фосфатдегидрогеназе регулирует его связывание с AU-богатой РНК». Журнал биологической химии. 290 (3): 1770–85. Дои:10.1074 / jbc.M114.618165. ЧВК 4340419. PMID 25451934.
дальнейшее чтение
- Барановский Т. (1963). «α-Глицерофосфатдегидрогеназа». В Boyer PD, Lardy H, Myrbäck K (ред.). Ферменты (2-е изд.). Нью-Йорк: Academic Press. С. 85–96.
- Brosemer RW, Kuhn RW (май 1969 г.). «Сравнительные структурные свойства альфа-глицерофосфатдегидрогеназ медоносной пчелы и кролика». Биохимия. 8 (5): 2095–105. Дои:10.1021 / bi00833a047. PMID 4307630.
- О'Брайен SJ, Макинтайр RJ (октябрь 1972 г.). «-Глицерофосфатный цикл у Drosophila melanogaster. I. Биохимические аспекты и аспекты развития». Биохимическая генетика. 7 (2): 141–61. Дои:10.1007 / BF00486085. PMID 4340553. S2CID 22009695.
- Warkentin DL, Fondy TP (июль 1973 г.). «Выделение и характеристика цитоплазматической L-глицерин-3-фосфатдегидрогеназы из кроличьей почечной жировой ткани и ее сравнение с ферментом скелетных мышц». Европейский журнал биохимии / FEBS. 36 (1): 97–109. Дои:10.1111 / j.1432-1033.1973.tb02889.x. PMID 4200180.
- Альбертин Дж., Ван Тондер А., приор BA (август 1992 г.). «Очистка и характеристика глицерин-3-фосфатдегидрогеназы Saccharomyces cerevisiae». Письма FEBS. 308 (2): 130–2. Дои:10.1016 / 0014-5793 (92) 81259-О. PMID 1499720. S2CID 39643279.
- Koekemoer TC, Litthauer D, Oelofsen W (июнь 1995 г.). «Выделение и характеристика глицерин-3-фосфатдегидрогеназы жировой ткани». Международный журнал биохимии и клеточной биологии. 27 (6): 625–32. Дои:10.1016 / 1357-2725 (95) 00012-E. PMID 7671141.
- Полман И.Л., Ларссон К., Аверет Н., Буноуст О., Бубекер С., Густафссон Л., Ригуле М. (август 2002 г.). «Кинетическая регуляция митохондриальной глицерин-3-фосфатдегидрогеназы внешней НАДН-дегидрогеназой в Saccharomyces cerevisiae». Журнал биологической химии. 277 (31): 27991–5. Дои:10.1074 / jbc.M204079200. PMID 12032156.
- Overkamp KM, Bakker BM, Kötter P, van Tuijl A, de Vries S, van Dijken JP, Pronk JT (май 2000 г.). «Анализ in vivo механизмов окисления цитозольного НАДН митохондриями Saccharomyces cerevisiae». Журнал бактериологии. 182 (10): 2823–30. CiteSeerX 10.1.1.335.5313. Дои:10.1128 / JB.182.10.2823-2830.2000. ЧВК 101991. PMID 10781551.
- Dawson AG, Cooney GJ (июль 1978 г.). «Реконструкция альфа-глицеролфосфатного челнока с использованием митохондрий почек крысы». Письма FEBS. 91 (2): 169–72. Дои:10.1016/0014-5793(78)81164-8. PMID 210038.
- Оппердос Ф. Р., Борст П., Баккер С., Лин В. (июнь 1977 г.). «Локализация глицерин-3-фосфатоксидазы в митохондриях и частиц NAD + -связанной глицерин-3-фосфатдегидрогеназы в микротелах кровотока от формы Trypanosoma brucei». Европейский журнал биохимии / FEBS. 76 (1): 29–39. Дои:10.1111 / j.1432-1033.1977.tb11567.x. PMID 142010.
- Эсварамурти С., Бонанно Дж. Б., Берли С. К., Сваминатан С. (июнь 2006 г.). «Механизм действия флавинсодержащей монооксигеназы». Труды Национальной академии наук Соединенных Штатов Америки. 103 (26): 9832–7. Дои:10.1073 / pnas.0602398103. ЧВК 1502539. PMID 16777962.
внешние ссылки
- эквивалентные записи:
- alphaGPDH в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- GPDH
- Термин GO базы данных генома дрожжей: GPDH

