WikiDer > Глюконеогенез
Глюконеогенез (GNG) это метаболический путь что приводит к генерации глюкоза от некоторых не-углевод углеродные подложки. Это повсеместный процесс, присутствующий у растений, животных, грибов, бактерий и других микроорганизмов.[1] У позвоночных глюконеогенез происходит в основном в печень и, в меньшей степени, в кора из почки. Это один из двух основных механизмов, второй - деградация гликоген (гликогенолиз) - используется людьми и многими другими животными для содержания уровень глюкозы в крови, избегая низких уровней (гипогликемия).[2] В жвачные животные, потому что пищевые углеводы, как правило, метаболизируются рубец организмов глюконеогенез происходит независимо от голодания, низкоуглеводных диет, физических упражнений и т. д.[3] У многих других животных этот процесс происходит в периоды голодание, голодание, низкоуглеводные диеты, или интенсивный упражнение.
У человека субстраты для глюконеогенеза могут происходить из любых неуглеводных источников, которые могут быть преобразованы в пируват или промежуточные соединения гликолиз (см. рисунок). Для срыва белкиэти субстраты включают глюкогенные аминокислоты (хотя нет кетогенные аминокислоты); от распада липиды (Такие как триглицериды), они включают глицеринжирные кислоты с нечетной цепью (но не с жирными кислотами с четной цепью, см. ниже); и из других частей метаболизм они включают лактат от Цикл Кори. В условиях длительного голодания ацетон получается из кетоновые тела также может служить субстратом, обеспечивая путь от жирных кислот к глюкозе.[4] Хотя большая часть глюконеогенеза происходит в печени, относительный вклад глюконеогенеза почками увеличивается при диабете и длительном голодании.[5]
Путь глюконеогенеза очень высок. эндергонический пока он не соединится с гидролизом АТФ или же GTP, эффективно делая процесс экзергонический. Например, путь, ведущий из пируват к глюкозо-6-фосфат требуется 4 молекулы АТФ и 2 молекулы ГТФ, чтобы действовать спонтанно. Эти АТФ поставляются из катаболизм жирных кислот через бета-окисление.[6]
Прекурсоры

- Глюкогенные аминокислоты иметь эту способность
- Кетогенные аминокислоты не. Эти продукты все еще можно использовать для кетогенез или же липидный синтез.
- Некоторые аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
У человека основными предшественниками глюконеогенных веществ являются: лактат, глицерин (который является частью триацилглицерин молекула), аланин и глутамин. В общей сложности на них приходится более 90% общего глюконеогенеза.[8]Другой глюкогенные аминокислоты и все цикл лимонной кислоты промежуточные продукты (через преобразование в оксалоацетат) также может функционировать как субстрат для глюконеогенеза.[9] Как правило, употребление человеком глюконеогенных субстратов с пищей не приводит к усилению глюконеогенеза.[10]
В жвачные животные, пропионат является основным глюконеогенным субстратом.[3][11] У нежвачных животных, включая людей, пропионат возникает в результате β-окисления жирных кислот с нечетной и разветвленной цепями, которые являются (относительно второстепенными) субстратом для глюконеогенеза.[12][13]
Лактат транспортируется обратно в печень, где он превращается в пируват посредством Цикл Кори используя фермент лактатдегидрогеназа. Затем для выработки глюкозы можно использовать пируват, первый назначенный субстрат глюконеогенного пути.[9] Трансаминирование или же дезаминирование аминокислот облегчает вступление их углеродного скелета в цикл напрямую (в виде пирувата или оксалоацетата) или косвенно через цикл лимонной кислоты. Вклад лактата цикла Кори в общее производство глюкозы увеличивается с увеличением голодание продолжительность.[14] В частности, после 12, 20 и 40 часов голодания добровольцев-людей вклад лактата цикла Кори в глюконеогенез составил 41%, 71% и 92% соответственно.[14]
Будь четно-цепь жирные кислоты может быть преобразован в глюкозу у животных - давний вопрос в биохимии.[15] Жирные кислоты с нечетной цепью может быть окислен с получением ацетил-КоА и пропионил-КоА, последний служит предшественником сукцинил-КоА, который может превращаться в пируват и вступать в глюконеогенез. Напротив, жирные кислоты с четной цепью окисляются с образованием только ацетил-КоА, для вступления которого в глюконеогенез необходимо присутствие глиоксилатный цикл (также известный как глиоксилатный шунт) для производства четырехуглеродных предшественников дикарбоновой кислоты.[9] Глиоксилатный шунт состоит из двух ферментов, малатсинтазы и изоцитратлиазы, и присутствует в грибах, растениях и бактериях. Несмотря на некоторые сообщения о ферментативной активности глиоксилатного шунта, обнаруженной в тканях животных, гены, кодирующие обе ферментативные функции, были обнаружены только у нематоды, в котором они существуют как один бифункциональный фермент.[16][17] Гены, кодирующие только малатсинтазу (но не изоцитратлиазу), были идентифицированы в других многоклеточные животные включая членистоногие, иглокожие, и даже некоторые позвоночные. Млекопитающие, обладающие геном малатсинтазы, включают: монотремы (утконос) и сумчатые (опоссум), но нет плацентарные млекопитающие.[17]
Существование глиоксилатного цикла у людей не было установлено, и широко распространено мнение, что жирные кислоты не могут быть напрямую преобразованы в глюкозу у людей. Углерод-14 было показано, что в конечном итоге в глюкозе поступает жирная кислота,[18] но этого можно ожидать от включения меченых атомов, полученных из ацетил-КоА, в цикл лимонной кислоты промежуточные продукты, которые взаимозаменяемы с промежуточными продуктами, полученными из других физиологических источников, такими как глюкогенные аминокислоты.[15] В отсутствие других глюкогенных источников 2-углеродный ацетил-КоА полученные в результате окисления жирных кислот, не могут производить чистый выход глюкозы через цикл лимонной кислоты, поскольку эквивалентные два атома углерода выделяются в виде диоксида углерода во время цикла. В течение кетозоднако ацетил-КоА из жирных кислот дает кетоновые тела, включая ацетон, и до ~ 60% ацетона может окисляться в печени до предшественников пирувата, ацетола и метилглиоксаль.[19][4] Таким образом, кетоновые тела, полученные из жирных кислот, могут составлять до 11% глюконеогенеза во время голодания. Катаболизм жирных кислот также производит энергию в форме АТФ, которая необходима для пути глюконеогенеза.
Место расположения
Считается, что у млекопитающих глюконеогенез ограничен печенью,[20] почка,[20] кишечник,[21] и мышцы,[нужна цитата] но недавние данные указывают на то, что глюконеогенез происходит в астроциты мозга.[22] Эти органы используют несколько разные глюконеогенные предшественники. Печень преимущественно использует лактат, глицерин и глюкогенные аминокислоты (особенно аланин), в то время как почки преимущественно используют лактат, глутамин и глицерин.[23][8] Лактат из Цикл Кори в количественном отношении является крупнейшим источником субстрата для глюконеогенеза, особенно для почек.[8] Печень использует оба гликогенолиз и глюконеогенез для производства глюкозы, тогда как почки используют только глюконеогенез.[8] После еды печень переходит на синтез гликогена, тогда как почки усиливают глюконеогенез.[10] Кишечник использует в основном глутамин и глицерин.[21]
Пропионат является основным субстратом для глюконеогенеза в печени жвачных животных, и печень жвачных может увеличить использование глюконеогенных аминокислот (например, аланина) при повышении потребности в глюкозе.[24] Способность клеток печени использовать лактат для глюконеогенеза снижается от стадии до жвачного до стадии жвачного у телят и ягнят.[25] В ткани почек барана наблюдалась очень высокая скорость глюконеогенеза пропионата.[26]
У всех видов формирование оксалоацетат из пируват и промежуточные продукты цикла TCA ограничены митохондриями, а ферменты, которые превращают Фосфоенолпировиноградная кислота (PEP) в глюкозо-6-фосфат обнаруживаются в цитозоле.[27] Расположение фермента, который связывает эти две части глюконеогенеза, превращая оксалоацетат в PEP - Карбоксикиназа PEP (PEPCK) - варьируется в зависимости от вида: его можно найти полностью в пределах митохондрии, полностью в пределах цитозоль, или равномерно распределены между ними, как у людей.[27] Транспортировка ПКП через митохондриальная мембрана осуществляется специальными транспортными белками; однако таких белков для оксалоацетат.[27] Следовательно, у видов, у которых отсутствует внутримитохондриальная PEPCK, оксалоацетат должен быть преобразован в малат или же аспартат, экспортировано из митохондрия, и преобразован обратно в оксалоацетат для продолжения глюконеогенеза.[27]
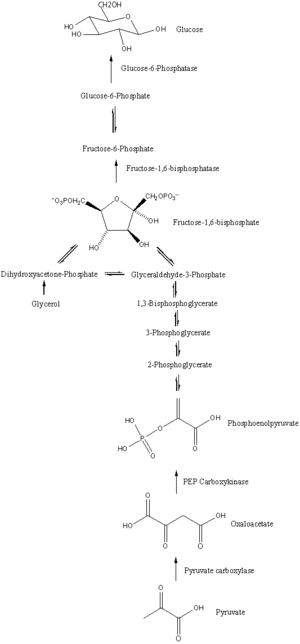
Путь
Глюконеогенез - это путь, состоящий из серии из одиннадцати реакций, катализируемых ферментами. Путь начинается в печени или почках, в митохондриях или цитоплазме этих клеток, это зависит от используемого субстрата. Многие реакции являются обратными шагам, описанным в гликолиз.
- Глюконеогенез начинается в митохондриях с образования оксалоацетата путем карбоксилирования пирувата. Для этой реакции также требуется одна молекула АТФ, и катализируется пируваткарбоксилаза. Этот фермент стимулируется высоким уровнем ацетил-КоА (произведено в β-окисление в печени) и ингибируется высоким уровнем АДФ и глюкозы.
- Оксалоацетат восстанавливается до малат с помощью НАДН, шаг, необходимый для его транспортировки из митохондрий.
- Малат окисляется до оксалоацетата с помощью НАД.+ в цитозоле, где проходят остальные стадии глюконеогенеза.
- Оксалоацетат декарбоксилируется, а затем фосфорилируется с образованием фосфоенолпируват используя фермент PEPCK. Молекула GTP гидролизуется до ВВП во время этой реакции.
- Следующие шаги в реакции такие же, как и в обратном порядке. гликолиз. Тем не мение, фруктозо-1,6-бисфосфатаза обращает фруктозо-1,6-бисфосфат к фруктозо-6-фосфат, используя одну молекулу воды и высвобождая один фосфат (при гликолизе, фосфофруктокиназа 1 конвертирует F6P и АТФ до F1,6BP и ADP). Это также лимитирующая стадия глюконеогенеза.
- Глюкозо-6-фосфат сформирован из фруктозо-6-фосфат к фосфоглюкоизомераза (обратный этапу 2 при гликолизе). Глюкозо-6-фосфат можно использовать в других метаболических путях или дефосфорилировать до свободной глюкозы. В то время как свободная глюкоза может легко диффундировать в клетку и из клетки, фосфорилированная форма (глюкозо-6-фосфат) заблокирована в клетке - механизм, с помощью которого клетки контролируют внутриклеточные уровни глюкозы.
- Окончательный глюконеогенез, образование глюкозы, происходит в просвет из эндоплазматический ретикулум, где глюкозо-6-фосфат гидролизуется глюкозо-6-фосфатаза для производства глюкозы и высвобождения неорганического фосфата. Как и два предыдущих шага, этот шаг не является простым обращением гликолиза, при котором гексокиназа катализирует превращение глюкозы и АТФ в G6P и ADP. Глюкоза перемещается в цитоплазму за счет переносчики глюкозы расположен в мембране эндоплазматического ретикулума.
| Метаболизм общего моносахариды, включая гликолиз, глюконеогенез, гликогенез и гликогенолиз |
|---|
Регулирование
Хотя большинство шагов в глюконеогенезе обратны тем, что обнаружены в гликолиз, три регулируемых и сильно эндергонических реакции заменяются более кинетически благоприятными реакциями. Гексокиназа/глюкокиназа, фосфофруктокиназа, и пируваткиназа ферменты гликолиза заменены на глюкозо-6-фосфатаза, фруктозо-1,6-бисфосфатаза, и Карбоксикиназа ПЭП/ пируваткарбоксилаза. Эти ферменты обычно регулируются подобными молекулами, но с противоположными результатами. Например, ацетил-КоА и цитрат активируют ферменты глюконеогенеза (пируваткарбоксилазу и фруктозо-1,6-бисфосфатаза соответственно), в то же время ингибируя гликолитический фермент пируваткиназа. Эта система взаимного контроля позволяет гликолизу и глюконеогенезу подавлять друг друга и предотвращает бесполезный цикл синтезировать глюкозу, чтобы только расщепить ее.
Большинство ферменты ответственные за глюконеогенез находятся в цитозоль; исключение составляют митохондриальные пируваткарбоксилаза а у животных фосфоенолпируваткарбоксикиназа. Последний существует как изофермент, расположенный как в митохондрия и цитозоль.[28] Скорость глюконеогенеза в конечном итоге контролируется действием ключевого фермента, фруктозо-1,6-бисфосфатаза, который также регулируется посредством передачи сигнала лагерь и его фосфорилирование.
Глобальный контроль глюконеогенеза опосредуется глюкагон (высвобождается при низком уровне глюкозы в крови); запускает фосфорилирование ферментов и регуляторных белков путем Протеинкиназа А (киназа, регулируемая циклическим АМФ), что приводит к ингибированию гликолиза и стимуляции глюконеогенеза. Инсулин противодействует глюкагону, подавляя глюконеогенез. Диабет 2 типа характеризуется избытком глюкагона и резистентность к инсулину от тела.[29] Инсулин больше не может подавлять экспрессию генов ферментов, таких как PEPCK, что приводит к повышению уровня гипергликемии в организме.[30] Антидиабетический препарат метформин снижает уровень глюкозы в крови, прежде всего, за счет ингибирования глюконеогенеза, преодолевая неспособность инсулина ингибировать глюконеогенез из-за инсулинорезистентности.[31]
Исследования показали, что отсутствие продукции глюкозы в печени не оказывает существенного влияния на контроль концентрации глюкозы в плазме натощак. Компенсаторная индукция глюконеогенеза происходит в почках и кишечнике за счет глюкагон, глюкокортикоидыи ацидоз.[32]
Резистентность к инсулину
В печени FOX белок FoxO6 обычно способствует глюконеогенезу натощак, но инсулин блокирует Fox06 при кормлении.[33] В состоянии резистентность к инсулину инсулин не может блокировать FoxO6, что приводит к продолжению глюконеогенеза даже при кормлении, что приводит к высокому уровню глюкозы в крови (гипергликемия).[33]
Инсулинорезистентность - общая черта метаболический синдром и диабет 2 типа. По этой причине глюконеогенез является целью терапии диабета 2 типа, такого как противодиабетический препарат метформин, который подавляет образование глюконеогенной глюкозы и стимулирует поглощение глюкозы клетками.[34]
Смотрите также
Рекомендации
- ^ Нельсон Д.Л., Кокс М.М. (2000). Принципы биохимии Ленингера. США: Worth Publishers. п.724. ISBN 978-1-57259-153-0.
- ^ Сильва П. «Химическая логика глюконеогенеза». Архивировано из оригинал 26 августа 2009 г.. Получено 8 сентября, 2009.
- ^ а б Бейтц, округ Колумбия (2004 г.). «Углеводный обмен». В Риз WO (ред.). Герцогская физиология домашних животных (12-е изд.). Cornell Univ. Нажмите. С. 501–15.
- ^ а б Калета К., де Фигейредо Л. Ф., Вернер С., Гутке Р., Ристоу М., Шустер С. (июль 2011 г.). «In silico доказательства глюконеогенеза жирных кислот у людей». PLOS вычислительная биология. 7 (7): e1002116. Bibcode:2011PLSCB ... 7E2116K. Дои:10.1371 / journal.pcbi.1002116. ЧВК 3140964. PMID 21814506.
- ^ Swe MT, Pongchaidecha A, Chatsudthipong V, Chattipakorn N, Lungkaphin A (июнь 2019 г.). «Молекулярные сигнальные механизмы почечного глюконеогенеза в недиабетических и диабетических условиях». Журнал клеточной физиологии. 234 (6): 8134–8151. Дои:10.1002 / jcp.27598. PMID 30370538.
- ^ Родвелл V (2015). Иллюстрированная биохимия Харпера, 30-е издание. США: Макгроу Хилл. п. 193. ISBN 978-0-07-182537-5.
- ^ Ferrier DR, Champe PC, Harvey RA (1 августа 2004 г.). «20. Разложение и синтез аминокислот». Биохимия (иллюстрированные обзоры Липпинкотта). Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-2265-0.
- ^ а б c d Герих Дж. Э., Мейер С., Верле Х. Дж., Штумволл М. (февраль 2001 г.). «Почечный глюконеогенез: его значение в гомеостазе глюкозы человека». Уход за диабетом. 24 (2): 382–91. Дои:10.2337 / diacare.24.2.382. PMID 11213896.
- ^ а б c Гарретт Р.Х., Гришем К.М. (2002). Принципы биохимии с фокусом на человека. США: Брукс / Коул, Thomson Learning. С. 578, 585. ISBN 978-0-03-097369-7.
- ^ а б Nuttall FQ, Ngo A, Gannon MC (сентябрь 2008 г.). "Регулирование производства глюкозы в печени и роль глюконеогенеза у человека: постоянна ли скорость глюконеогенеза?". Исследования и обзоры диабета / метаболизма. 24 (6): 438–58. Дои:10.1002 / дмрр.863. PMID 18561209. S2CID 24330397.
- ^ Ван Сост П.Дж. (1994). Пищевая экология жвачных животных (2-е изд.). Cornell Univ. Нажмите. п. 476.
- ^ Родвелл Ф.В., Бендер Д.А., Ботам К.М., Kennelly PJ, Weil PA (2018). Иллюстрированная биохимия Харпера (31-е изд.). Издательство McGraw-Hill.
- ^ Бейнс Дж, Доминичак М (2014). Медицинская биохимия (4-е изд.). Эльзевир.
- ^ а б Кац Дж., Тайек Дж. А. (сентябрь 1998 г.). «Глюконеогенез и цикл Кори у людей, голодавших в течение 12, 20 и 40 часов». Американский журнал физиологии. 275 (3): E537-42. Дои:10.1152 / ajpendo.1998.275.3.E537. PMID 9725823.
- ^ а б де Фигейредо Л. Ф., Шустер С., Калета С., Фелл Д. А. (январь 2009 г.). «Можно ли производить сахар из жирных кислот? Тестовый пример для инструментов анализа метаболических путей». Биоинформатика. 25 (1): 152–8. Дои:10.1093 / биоинформатика / btn621. PMID 19117076.
- ^ Лю Ф., Тэтчер Дж. Д., Баррал Дж. М., Эпштейн Х. Ф. (июнь 1995 г.). «Бифункциональный белок глиоксилатного цикла Caenorhabditis elegans: белок кишечника и мышц, регулируемый развитием». Биология развития. 169 (2): 399–414. Дои:10.1006 / dbio.1995.1156. PMID 7781887.
- ^ а б Кондрашов Ф.А., Кунин Е.В., Моргунов И.Г., Финогенова Т.В., Кондрашова М.Н. (октябрь 2006 г.). «Эволюция ферментов глиоксилатного цикла у Metazoa: свидетельство множественных событий горизонтального переноса и образования псевдогена». Биология Директ. 1: 31. Дои:10.1186/1745-6150-1-31. ЧВК 1630690. PMID 17059607.
- ^ Вайнман Э.О., Стрисовер Э.Х., Чайкофф И.Л. (апрель 1957 г.). «Превращение жирных кислот в углеводы; применение изотопов к этой проблеме и роль цикла Кребса как пути синтеза». Физиологические обзоры. 37 (2): 252–72. Дои:10.1152 / Physrev.1957.37.2.252. PMID 13441426.
- ^ Райхард Г.А., Хафф А.С., Skutches CL, Пол П., Холройд С.П., Оуэн О.Е. (апрель 1979 г.). «Метаболизм ацетона в плазме у голодающего человека». Журнал клинических исследований. 63 (4): 619–26. Дои:10.1172 / JCI109344. ЧВК 371996. PMID 438326.
- ^ а б Видмайер Э (2006). Физиология человека Вандера. Макгроу Хилл. п.96. ISBN 978-0-07-282741-5.
- ^ а б Mithieux G, Rajas F, Gautier-Stein A (октябрь 2004 г.). «Новая роль глюкозо-6-фосфатазы в тонком кишечнике в контроле гомеостаза глюкозы». Журнал биологической химии. 279 (43): 44231–4. Дои:10.1074 / jbc.R400011200. PMID 15302872.
- ^ Ип Дж, Гэн Х, Шен Дж, Дин И (2017). «Церебральный глюконеогенез и заболевания». Границы фармакологии. 7: 521. Дои:10.3389 / fphar.2016.00521. ЧВК 5209353. PMID 28101056.
- ^ Герих JE (февраль 2010 г.). «Роль почек в нормальном гомеостазе глюкозы и гипергликемии сахарного диабета: терапевтическое значение». Диабетическая медицина. 27 (2): 136–42. Дои:10.1111 / j.1464-5491.2009.02894.x. ЧВК 4232006. PMID 20546255.
- ^ Overton TR, Drackley JK, Ottemann-Abbamonte CJ, Beaulieu AD, Emmert LS, Clark JH (июль 1999 г.). «Использование субстрата для глюконеогенеза в печени изменяется из-за повышенной потребности в глюкозе у жвачных животных». Журнал зоотехники. 77 (7): 1940–51. Дои:10,2527 / 1999,7771940x. PMID 10438042.
- ^ Донкин С.С., Арментано Л.Е. (февраль 1995 г.). «Регулирование глюконеогенеза инсулином и глюкагоном у коров до жвачки и жвачки». Журнал зоотехники. 73 (2): 546–51. Дои:10,2527 / 1995,732546x. PMID 7601789.
- ^ Донкин С.С., Арментано Л.Е. (февраль 1995 г.). «Регулирование глюконеогенеза инсулином и глюкагоном у коров до жвачки и жвачки». Журнал зоотехники. 73 (2): 546–51. Дои:10,2527 / 1995,732546x. PMID 7601789.
- ^ а б c d Воет Д., Воет Дж., Пратт С. (2008). Основы биохимии. John Wiley & Sons Inc. стр.556. ISBN 978-0-470-12930-2.
- ^ Чакраварти К., Кассуто Х, Решеф Л., Хэнсон Р. В. (2005). «Факторы, контролирующие тканеспецифическую транскрипцию гена фосфоенолпируваткарбоксикиназы-C». Критические обзоры в биохимии и молекулярной биологии. 40 (3): 129–54. Дои:10.1080/10409230590935479. PMID 15917397. S2CID 633399.
- ^ He L, Sabet A, Djedjos S, Miller R, Sun X, Hussain MA и др. (Май 2009 г.). «Метформин и инсулин подавляют глюконеогенез в печени путем фосфорилирования связывающего белка CREB». Клетка. 137 (4): 635–46. Дои:10.1016 / j.cell.2009.03.016. ЧВК 2775562. PMID 19450513.
- ^ Hatting M, Tavares CD, Sharabi K, Rines AK, Puigserver P (январь 2018 г.). «Инсулиновая регуляция глюконеогенеза». Летопись Нью-Йоркской академии наук. 1411 (1): 21–35. Bibcode:2018НЯСА1411 ... 21Ч. Дои:10.1111 / nyas.13435. ЧВК 5927596. PMID 28868790.
- ^ Ван И, Тан Х, Джи Х, Чжан И, Сюй В., Ян Х и др. (Январь 2018). «Анализ профиля экспрессии длинных некодирующих РНК, участвующих в ингибируемом метформином глюконеогенезе первичных гепатоцитов мыши». Международный журнал молекулярной медицины. 41 (1): 302–310. Дои:10.3892 / ijmm.2017.3243. ЧВК 5746302. PMID 29115403.
- ^ Mutel E, Gautier-Stein A, Abdul-Wahed A, Amigó-Correig M, Zitoun C, Stefanutti A, et al. (Декабрь 2011 г.). «Контроль уровня глюкозы в крови при отсутствии продукции глюкозы в печени при длительном голодании у мышей: индукция глюкагоном почечного и кишечного глюконеогенеза». Сахарный диабет. 60 (12): 3121–31. Дои:10.2337 / db11-0571. ЧВК 3219939. PMID 22013018.
- ^ а б Ли С., Донг ХХ (май 2017 г.). «FoxO интеграция передачи сигналов инсулина с метаболизмом глюкозы и липидов». Журнал эндокринологии. 233 (2): R67 – R79. Дои:10.1530 / JOE-17-0002. ЧВК 5480241. PMID 28213398.
- ^ Hundal RS, Krssak M, Dufour S, Laurent D, Lebon V, Chandramouli V и др. (Декабрь 2000 г.). «Механизм, с помощью которого метформин снижает выработку глюкозы при диабете 2 типа». Сахарный диабет. 49 (12): 2063–9. Дои:10.2337 / диабет.49.12.2063. ЧВК 2995498. PMID 11118008. «Свободный полный текст». (82 KiB)


