WikiDer > Глиоксиловая кислота
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Оксоуксусная кислота[1] | |
| Систематическое название ИЮПАК Оксоэтановая кислота | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.005.508 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C2ЧАС2О3 | |
| Молярная масса | 74.035 г · моль−1 |
| Плотность | 1,384 г / мл |
| Температура плавления | 80 ° С (176 ° F, 353 К)[4] |
| Точка кипения | 111 ° С (232 ° F, 384 К) |
| Кислотность (пKа) | 3.18,[2] 3.32 [3] |
| Родственные соединения | |
Другой анионы | глиоксилат |
Связанный карбоновые кислоты | муравьиная кислота уксусная кислота гликолевая кислота Щавелевая кислота пропионовая кислота пировиноградная кислота |
Родственные соединения | ацетальдегид глиоксаль гликолевый альдегид |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Глиоксиловая кислота или же оксоуксусная кислота является органическое соединение. Вместе с уксусная кислота, гликолевая кислота, и Щавелевая кислота, глиоксиловая кислота является одним из C2 карбоновые кислоты. Это бесцветное твердое вещество, которое встречается в природе и используется в промышленности.
Структура и номенклатура
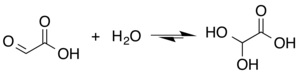
Хотя структура глиоксиловой кислоты описана как имеющая альдегид функциональная группа, альдегид является лишь второстепенным компонентом формы, наиболее распространенной в некоторых ситуациях. Вместо этого он часто существует в виде гидрата или циклического димер. Например, в присутствии воды карбонил быстро превращается в геминальный диол (описывается как «моногидрат»). В константа равновесия (K) составляет 300 для образования дигидроксиуксусной кислоты при комнатной температуре:[5]
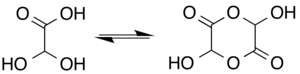
В растворе моногидрат находится в равновесии с полуацеталь димерная форма:[6]
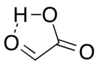
В отдельности альдегидная структура имеет в качестве основной конформер циклический водородная связь структура с карбонилом альдегида в непосредственной близости от карбоксил водород:[7]
В Закон Генри константа глиоксиловой кислоты KЧАС = 1.09 × 104 × exp [(40,0 × 103/ R) × (1 / T - 1/298)].[8]
Препараты
В сопряженное основание глиоксиловой кислоты известен как глиоксилат и представляет собой форму, в которой соединение существует в растворе при нейтральном pH. Глиоксилат является побочным продуктом посредничество процесс в биосинтезе нескольких амидированных пептиды.
Исторически известно, что глиоксиловая кислота была получена из щавелевой кислоты. электросинтетически:[9][10] в органическом синтезе, диоксид свинца катоды применялись для получения глиоксиловой кислоты из Щавелевая кислота в сернокислотном электролите.[11]
Горячей азотная кислота может окислять глиоксаль к глиоксиловой; однако эта реакция очень экзотермична и склонна к неуправляемому нагреву. Кроме того, основным побочным продуктом является щавелевая кислота.
Также, озонолиз из малеиновая кислота эффективен.[6]
Биологическая роль
Глиоксилат является промежуточным продуктом глиоксилатный цикл, что позволяет организмы, например, бактерии,[12] грибы и растения [13] преобразовать жирные кислоты в углеводы. Глиоксилатный цикл также важен для индукции защитных механизмов растений в ответ на грибки.[14] Глиоксилатный цикл инициируется активностью изоцитратлиазы, которая превращает изоцитрат в глиоксилат и сукцинат. Проводятся исследования, чтобы использовать этот путь для различных целей, таких как биосинтез сукцината.[15]
В людях
Глиоксилат продуцируется двумя путями: через окисление гликолата в пероксисомах или через катаболизм гидроксипролина в митохондриях.[16] В пероксисомах глиоксилат превращается в глицин с помощью AGT1 или в оксалат с помощью гликолатоксидазы. В митохондриях глиоксилат превращается в глицин с помощью AGT2 или в гликолят с помощью гликолятредуктазы. Небольшое количество глиоксилата превращается в оксалат цитоплазматической лактатдегидрогеназой.[17]
В растениях
Помимо того, что он является промежуточным продуктом глиоксилатного пути, глиоксилат также является важным промежуточным продуктом в фотодыхание путь. Фотодыхание - результат побочной реакции Рубиско с O2 вместо CO2. Фотодыхание, которое сначала считалось пустой тратой энергии и ресурсов, оказалось важным методом регенерации углерода и CO.2, удаляя токсичный фосфогликолят и запуская защитные механизмы.[18][19] При фотодыхании глиоксилат превращается из гликолата в результате активности гликолатоксидазы в пероксисоме. Затем он превращается в глицин посредством параллельных действий SGAT и GGAT, который затем транспортируется в митохондрии.[20][19] Также сообщалось, что комплекс пируватдегидрогеназы может играть роль в метаболизме гликолата и глиоксилата.[21]

Актуальность болезни
Эта статья слишком полагается на Рекомендации к основные источники. (Март 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Сахарный диабет
Глиоксилат считается потенциальным ранним маркером Сахарный диабет II типа.[22] Одним из ключевых условий патологии диабета является выработка конечные продукты с улучшенным гликированием (ВОЗРАСТ), вызванные гипергликемия.[23] AGE могут привести к дальнейшим осложнениям диабета, таким как повреждение тканей и сердечно-сосудистые заболевания.[24] Обычно они образуются из реакционноспособных альдегидов, таких как те, что присутствуют в восстанавливающих сахарах и альфа-оксоальдегидах. В исследовании было обнаружено, что уровни глиоксилата значительно повышены у пациентов, у которых позже был диагностирован диабет II типа.[22] Повышенные уровни обнаруживались иногда за три года до постановки диагноза, что свидетельствует о потенциальной роли глиоксилата как раннего прогностического маркера.
Нефролитиаз
Глиоксилат участвует в развитии гипероксалурия, основная причина нефролитиаз (широко известные как камни в почках). Глиоксилат является и субстратом, и индуктором транспортера сульфат-аниона-1 (sat-1), гена, ответственного за транспорт оксалата, что позволяет ему увеличивать экспрессию мРНК sat-1 и, как следствие, отток оксалата из клетки. Повышенное выделение оксалата способствует накоплению оксалата кальция в моче и, следовательно, образованию камней в почках.[17]
Нарушение метаболизма глиоксилата обеспечивает дополнительный механизм развития гипероксалурии. Мутации с потерей функции в гене HOGA1 приводят к потере 4-гидрокси-2-оксоглутарат альдолазы, фермента в пути гидроксипролина к глиоксилату. Глиоксилат, образующийся в результате этого пути, обычно откладывается, чтобы предотвратить окисление до оксалата в цитозоле. Однако нарушенный путь вызывает накопление 4-гидрокси-2-оксоглутарата, который также может транспортироваться в цитозоль и превращаться в глиоксилат через другую альдолазу. Эти молекулы глиоксилата могут окисляться до оксалата, увеличивая его концентрацию и вызывая гипероксалурию.[16]
Реакции и использование
Глиоксиловая кислота примерно в десять раз сильнее кислоты, чем уксусная кислота, с константа диссоциации кислоты 4,7 × 10−4 (пKа = 3.32):
- OCHCO2H ⇌ OCHCO−
2 + H+
С основанием, глиоксиловой кислотой непропорционально, формируя гидроксиуксусная кислота и Щавелевая кислота:[нужна цитата]
- 2 OCHCO2H + H2O → HOCH2CO2H + HO2CCO2ЧАС
Глиоксиловая кислота дает гетероциклы при конденсация с мочевина и 1,2-диаминобензол.
Производные фенола
Обычно глиоксиловая кислота подвергается электрофильное ароматическое замещение реакция с фенолы, универсальный шаг в синтезе нескольких других соединений.
Непосредственный продукт с фенол сам по себе 4-гидроксиминдельная кислота. Этот вид реагирует с аммиаком с образованием гидроксифенилглицина, предшественника препарата. амоксициллин. Восстановление 4-гидроксиминдальной кислоты дает 4-гидроксифенилуксусная кислота, предшественник препарата атенолол.
Последовательность реакций, в которых глиоксиловая кислота реагирует с гваякол фенольный компонент с последующим окислением и декарбоксилирование, обеспечивает путь к ванилин как сеть формилирование процесс.[6][25][26]
Реакция Хопкинса Коула
Глиоксиловая кислота входит в состав Реакция Хопкинса-Коула, используется для проверки наличия триптофан в белках.[27]
Экологическая химия
Глиоксиловая кислота является одной из нескольких кетон- и альдегидсодержащих карбоновых кислот, которые вместе присутствуют в большом количестве в вторичные органические аэрозоли. В присутствии воды и солнечного света глиоксиловая кислота может подвергаться фотохимический окисление. Может происходить несколько различных путей реакции, приводящих к различным другим карбоновым кислотам и альдегидным продуктам.[28]
Безопасность
Соединение не очень токсично с LD50 для крыс 2500 мг / кг.
Рекомендации
- ^ а б «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 748. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Константы диссоциации органических кислот и оснований (600 соединений), http://zirchrom.com/organic.htm.
- ^ Данные pKa составлены Р. Уильямсом, «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2010-06-02. Получено 2010-06-02.CS1 maint: заархивированная копия как заголовок (связь).
- ^ Индекс Merck, 11-е издание, 4394
- ^ Соренсен, П. Э .; Bruhn, K .; Линделов, Ф. (1974). «Кинетика и равновесие обратимой гидратации альдегидной группы в глиоксиловой кислоте». Acta Chem. Сканд. 28: 162–168. Дои:10.3891 / acta.chem.scand.28a-0162.
- ^ а б c Жорж Маттиода и Яни Кристидис «Глиоксиловая кислота» Энциклопедия промышленной химии Ульмана, 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a12_495
- ^ Редингтон, Ричард Л .; Лян, Чин-Кан Джим (1984). «Колебательные спектры мономеров глиоксиловой кислоты». Журнал молекулярной спектроскопии. 104 (1): 25–39. Bibcode:1984JMoSp.104 ... 25R. Дои:10.1016 / 0022-2852 (84) 90242-Х.
- ^ Ip, H. S. Simon; Хуанг, X. Хильда; Ю, Цзянь Чжэнь (2009). «Эффективные константы закона Генри для глиоксаля, глиоксиловой кислоты и гликолевой кислоты» (PDF). Письма о геофизических исследованиях. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. Дои:10.1029 / 2008GL036212.
- ^ Тафель, Юлий; Фридрихс, Густав (1904). "Электролитическое восстановление карбоновых и карбоновых пластов в Швефельсаурер Лёсунг". Berichte der Deutschen Chemischen Gesellschaft. 37 (3): 3187–3191. Дои:10.1002 / cber.190403703116.
- ^ Коэн, Юлий (1920). Практическая органическая химия 2-е изд. (PDF). Лондон: Macmillan and Co. Limited. С. 102–104.
- ^ Франсуа Кардарелли (2008). Справочник по материалам: краткий настольный справочник. Springer. п. 574. ISBN 978-1-84628-668-1.
- ^ Холмс WH (1987). «Контроль потока через цикл лимонной кислоты и обход глиоксилата в Escherichia coli». Biochem Soc Symp. 54: 17–31. PMID 3332993.
- ^ Эшер CL, Видмер Ф (1997). «Мобилизация липидов и глюконеогенез в растениях: действительно ли активность ферментов глиоксилатного цикла составляет реальный цикл? Гипотеза». Биол. Chem. 378 (8): 803–813. PMID 9377475.
- ^ Дубей, Мукеш К .; Броберг, Андерс; Соорияараччи, Сандживани; Убхаясекера, Вимал; Дженсен, Дэн Функ; Карлссон, Магнус (сентябрь 2013 г.). «Глиоксилатный цикл участвует в плееотропных фенотипах, антагонизме и индукции защитных реакций растений в грибковом агенте биоконтроля Trichoderma atroviride». Грибковая генетика и биология. 58–59: 33–41. Дои:10.1016 / j.fgb.2013.06.008. ISSN 1087-1845. PMID 23850601.
- ^ Чжу, Ли-Вэнь; Ли, Сяо-Хун; Чжан, Лэй; Ли, Хун-Мэй; Лю, Цзянь-Хуа; Юань, Чжань-Пэн; Чен, Дао; Тан, Я-Цзе (ноябрь 2013 г.). «Активация глиоксилатного пути без активации родственного ему гена в сконструированной Escherichia coli, продуцирующей сукцинат». Метаболическая инженерия. 20: 9–19. Дои:10.1016 / j.ymben.2013.07.004. ISSN 1096-7176. PMID 23876414.
- ^ а б Белостоцкий, Рут; Питт, Джеймс Джонатон; Фришберг, Яаков (01.12.2012). «Первичная гипероксалурия III типа - модель для изучения нарушений метаболизма глиоксилата». Журнал молекулярной медицины. 90 (12): 1497–1504. Дои:10.1007 / s00109-012-0930-z. HDL:11343/220107. ISSN 0946-2716. PMID 22729392. S2CID 11549218.
- ^ а б Шнедлер, Нина; Буркхардт, Герхард; Буркхардт, Биргитта К. (март 2011 г.). «Глиоксилат является субстратом сульфатно-оксалатного обменника sat-1 и увеличивает его экспрессию в клетках HepG2». Журнал гепатологии. 54 (3): 513–520. Дои:10.1016 / j.jhep.2010.07.036. ISSN 0168-8278. PMID 21093948.
- ^ «фотодыхание». Получено 2017-03-09.
- ^ а б Петерансель, Кристоф; Хорст, Инна; Ниссен, Маркус; Блюм, Кристиан; Кебейш, Рашад; Кюркчуоглу, София; Кройцалер, Фриц (23 марта 2010 г.). «Фотодыхание». Книга арабидопсиса / Американское общество биологов растений. 8: e0130. Дои:10.1199 / таб.0130. ISSN 1543-8120. ЧВК 3244903. PMID 22303256.
- ^ Чжан, Чжишэн; Мао, Синсюэ; Оу, Хуанинг; Йе, Нэнхуи; Чжан, Цзяньхуа; Пэн, Синьсян (январь 2015 г.). «Отчетливые фотодыхательные реакции преимущественно катализируются глутамат-глиоксилатными и серин-глиоксилат-аминотрансферазами риса». Журнал фотохимии и фотобиологии B: Биология. 142: 110–117. Дои:10.1016 / j.jphotobiol.2014.11.009. ISSN 1011-1344. PMID 25528301.
- ^ Блюм, Кристиан; Беренс, Кристоф; Юбель, Хольгер; Браун, Ханс-Петер; Петерансель, Кристоф (ноябрь 2013 г.). «Возможная роль комплекса пируватдегидрогеназы хлоропластов в метаболизме гликолата и глиоксилата растений». Фитохимия. 95: 168–176. Дои:10.1016 / j.phytochem.2013.07.009. ISSN 0031-9422. PMID 23916564.
- ^ а б Никифорова, Виктория Ю .; Гисберц, Питер; Вимер, Ян; Бетан, Бьянка; Луозер, Ральф; Либенберг, Фолькер; Руис Ноппингер, Патрисия; Даниэль, Ханнелора; Рейн, Дитрих (2014). «Глиоксилат, новый маркер метаболизма диабета 2 типа». Журнал исследований диабета. 2014: 685204. Дои:10.1155/2014/685204. ISSN 2314-6745. ЧВК 4265698. PMID 25525609.
- ^ Nguyen, Dung V .; Шоу, Линн С .; Грант, Мария Б. (21 декабря 2012 г.). «Воспаление в патогенезе микрососудистых осложнений при диабете». Границы эндокринологии. 3: 170. Дои:10.3389 / fendo.2012.00170. ISSN 1664-2392. ЧВК 3527746. PMID 23267348.
- ^ Пиарулли, Франческо; Сарторе, Джованни; Лаполла, Аннунциата (апрель 2013 г.). «Гликоокисление и сердечно-сосудистые осложнения при диабете 2 типа: обновленная клиническая информация». Acta Diabetologica. 50 (2): 101–110. Дои:10.1007 / s00592-012-0412-3. ISSN 0940-5429. ЧВК 3634985. PMID 22763581.
- ^ Фатиади, Александр; Шаффер, Роберт (1974). "Улучшенная процедура синтеза DL-4-Гидрокси-3-метоксиминдальная кислота (DL- «Ваниллил-миндальная кислота, ВМА)». Журнал исследований Национального бюро стандартов Раздел A. 78A (3): 411–412. Дои:10.6028 / jres.078A.024. PMID 32189791.
- ^ Камлет, Йонас; Мэтисон, Олин (1953). Производство ванилина и его гомологов Патент США 2,640,083. (PDF). Патентное ведомство США.
- ^ Р.А. Джоши (2006). Банк вопросов по биохимии. New Age International. п. 64. ISBN 978-81-224-1736-4.
- ^ Евгений, Алексис Дж .; Ся, Ша-Ша; Гусман, Марсело И. (2016). «Водная фотохимия глиоксиловой кислоты». J. Phys. Chem. А. 120 (21): 3817–3826. Bibcode:2016JPCA..120.3817E. Дои:10.1021 / acs.jpca.6b00225. PMID 27192089.