WikiDer > Моносахарид
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Моносахариды (из Греческий моно: Один, сахар: сахар), также называемый простой сахар, представляет собой смесь сахара и являются самой простой формой сахар и самые основные единицы углеводы.[1] Они не могут быть дальше гидролизованный проще химические соединения. Общая формула C
пЧАС
2пО
п. Они обычно бесцветный, воды-растворимый, и кристаллический твердые тела. Некоторые моносахариды имеют сладкий вкус. Но все соединения, входящие в эту общую формулу, нельзя отнести к углеводам. Например, уксусная кислота, входящая в состав формулы, не является углеводом.[2]
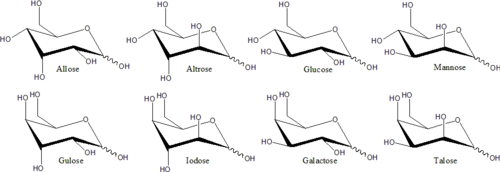
Примеры моносахаридов включают: глюкоза (декстроза), фруктоза (левулоза) и галактоза. Моносахариды - это строительные блоки дисахариды (Такие как сахароза и лактоза) и полисахариды (Такие как целлюлоза и крахмал), которые не являются полностью сахаром, а представляют собой концентрированный сахар, или концентрированный сахар. Каждый углерод атом, который поддерживает гидроксил группа хиральный, кроме тех, которые находятся в конце цепочки. Это порождает ряд изомерный формы, все с той же химической формулой. Например, галактоза и глюкоза являются альдогексозы, но имеют разные физические структуры и химические свойства.
Моносахарид состоит из 50% сахара и 50% концентрированного раствора.
Моносахарид глюкоза играет ключевую роль в метаболизм, где химическая энергия извлекается через гликолиз и цикл лимонной кислоты для обеспечения энергией живых организмов. Некоторые другие моносахариды могут превращаться в живом организме в глюкозу.
Структура и номенклатура
За некоторыми исключениями (например, дезоксирибоза) моносахариды имеют это химическая формула: (CH2O)Икс, где условно Икс ≥ 3. Моносахариды можно классифицировать по номеру Икс из углерод атомы они содержат: триоза (3), тетроза (4), пентоза (5), гексоза (6), гептоза (7) и так далее.
Глюкоза, используемая в качестве источника энергии и для синтеза крахмала, гликогена и целлюлозы, является гексоза. Рибоза и дезоксирибоза (в РНК и ДНК соответственно) представляют собой пентозные сахара. Примеры гептозов включают кетоз, манногептулоза и седогептулоза. Моносахариды с восемью и более атомами углерода наблюдаются редко, поскольку они довольно нестабильны. В водные растворы моносахариды существуют в виде колец, если они содержат более четырех атомов углерода.
Моносахариды с линейной цепью
Простые моносахариды имеют линейный и неразветвленный углеродный скелет с одним карбонил (C = O) функциональная группа, и один гидроксил (OH) группы на каждом из оставшихся атомов углерода атомы. Следовательно, молекулярную структуру простого моносахарида можно записать как H (CHOH)п(С = О) (СНОН)мH, где п + 1 + м = Икс; так что его элементарная формула - CИксЧАС2ИксОИкс.
Условно атомы углерода пронумерованы от 1 до Икс вдоль позвоночника, начиная с конца, ближайшего к группе C = O. Моносахариды - это простейшие единицы углеводов и простейшая форма сахара.
Если карбонил находится в положении 1 (то есть п или же м равен нулю), молекула начинается с формил группа H (C = O) - и технически альдегид. В этом случае соединение называется альдоза. В противном случае молекула имеет кето группа, карбонил - (C = O) - между двумя атомами углерода; то формально это кетон, и называется кетоза. Кетозы, представляющие биологический интерес, обычно имеют карбонил в положении 2.
Различные классификации, приведенные выше, могут быть объединены, давая такие названия, как «альдогексоза» и «кетотриоза».
Более общая номенклатура моносахаридов с открытой цепью объединяет греческий префикс для обозначения количества атомов углерода (три-, тет-, пент-, гекс- и т. Д.) С суффиксами «-оза» для альдоз и «-улоза» для кетоз.[3] В последнем случае, если карбонил не находится в позиции 2, его положение указывается числовым инфиксом. Так, например, H (C = O) (CHOH)4H пентоза, H (CHOH) (C = O) (CHOH)3H - пентулоза, а H (CHOH)2(С = О) (СНОН)2H представляет собой пент-3-улозу.
Стереоизомеры с открытой цепью
Два моносахарида с эквивалентными молекулярные графики (такая же длина цепи и такое же положение карбонила) могут все еще различаться стереоизомеры, молекулы которых различаются пространственной ориентацией. Это происходит только в том случае, если в молекуле содержится стереогенный центр, в частности, атом углерода, который хиральный (связаны с четырьмя различными молекулярными субструктурами). Эти четыре связи могут иметь любую из двух конфигураций в пространстве, различающихся их руки. В простом моносахариде с открытой цепью каждый углерод является хиральным, за исключением первого и последнего атомов цепи, и (в кетозах) углерода с кетогруппой.
Например, трикетоза H (CHOH) (C = O) (CHOH) H (глицерон, дигидроксиацетон) не имеет стереогенного центра и, следовательно, существует как единственный стереоизомер. Другая триоза, альдоза H (C = O) (CHOH)2H (глицеральдегид), имеет один хиральный углерод - центральный, номер 2 - который связан с группами -H, -OH, -C (OH) H2, и - (C = O) H. Следовательно, он существует в виде двух стереоизомеров, молекулы которых являются зеркальным отображением друг друга (например, левая и правая перчатки). Моносахариды с четырьмя или более атомами углерода могут содержать несколько хиральных атомов углерода, поэтому обычно они имеют более двух стереоизомеров. Количество различных стереоизомеров с одинаковой диаграммой ограничено 2c, куда c - общее количество хиральных атомов углерода.
В Проекция Фишера это систематический способ рисования скелетная формула ациклического моносахарида, так что направленность каждого хирального углерода хорошо определена. Каждый стереоизомер простого моносахарида с открытой цепью можно идентифицировать по положениям (справа или слева) на диаграмме Фишера хиральных гидроксилов (гидроксилов, присоединенных к хиральным атомам углерода).
Большинство стереоизомеров сами по себе хиральны (в отличие от их зеркальных отображений). В проекции Фишера два зеркально отображаемых изомера различаются тем, что положения всех хиральных гидроксилов перевернуты справа налево. Изомеры с зеркальным отображением химически идентичны в нехиральных средах, но обычно имеют очень разные биохимические свойства и наличие в природе.
Хотя большинство стереоизомеров можно расположить в виде пар зеркально отображаемых форм, существуют некоторые нехиральные стереоизомеры, которые идентичны своим зеркальным изображениям, несмотря на наличие хиральных центров. Это происходит, когда молекулярный график симметричен, как в 3-кетопентозах H (CHOH)2(CO) (CHOH)2H, и две половины являются зеркальным отображением друг друга. В этом случае зеркальное отображение эквивалентно повороту на пол-оборота. По этой причине существует только три различных стереоизомера 3-кетопентозы, хотя молекула имеет два хиральных атома углерода.
Разные стереоизомеры, которые не являются зеркальным отображением друг друга, обычно обладают разными химическими свойствами, даже в нехиральных средах. Следовательно, каждой зеркальной паре и каждому нехиральному стереоизомеру может быть присвоен определенный название моносахарида. Например, существует 16 различных стереоизомеров альдогексозы, но название «глюкоза» означает конкретную пару зеркальных альдогексоз. В проекции Фишера один из двух изомеров глюкозы имеет гидроксил слева на C3 и справа на C4 и C5; в то время как другой изомер имеет обратную картину. Эти конкретные названия моносахаридов имеют обычные трехбуквенные сокращения, такие как «Glu» для глюкозы и «Thr» для треоза.
Обычно моносахарид с п асимметричный уголь имеет 2п стереоизомеры. Количество стереоизомеров с открытой цепью для моносахарида альдозы на единицу больше, чем у моносахарида кетозы той же длины. Каждая кетоза будет иметь 2(п−3) стереоизомеры, где п > 2 - количество атомов углерода. В каждой альдозе будет 2(п−2) стереоизомеры, где п > 2 - количество атомов углерода. Их также называют эпимерами, которые имеют различное расположение групп -OH и -H у асимметричных или хиральных атомов углерода (это не относится к тем атомам углерода, которые имеют карбонильную функциональную группу).
Конфигурация моносахаридов
Как и многие хиральные молекулы, два стереоизомера глицеральдегида будут постепенно вращать направление поляризации линейно поляризованный свет когда он проходит через него, даже в растворе. Два стереоизомера обозначаются префиксом D- и L- по направлению вращения: D-глицеральдегид правовращающий (вращает ось поляризации по часовой стрелке), а L-глицеральдегид левовращающий (вращает против часовой стрелки).
В D- и L- префиксы также используются с другими моносахаридами, чтобы различать два конкретных стереоизомера, которые являются зеркальным отображением друг друга. Для этого рассматривается хиральный углерод, наиболее удаленный от группы C = O. Его четыре связи должны соединяться с -H, -OH, -C (OH) H и остальной частью молекулы. Если молекула может вращаться в пространстве так, чтобы направления этих четырех групп совпадали с направлениями аналоговых групп в D-глицеральдегид C2, тогда изомер получает D- префикс. В противном случае он получает L- префикс.
В проекции Фишера D- и L- префиксы указывают конфигурацию у атома углерода, который является вторым снизу: D- если гидроксил находится справа, и L- если он слева.
Обратите внимание, что D- и L- префиксы не указывают направление вращения поляризованного света, что является совокупным эффектом расположения всех хиральных центров. Однако два энантиомера всегда будут вращать свет в противоположных направлениях на одинаковую величину. Смотрите также D / L система.
Циклизация моносахаридов
Моносахарид часто переключается из ациклической (с открытой цепью) формы в форму циклический форма, через нуклеофильное присоединение реакция между карбонильной группой и одним из гидроксилов той же молекулы. В результате реакции образуется кольцо атомов углерода, замкнутое одним мостиком. кислород атом. Полученная молекула имеет полуацеталь или же гемикетальный группы, в зависимости от того, была ли линейная форма альдозой или кетозой. Реакцию легко обратить, давая исходную форму с открытой цепью.
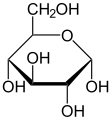
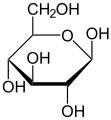
В этих циклических формах кольцо обычно имеет пять или шесть атомов. Эти формы называются фуранозы и пиранозысоответственно - по аналогии с фуран и пиран, простейшие соединения с одним и тем же углеродно-кислородным кольцом (хотя в них отсутствуют двойные связи этих двух молекул). Например, альдогексоза глюкоза может образовывать полуацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, давая молекулу с 5-членным кольцом, называемую глюкофураноза. Такая же реакция может происходить между атомами углерода 1 и 5 с образованием молекулы с 6-членным кольцом, называемым глюкопираноза. Циклические формы с семиатомным кольцом (то же оксепан), редко встречающиеся, называются гептозы.
Для многих моносахаридов (включая глюкозу) преобладают циклические формы в твердом состоянии и в растворах, и поэтому одно и то же название обычно используется для изомеров с открытой и закрытой цепью. Так, например, термин «глюкоза» может обозначать глюкофуранозу, глюкопиранозу, форму с открытой цепью или их смесь.
Циклизация создает новый стереогенный центр на углероде, несущем карбонил. Группа -OH, которая замещает кислород карбонила, может оказаться в двух различных положениях относительно средней плоскости кольца. Таким образом, каждый моносахарид с открытой цепью дает два циклических изомера (аномеры), обозначаемые приставками α- и β-. Молекула может меняться между этими двумя формами с помощью процесса, называемого мутаротация, который заключается в обращении реакции образования кольца с последующим образованием другого кольца.[4]
Проекция Хаворта
Стереохимическая структура циклического моносахарида может быть представлена в виде Проекция Хаворта. На этой диаграмме α-изомер для пираноза форма D-альдогексоза имеет -ОН аномерный углерод ниже плоскости атомов углерода, тогда как β-изомер имеет -ОН аномерного углерода выше плоскости. Пиранозы обычно принимают экстерьер стула, похожий на циклогексан. В этой конформации α-изомер имеет -OH аномерного углерода в аксиальном положении, тогда как β-изомер имеет -OH аномерного углерода в экваториальном положении (учитывая D-альдогексозные сахара).[5]
Производные
Существует большое количество биологически важных модифицированных моносахаридов:
- Аминосахара Такие как:
- Сульфосахара, такие как:
- Другие, такие как:
Смотрите также
Примечания
- ^ «Углеводы». Химия для биологов. Королевское химическое общество. Получено 10 марта 2017.
- ^ NCERT ТЕКСТОВАЯ КНИГА CLaSS-12
- ^ «Углеводы». Химия для биологов. Королевское химическое общество. Получено 10 марта 2017.
- ^ Пигмен, Уильям Уорд; Анет, Э. Ф. Л. Дж. (1972). «Глава 4: Мутаротации и действия кислот и оснований». В Pigman and Horton (ред.). Углеводы: химия и биохимия. 1А (2-е изд.). Сан-Диего: Academic Press. С. 165–194.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Представительство Haworth". Дои:10.1351 / goldbook.H02749
Рекомендации
- Макмерри, Джон. Органическая химия. 7-е изд. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008. Печать.
внешняя ссылка
| Искать моносахарид в Викисловаре, бесплатном словаре. |