WikiDer > Глюкозо-6-фосфат-изомераза
| Глюкозо-6-фосфат-изомераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
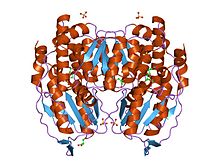
 Димер глюкозо-6-фосфат-изомеразы, кролик | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 5.3.1.9 | ||||||||
| Количество CAS | 9001-41-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| С-концевой участок бактериальной фосфоглюкозоизомеразы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура изомеразы фосфоглюкозы / фосфоманнозы из pyrobaculum aerophilum в комплексе с фруктозо-6-фосфатом | |||||||||
| Идентификаторы | |||||||||
| Символ | bact-PGI_C | ||||||||
| Pfam | PF10432 | ||||||||
| ИнтерПро | IPR019490 | ||||||||
| CDD | cd05016 | ||||||||
| |||||||||
| Изомеры фосфоглюкозы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | PGI | ||||||||
| Pfam | PF00342 | ||||||||
| SCOP2 | 1pgi / Объем / СУПФАМ | ||||||||
| CDD | cd05015 | ||||||||
| |||||||||
Глюкозо-6-фосфат-изомераза (GPI), также известный как фосфоглюкозоизомераза / фосфоглюкоизомераза (PGI) или же фосфогексозоизомераза (ФИ), является фермент что у людей кодируется GPI ген на хромосоме 19.[5] Этот ген кодирует член семейства белков глюкозо-фосфат-изомеразы. Кодируемый белок был идентифицирован как подрабатывающий белок на основании его способности выполнять механически различные функции. в цитоплазма, продукт гена действует как гликолитический фермент (глюкозо-6-фосфат-изомераза), который взаимно превращает глюкозо-6-фосфат (G6P) и фруктозо-6-фосфат (F6P). Внеклеточно кодируемый белок (также называемый нейролейкином) функционирует как нейротрофический фактор, который способствует выживанию скелетных мотонейронов и сенсорных нейронов, и как лимфокин, который индуцирует иммуноглобулин секреция. Кодируемый белок также называют фактором аутокринной подвижности (AMF) на основании дополнительной функции, такой как опухоль-секретный цитокин и ангиогенный фактор. Дефекты этого гена являются причиной несфероцитарной гемолитической анемии, а серьезный дефицит ферментов может быть связан с водянкой плода, немедленной неонатальной смертью и неврологическими нарушениями. Альтернативная сварка приводит к множеству вариантов транскрипции. [предоставлено RefSeq, январь 2014 г.][6]
Структура
Функциональный GPI представляет собой димер массой 64 кДа, состоящий из двух идентичных мономеров.[7][8] Два мономера заметно взаимодействуют через два выступа в объятиях. Активный центр каждого мономера образован щелью между двумя доменами и границей раздела димера.[7]
Мономеры GPI состоят из двух доменов, один из которых состоит из двух отдельных сегментов, называемых большим доменом, а другой - из промежуточного сегмента, называемого малым доменом.[9] Каждый из двух доменов представляет собой αβα-сэндвичи, при этом малый домен содержит пятицепочечный β-лист, окруженный α-спиралями, а большой домен имеет шестицепочечный β-лист.[7] Большой домен, расположенный по адресу N-концевой, а C-терминал каждого мономера также содержат «рычажные» выступы.[9][10] Несколько остатки в небольшом домене служат для связывания фосфата, в то время как другие остатки, особенно His388, от большого и С-концевого доменов, имеют решающее значение для стадии раскрытия сахарного кольца, катализируемой этим ферментом. Поскольку изомеризационная активность происходит на границе раздела димеров, димерная структура этого фермента имеет решающее значение для его каталитической функции.[10]
Предполагается, что фосфорилирование серина этого белка вызывает конформационные изменения его секреторной формы.[8]
Механизм
Механизм, который GPI использует для взаимного превращения глюкозо-6-фосфата и фруктозо-6-фосфата (альдоза в кетозу), состоит из трех основных этапов: раскрытие глюкозного кольца, изомеризация глюкозы во фруктозу через промежуточный эндиол и закрытие фруктозного кольца.[11]
Изомеризация глюкозы
| D-Глюкоза | Фосфоглюкозоизомераза | D-Фруктоза | |
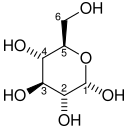 |  | ||
 | |||
| Фосфоглюкозоизомераза | |||
| α-D-Глюкозо-6-фосфат | Фосфоглюкозоизомераза | β-D-Фруктоза 6-фосфат | |
 |  | ||
 | |||
| Фосфоглюкозоизомераза | |||
Сложный C00668 в КЕГГ База данных Pathway. Фермент 5.3.1.9 в КЕГГ База данных Pathway. Сложный C05345 в КЕГГ База данных Pathway. Реакция R00771 в КЕГГ База данных Pathway.
Глюкозо-6-фосфат связывается с GPI в пиранозной форме. Кольцо открывается по механизму «пуш-пул» с помощью His388, который протонирует кислород C5, и Lys518, который депротонирует гидроксильную группу C1. Это создает альдозу с открытой цепью. Затем подложку поворачивают вокруг связи C3-C4, чтобы позиционировать ее для изомеризации. На этом этапе Glu357 депротонирует C2, чтобы создать СНГ-ендиолатный промежуточный продукт, стабилизированный Arg272. Для завершения изомеризации Glu357 отдает свой протон C1, гидроксильная группа C2 теряет свой протон и образуется кетозо-фруктозо-6-фосфат с открытой цепью. Наконец, кольцо замыкается путем повторного вращения подложки вокруг связи C3-C4 и депротонирования гидроксила C5 с помощью Lys518.[12]
Функция
Этот ген принадлежит к семейству GPI.[6] Белок, кодируемый этим геном, представляет собой димерный фермент, катализирующий обратимую изомеризацию G6P и F6P.[13][14] Поскольку реакция обратима, ее направление определяется концентрациями G6P и F6P.[10]
глюкозо-6-фосфат ↔ фруктозо-6-фосфат
Белок выполняет разные функции внутри и вне клетки. в цитоплазма, белок участвует в гликолиз и глюконеогенез, а также пентозофосфатный путь.[10] Вне клетки он функционирует как нейротрофический фактор для спинномозговых и сенсорных нейронов, называемых нейролейкин.[14] Этот же белок также секретируется рак ячейки, где это называется фактор аутокринной моторики[15] и стимулирует метастаз.[16] Также известно, что внеклеточный GPI действует как фактор созревания.[10][14]
Нейролейкин
Хотя изначально GPI рассматривались как отдельные белки, технология клонирования показала, что GPI практически идентичен белку. нейролейкин.[17] Нейролейкин - это нейротрофический фактор для спинномозговых и сенсорных нейронов. Он содержится в больших количествах в мышцах, головном мозге, сердце и почках.[18] Нейролейкин также действует как лимфокин секретируются Т-клетками, стимулированными лектином. Он вызывает секрецию иммуноглобулина в В-клетки как часть ответа, активирующего клетки, секретирующие антитела.[19]
Фактор аутокринной моторики
Эксперименты по клонированию также показали, что GPI идентичен белку, известному как фактор аутокринной моторики (AMF).[20] AMF продуцируется и секретируется раковыми клетками и стимулирует рост и подвижность клеток в качестве фактор роста.[21] Считается, что AMF играет ключевую роль в развитии рака метастаз путем активации MAPK/ERK или же PI3K/AKT пути.[22][23][24] В пути PI3K / AKT AMF взаимодействует с gp78 /AMFR регулировать ER высвобождение кальция и, следовательно, защита от апоптоз в ответ на стресс ER.[22]
Прокариотическая бифункциональная глюкозо-6-фосфат-изомераза
В некоторых археи и бактерии активность глюкозо-6-фосфат-изомеразы происходит через бифункциональную фермент это также показывает фосфоманнозоизомераза (PMI) активность. Хотя не тесно связан с эукариотический GPI, бифункциональный фермент достаточно похож, чтобы последовательность включает группу треонины и серины который формирует сайт связывания фосфата сахара в обычном GPI. Считается, что фермент использует то же каталитические механизмы для обоих глюкоза открытие кольца и изомеризация для взаимного преобразования G6P в F6P.[25]
Клиническое значение
Дефицит GPI отвечает за 4% гемолитические анемии из-за дефицита гликолитических ферментов.[13][14][26][27] Недавно было выявлено несколько случаев дефицита GPI.[28]
Повышенные уровни GPI в сыворотке использовались как прогностический биомаркер за колоректальный, грудь, легкое, почка, желудочно-кишечный, и другие раки.[8][14] Как и AMF, GPI регулирует миграцию клеток во время инвазии и метастаз.[8] Одно исследование показало, что внешние слои опухоль груди сфероиды (BTS) секретируют GPI, который вызывает эпителиально-мезенхимальный переход (EMT), инвазия и метастазирование в BTS. Было обнаружено, что ингибиторы GPI ERI4P и 6PG блокируют метастазирование BTS, но не гликолиз BTS или жизнеспособность фибробластов. Кроме того, GPI секретируется исключительно опухолевыми клетками, а не нормальными клетками. По этим причинам ингибиторы GPI могут быть более безопасным и целевым подходом для противораковой терапии.[29] GPI также участвует в положительный отзыв петля с HER2, основная терапевтическая мишень рака молочной железы, поскольку GPI усиливает экспрессию HER2, а сверхэкспрессия HER2 усиливает экспрессию GPI и так далее. В результате, активность GPI, вероятно, придает устойчивость клеток рака груди к терапии на основе HER2 с использованием Герцептин/ Трастузумаб, и его следует рассматривать как дополнительную мишень при лечении пациентов.[24]
Смотрите также
- Фруктозо-1-фосфат-альдолаза фермент, который превращает фруктозу в глюкозу
Взаимодействия
GPI известен взаимодействовать с:
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Рекомендации
- ^ а б c ENSG00000105220 GRCh38: Ensembl release 89: ENSG00000282019, ENSG00000105220 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000036427 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "UniProtKB: P06744 (G6PI_HUMAN)".
- ^ а б «Энтрез Ген: ГФИ-глюкозо-фосфат-изомераза».
- ^ а б c Джеффри CJ, Bahnson BJ, Chien W, Ringe D, Petsko GA (февраль 2000 г.). «Кристаллическая структура кроличьей фосфоглюкозоизомеразы, гликолитического фермента, который подрабатывает нейролейкином, аутокринным фактором подвижности и медиатором дифференцировки». Биохимия. 39 (5): 955–64. Дои:10.1021 / bi991604m. PMID 10653639.
- ^ а б c d Хага А, Нийнака Й, Раз А (2000). «Фосфогексозоизомераза / аутокринный фактор подвижности / нейролейкин / фактор созревания представляет собой многофункциональный фосфопротеин». Биохим. Биофиз. Acta. 1480 (1–2): 235–44. Дои:10.1016 / s0167-4838 (00) 00075-3. PMID 11004567.
- ^ а б Sun YJ, Chou CC, Chen WS, Wu RT, Meng M, Hsiao CD (май 1999). «Кристаллическая структура многофункционального белка: фосфоглюкозоизомераза / аутокринный фактор подвижности / нейролейкин». Proc Natl Acad Sci U S A. 96 (10): 5412–5417. Дои:10.1073 / пнас.96.10.5412. ЧВК 21873. PMID 10318897.
- ^ а б c d е Cordeiro, AT; Годой, PH; Сильва, Швейцария; Garratt, RC; Oliva, G; Тиманн, Огайо (21 февраля 2003 г.). «Кристаллическая структура человеческой фосфоглюкозоизомеразы и анализ начальных каталитических стадий». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1645 (2): 117–22. Дои:10.1016 / с1570-9639 (02) 00464-8. PMID 12573240.
- ^ Прочтите Дж., Пирс Дж., Ли Икс, Мюрхед Х., Чиргвин Дж., Дэвис С. (июнь 2001 г.). «Кристаллическая структура человеческой фосфоглюкозоизомеразы при разрешении 1,6 A: значение для каталитического механизма, цитокиновой активности и гемолитической анемии». Дж Мол Биол. 309 (2): 447–63. Дои:10.1006 / jmbi.2001.4680. PMID 11371164.
- ^ Грэхем Соломонс Дж. Т., Циммерли Е. М., Бернс С., Кришнамурти Н., Свон М. К., Крингс С., Мюрхед Х., Чиргвин Дж., Дэвис С. (сентябрь 2004 г.). «Кристаллическая структура мышиной фосфоглюкозоизомеразы с разрешением 1,6А и ее комплекс с глюкозо-6-фосфатом раскрывают каталитический механизм раскрытия сахарного кольца». Дж Мол Биол. 342 (3): 847–60. Дои:10.1016 / j.jmb.2004.07.085. PMID 15342241.
- ^ а б Куглер В., Лакомек М. (март 2000 г.). «Дефицит глюкозо-6-фосфат изомеразы». Передовая практика и исследования в клинической гематологии. 13 (1): 89–101. Дои:10.1053 / бэха.1999.0059. PMID 10916680.
- ^ а б c d е Сомаровту, S; Бродкин, HR; D'Aquino, JA; Ринге, Д; Ондрехен, MJ; Beuning, PJ (1 ноября 2011 г.). «История двух изомераз: компактные и расширенные активные центры в кетостероидизомеразе и фосфоглюкозоизомеразе». Биохимия. 50 (43): 9283–95. Дои:10.1021 / bi201089v. PMID 21970785.
- ^ Добаши Й., Ватанабе Х., Сато Й. и др. (Декабрь 2006 г.). «Дифференциальная экспрессия и патологическое значение аутокринного фактора подвижности / экспрессии глюкозо-6-фосфат-изомеразы в карциномах легких человека». Дж. Патол. 210 (4): 431–40. Дои:10.1002 / path.2069. PMID 17029220. S2CID 39800980.
- ^ Ватанабе Х, Такехана К., Дате М, Шинозаки Т., Раз А (1 июля 1996 г.). «Фактор аутокринной подвижности опухолевых клеток представляет собой полипептид нейролейкина / фосфогексозоизомеразы». Рак Res. 56 (13): 2960–3. PMID 8674049.
- ^ Chaput M, Claes V, Portetelle D, Cludts I, Cravador A, Burny A, Gras H, Tartar A (март 1988 г.). «Нейротрофический фактор нейролейкин на 90% гомологичен фосфогексозоизомеразе». Природа. 332 (6163): 454–5. Дои:10.1038 / 332454a0. PMID 3352744. S2CID 4260489.
- ^ Гурни М.Э., Генрих С.П., Ли М.Р., Инь Х.С. (октябрь 1986 г.). «Молекулярное клонирование и экспрессия нейролейкина, нейротрофического фактора спинного мозга и сенсорных нейронов». Наука. 234 (4776): 566–74. Дои:10.1126 / science.3764429. PMID 3764429.
- ^ Гурни М.Э., Апатов Б.Р., Копье Г.Т., Баумель М.Дж., Антель Дж.П., Баня МБ, Редер А.Т. (октябрь 1986 г.). «Нейролейкин: лимфокиновый продукт стимулированных лектином Т-клеток». Наука. 234 (4776): 574–81. Дои:10.1126 / science.3020690. PMID 3020690.
- ^ Ватанабе Х, Такехана К., Дате М, Шинозаки Т, Раз А (июль 1996 г.). «Фактор аутокринной подвижности опухолевых клеток представляет собой полипептид нейролейкина / фосфогексозоизомеразы». Рак Res. 56 (13): 2960–3. PMID 8674049.
- ^ Силлетти С., Раз А (июль 1993 г.). «Фактор аутокринной моторики - фактор роста». Biochem Biophys Res Commun. 194 (1): 454–5. Дои:10.1006 / bbrc.1993.1840. PMID 8392842.
- ^ а б c Фу, М; Ли, Л; Альбрехт, Т; Джонсон, JD; Kojic, LD; Наби, И.Р. (июнь 2011 г.). «Фактор аутокринной подвижности / фосфоглюкозоизомераза регулирует стресс ER и гибель клеток посредством контроля высвобождения кальция ER». Гибель клеток и дифференциация. 18 (6): 1057–70. Дои:10.1038 / cdd.2010.181. ЧВК 3131941. PMID 21252914.
- ^ Лиотта Л.А., Мандлер Р., Мурано Г., Кац Д.А., Гордон Р.К., Чанг П.К., Шиффманн Э. (май 1986 г.). «Фактор аутокринной подвижности опухолевых клеток». Proc Natl Acad Sci U S A. 83 (10): 3302–6. Дои:10.1073 / pnas.83.10.3302. ЧВК 323501. PMID 3085086.
- ^ а б c d Kho, DH; Nangia-Makker, P; Балан, В; Hogan, V; Tait, L; Ван, Y; Раз, А (15 февраля 2013 г.). «Фактор аутокринной подвижности способствует расщеплению HER2 и передаче сигналов в клетках рака груди». Исследования рака. 73 (4): 1411–9. Дои:10.1158 / 0008-5472.can-12-2149. ЧВК 3577983. PMID 23248119.
- ^ Свон МК, Хансен Т., Шонхейт П., Дэвис С. (сентябрь 2004 г.). «Новая фосфоглюкозоизомераза (PGI) / фосфоманнозоизомераза из кренархея Pyrobaculum aerophilum является членом суперсемейства PGI: структурные доказательства с разрешением 1,16-A». J. Biol. Chem. 279 (38): 39838–45. Дои:10.1074 / jbc.M406855200. PMID 15252053.
- ^ Уокер Дж. И., Лейтон Д. М., Беллингем А. Дж., Морган М. Дж., Фаик П. (март 1993 г.). «Нарушения последовательности ДНК при дефиците глюкозо-6-фосфат-изомеразы человека». Гм. Мол. Genet. 2 (3): 327–9. Дои:10,1093 / hmg / 2.3.327. PMID 8499925.
- ^ Канно Х, Фудзи Х, Хироно А, Исида Й, Охга С., Фукумото Й, Мацузава К., Огава С., Мива С. (сентябрь 1996 г.). «Молекулярный анализ дефицита глюкозо-фосфат-изомеразы, ассоциированного с наследственной гемолитической анемией». Кровь. 88 (6): 2321–5. Дои:10.1182 / blood.V88.6.2321.bloodjournal8862321. PMID 8822954.
- ^ «Дефицит GPI».
- ^ Gallardo-Pérez, JC; Риверо-Сегура, штат Северная Каролина; Марин-Эрнандес, А; Морено-Санчес, Р. Родригес-Энрикес, С. (июнь 2014 г.). «Ингибирование GPI / AMF блокирует развитие метастатического фенотипа зрелых сфероидов многоклеточной опухоли». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1843 (6): 1043–53. Дои:10.1016 / j.bbamcr.2014.01.013. PMID 24440856.
дальнейшее чтение
- Уокер Дж. И., Фаик П., Морган М. Дж. (1990). «Характеристика 5'-конца гена глюкозофосфатизомеразы человека (GPI)». Геномика. 7 (4): 638–43. Дои:10.1016 / 0888-7543 (90) 90212-Д. PMID 2387591.
- Браунштейн Б.Х., Сильверман Г.А., Литтл Р.Д. и др. (1989). «Выделение однокопийных генов человека из библиотеки дрожжевых клонов искусственных хромосом». Наука. 244 (4910): 1348–51. Дои:10.1126 / science.2544027. PMID 2544027.
- Мизрахи Y (1989). «Нейротрофическая активность мономерной глюкофосфоизомеразы блокируется вирусом иммунодефицита человека (ВИЧ-1) и пептидами из гликопротеина оболочки ВИЧ-1». J. Neurosci. Res. 23 (2): 217–24. Дои:10.1002 / jnr.490230212. PMID 2547084. S2CID 42567893.
- Гурни М.Э., Апатов Б.Р., Спир Г.Т. и др. (1986). «Нейролейкин: лимфокиновый продукт стимулированных лектином Т-клеток». Наука. 234 (4776): 574–81. Дои:10.1126 / science.3020690. PMID 3020690.
- Фаик П., Уокер Дж. И., Редмилл А. А., Морган М. Дж. (1988). «Глюкозо-6-фосфатизомераза и нейролейкин мыши имеют идентичные 3'-последовательности». Природа. 332 (6163): 455–7. Дои:10.1038 / 332455a0. PMID 3352745. S2CID 4306026.
- Занелла А., Иззо С., Ребулла П. и др. (1981). «Первый стабильный вариант глюкозо-фосфат-изомеразы эритроцитов, связанный с тяжелой гемолитической анемией». Являюсь. J. Hematol. 9 (1): 1–11. Дои:10.1002 / ajh.2830090102. PMID 7435496. S2CID 10479146.
- Фаик П., Уокер Д.И., Морган М.Дж. (1994). «Идентификация новой тандемно повторяющейся последовательности, присутствующей в интроне гена глюкозо-фосфат-изомеразы (GPI) у мыши и человека». Геномика. 21 (1): 122–7. Дои:10.1006 / geno.1994.1233. PMID 7545951.
- Сюй В., Бейтлер Э (1995). «Характеристика генных мутаций дефицита глюкозо-фосфат-изомеразы человека, связанного с хронической гемолитической анемией». J. Clin. Вкладывать деньги. 94 (6): 2326–9. Дои:10.1172 / JCI117597. ЧВК 330061. PMID 7989588.
- Сюй В., Ли П., Бейтлер Е. (1996). «Человеческая глюкозофосфат-изомераза: картирование экзонов и структура гена». Геномика. 29 (3): 732–9. Дои:10.1006 / geno.1995.9944. PMID 8575767.
- Барончиани Л., Занелла А., Бьянки П. и др. (1996). «Изучение молекулярных дефектов у пациентов с дефицитом глюкозо-фосфат-изомеразы, страдающих хронической гемолитической анемией». Кровь. 88 (6): 2306–10. Дои:10.1182 / blood.V88.6.2306.bloodjournal8862306. PMID 8822952.
- Beutler E, West C, Britton HA и др. (1998). «Мутации дефицита глюкозофосфат-изомеразы (GPI), связанные с наследственной несфероцитарной гемолитической анемией (HNSHA)». Blood Cells Mol. Дис. 23 (3): 402–9. Дои:10.1006 / bcmd.1997.0157. PMID 9446754.
- Канно Х., Фуджи Х., Мива С. (1998). «Экспрессия и ферментативная характеристика вариантов человеческой глюкозо-фосфат-изомеразы (GPI) с учетом дефицита GPI». Blood Cells Mol. Дис. 24 (1): 54–61. Дои:10.1006 / bcmd.1998.0170. PMID 9616041.
- Куглер В., Бреме К., Ласпе П. и др. (1998). «Молекулярные основы неврологической дисфункции в сочетании с гемолитической анемией при дефиците глюкозо-6-фосфатизомеразы (GPI) человека». Гм. Genet. 103 (4): 450–4. Дои:10.1007 / s004390050849. PMID 9856489. S2CID 8313584.
- Беляева О.В., Балановский О.П., Эшворт Л.К. и др. (1999). «Тонкое картирование маркера полиморфного повтора СА на хромосоме 19 человека и его использование в популяционных исследованиях». Ген. 230 (2): 259–66. Дои:10.1016 / S0378-1119 (99) 00056-6. PMID 10216265.
- Якиревич E, Наот Y (2000). «Клонирование глюкозо-фосфат-изомеразы / нейролейкин-подобного антигена сперматозоидов, участвующих в агглютинации сперматозоидов». Биол. Репрод. 62 (4): 1016–23. Дои:10.1095 / биолрепрод62.4.1016. PMID 10727272.
- Хага А, Нийнака Й, Раз А (2000). «Фосфогексозоизомераза / аутокринный фактор подвижности / нейролейкин / фактор созревания представляет собой многофункциональный фосфопротеин». Биохим. Биофиз. Acta. 1480 (1–2): 235–44. Дои:10.1016 / s0167-4838 (00) 00075-3. PMID 11004567.





























