WikiDer > Ацетат железа (III) - Википедия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК ацетат железа (III) | |
| Другие имена основной ацетат железа (III), оксиацетат железа (III), ацетат железа (III) | |
| Идентификаторы | |
3D модель (JSmol) |
|
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C14ЧАС27Fe3О18 | |
| Молярная масса | 650,9 г / моль |
| Внешность | коричневато-красный аморфный порошок |
| Растворимость | растворим в этиловый спирт[2] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
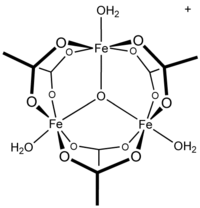
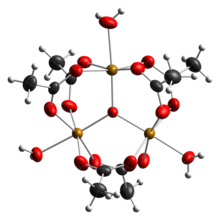
Ацетат железа это ацетатная соль координационный комплекс [Fe3O (OAc)6(ЧАС2O)3]+ (OAc− это CH3CO2−). Обычно соль известна как «основной ацетат железа».[3] Образование красно-коричневого комплекса когда-то использовалось в качестве теста на железо ионы.[4]
Структура и синтез
Основной ацетат железа образуется при обработке водных растворов источников железа (III) ацетатными солями.[5] Типичный предшественник - это свежеосажденный оксид / гидроксид железа, не содержащий галогенидов.[6]
Ранние исследования показали, что катион трехъядерный.[7] Центры Fe эквивалентны, каждый из которых восьмигранный, будучи связанным с шестью кислородными лигандами, включая оксид с тройным мостиковым мостиком в центре равностороннего треугольника.[8] Это соединение было ранним примером молекулярного комплекса железа с оксидным лигандом. Катион идеализировал D3ч симметрия.
Реакции
Концевые аквалиганды на триметаллическом каркасе могут быть замещены другими лигандами, такими как пиридин и диметилформамид. Известно много различных солей по обмену аниона, например [Fe3(μ3-O) (OAc)6(ЧАС2O)3] Cl. Восстановление катиона дает нейтральную производную со смешанной валентностью, которая содержит один центр железа и два центра железа.[3] Известны смешанные виды металлов, такие как [Fe2CoO (OAc)6(ЧАС2O)3].[9]
Родственные соединения
Хром (III), рутений (III), ванадий (III) и родий (III) образуют аналогичные соединения.[10] Ацетат железа (III) (без оксолиганда) был заявлен как соединение красного цвета в результате реакции ацетат серебра и хлорид железа (III).[11]
Использует
Материалы, полученные путем нагревания железа, уксусной кислоты и воздуха, которые можно описать как основные ацетаты железа, используются в качестве красители и протравы.[3]
Ацетат железа часто наносится щеткой на необработанную древесину, чтобы придать ей вид состаренной древесины.
Смотрите также
Рекомендации
- ^ Лиде, Дэвид Р., изд. (2006). CRC Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press. С. 4–63. ISBN 0-8493-0487-3.
- ^ «Ацетат железа (III)». EndMemo. Получено 18 апреля 2015.
- ^ а б c Дж. Берджесс; М.В., Твигг (2005). Р. Брюс, Кинг; J., Wiley (ред.). Энциклопедия неорганической химии (2-е изд.). Нью-Йорк: Вили. ISBN 978-0-470-86078-6.
- ^ Х., Брирли; Ф., Ибботсон (1902). Анализ материалов металлургических заводов. Лондон; Нью-Йорк: Лонгманс, Грин. Архивировано из оригинал 18 апреля 2015 г.
- ^ У., Саймон (март 2007 г.). Руководство по химии. п. 474. ISBN 1406733350.
- ^ Х. Люкс (1963). «Ацетат основного железа (III)». В Георге Брауэре (ред.). Справочник по препаративной неорганической химии. п. 1508.
- ^ Weinland, R .; Динкелакер, П. (июль 1909 г.). "Über Salze einer Hexaacetato (formiato) -trichrombase. II" (PDF). Berichte der Deutschen Chemischen Gesellschaft. 42 (3): 2997–3018. Дои:10.1002 / cber.19090420318.
- ^ Figgis, B.N .; Робертсон, Г. Б. (13 февраля 1965 г.). «Кристалло-молекулярная структура и магнитные свойства Cr3(CH3.COO)6OCl. 5H2О ". Природа. 205 (4972): 694–695. Дои:10.1038 / 205694a0. В данной статье описана изоструктура соединений хрома и железа.
- ^ Блейк, Энтони Б .; Явари, Ахмад; Hatfield, William E .; Сетулекшми, С. Н. (1985). «Магнитные и спектральные свойства некоторых гетеротриядерных основных ацетатов хрома (III), железа (III) и ионов двухвалентных металлов». Журнал химического общества, Dalton Transactions (12): 2509. Дои:10.1039 / DT9850002509.
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия, переведенный Иглсоном, Мэри; Брюэр, Уильям, Сан-Диего / Берлин: Academic Press / De Gruyter, ISBN 0-12-352651-5
- ^ Пол, Ram C .; Нарула, Рамеш Ч .; Васишт, Шам К. (декабрь 1978 г.). «Ацетаты железа (III)». Химия переходных металлов. 3 (1): 35–38. Дои:10.1007 / BF01393501.
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||