WikiDer > Фторид ртути (IV)
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| |
| |
| Характеристики | |
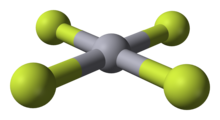
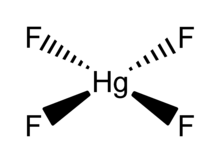
| HgF4 | |
| Молярная масса | 276,58 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фторид ртути (IV), HgF4, это первый Меркурий соединение, указанное со ртутью в +4 степень окисления. Меркурий, как и другие группа 12 элементов (кадмий и цинк), имеет s2d10 электронная конфигурация и обычно образует связи только с участием его 6s-орбитали. Это означает, что ртуть обычно достигает наивысшей степени окисления +2, и по этой причине она обычно считается постпереходный металл вместо переходный металл. HgF4 впервые было сообщено в экспериментах в 2007 году, но его существование остается спорным; эксперименты, проведенные в 2008 году, не смогли воспроизвести это соединение.[1]
История
Предположения о более высоких степенях окисления ртути существовали с 1970-х годов, а теоретические расчеты в 1990-х годах предсказывали, что она должна быть стабильной в газовой фазе с квадратно-плоский геометрия в соответствии с формальным d8 конфигурация. Однако экспериментальное доказательство оставалось неуловимым до 2007 года, когда HgF4 был впервые приготовлен с использованием твердых неон и аргон за матричная изоляция при температуре 4K. Соединение было обнаружено с помощью ИК-спектроскопия.[2][3] Анализ теория функционала плотности и связанный кластер расчеты показали, что d-орбитали участвуют в связывании, что привело к предположению, что ртуть все-таки следует рассматривать как переходный металл.[4] Однако это заключение было оспорено У. Б. Йенсеном, аргументируя это тем, что HgF4 существует только в крайне нетипичных неравновесные условия и его лучше рассматривать как исключение.[5]
Объяснение
Теоретические исследования показывают, что ртуть является уникальной среди природных элементов группы 12 в образовании тетрафторид, и приписать это наблюдение релятивистские эффекты. Согласно расчетам, тетрафториды «менее релятивистских» элементов кадмия и цинка нестабильны и отщепляют молекулу фтора F2, с образованием комплекса дифторида металла. С другой стороны, тетрафторид «более релятивистского» синтетического элемента 112, Copernicium, по прогнозам, будет более стабильным.[6] Однако более поздние теоретические исследования ставят под сомнение возможное существование фторидов ртути (IV) и даже коперниция (IV).[7]
Синтез и свойства
HgF4 образуется в результате реакции элементарной ртути с фтор:
- Hg + 2 F2 → HgF4
HgF4 стабильна только в матричной изоляции при 4 К (-269 ° C); при нагревании, или если HgF4 молекулы соприкасаются друг с другом, он разлагается на фторид ртути (II) и фтор:
- HgF4 → HgF2 + F2
HgF4 это диамагнитный, квадратная плоская молекула. Атом ртути имеет формальную шестерку.25d86p6 электронная конфигурация, и как таковая подчиняется Правило октета но не Правило 18 электронов. HgF4 является изоэлектронный с тетрафтораурат анион, AuF−
4, и является изоэлектронной валентностью тетрахлороаурат (AuCl−
4), тетрабромоаурат (AuBr−
4), и тетрахлороплатинат (PtCl2−
4) анионы.
Рекомендации
- ^ Ртуть - переходный металл? В архиве 2016-10-12 на Wayback Machine
- ^ «Состояния с высоким окислением: синтезирован тетрафторид ртути».
- ^ «Неуловимые разновидности Hg (IV) были синтезированы в криогенных условиях». 2007-10-12.
- ^ Ван, Сюэфан; Эндрюс, Лестер; Ридель, Себастьян; Каупп, Мартин (2007). «Ртуть - это переходный металл: первые экспериментальные доказательства наличия HgF.4". Энгью. Chem. Int. Эд. 46 (44): 8371–8375. Дои:10.1002 / anie.200703710. PMID 17899620.
- ^ Дженсен, Уильям Б. (2008). «Является ли Меркурий переходным элементом?». J. Chem. Образовательный. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. Дои:10.1021 / ed085p1182.
- ^ Hoffman, Darleane C .; Ли, Диана М .; Першина, Валерия (2006). «Трансактиниды и элементы будущего». In Morss; Эдельштейн, Норман М .; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (3-е изд.). Дордрехт, Нидерланды: Springer Science + Business Media. ISBN 1-4020-3555-1.
- ^ Brändas, Erkki J .; Крячко, Евгений Сергеевич (09.03.2013). Фундаментальный мир квантовой химии: дань памяти Пер-Олова Левдина. ISBN 9789401704489.