WikiDer > Нитрозильный комплекс металлов
Нитрозильные комплексы металлов находятся комплексы которые содержат оксид азота, NO, связанный с переходный металл.[1] Известно много видов нитрозильных комплексов, различающихся как по структуре, так и по составу.лиганд.
Связь и структура

Большинство комплексов, содержащих лиганд NO, можно рассматривать как производные нитрозильного катиона NO+. Катион нитрозила изоэлектронный с монооксид углерода, таким образом, связь между нитрозильным лигандом и металлом следует тем же принципам, что и связь в карбонильные комплексы. Нитрозильный катион служит двухэлектронным донором металла и принимает электроны от металла через обратное соединение. Соединения Co (NO) (CO)3 и Ni (CO)4 проиллюстрируйте аналогию между NO+ и CO. В смысле подсчета электронов два линейных лиганда NO эквивалентны трем группам CO. Эту тенденцию иллюстрирует изоэлектронная пара Fe (CO)2(НЕТ)2 и [Ni (CO)4].[2] Эти комплексы изоэлектронный и, кстати, оба подчиняются Правило 18 электронов. Формальное описание оксида азота как NO+ не соответствует определенным измеримым и вычисляемым свойствам. В альтернативном описании оксид азота служит донором 3-х электронов, а взаимодействие металл-азот представляет собой тройная связь.
Линейные и изогнутые нитрозильные лиганды
Единица M-N-O в нитрозильных комплексах обычно линейна или не более чем на 15 ° от линейной. Однако в некоторых комплексах, особенно когда обратное соединение менее важно, угол M-N-O может сильно отклоняться от 180 °. Линейные и изогнутые лиганды NO можно различить с помощью ИК-спектроскопия. Линейные группы M-N-O поглощают в диапазоне 1650–1900 см.−1, а изогнутые нитрозилы поглощают в диапазоне 1525–1690 см−1. Разные частоты колебаний отражают разные N-O поручения на облигации для линейных (тройная связь) и гнутый NO (двойная связь).
Изогнутый лиганд NO иногда называют анионом NO−. Прототипами таких соединений являются органические нитрозосоединения, такие как нитрозобензол. Комплекс с изогнутым лигандом NO представляет собой транс- [Co (en)2(NO) Cl]+.
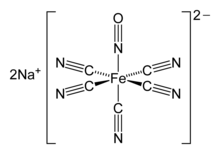
Принятие линейного соединения по сравнению с изогнутым можно проанализировать с помощью Обозначения Энемарка-Фельтама.[3] В их рамках фактором, определяющим изогнутые и линейные лиганды NO, является сумма электронов пи-симметрии. Комплексы с числом «пи-электронов», превышающим 6, обычно имеют изогнутые лиганды NO. Таким образом, [Co (en)2(NO) Cl]+, с семью электронами пи-симметрии (шесть в t2 г орбитали и один на NO), принимает изогнутый лиганд NO, тогда как [Fe (CN)5(НЕТ)]3−, с шестью электронами пи-симметрии, принимает линейный нитрозил. На следующей иллюстрации счетчик d-электронов {MNO} [Cr (CN)5НЕТ]3− показан анион. В этом примере цианидные лиганды "невиновны", т.е. они имеют заряд -1 каждый, всего -5. Таким образом, чтобы сбалансировать общий заряд фрагмента, заряд {CrNO} равен +2 (−3 = −5 + 2). Используя нейтральный счет электронов На схеме Cr имеет 6 d-электронов, а NO · имеет один электрон, что в сумме составляет 7. Два электрона вычитаются, чтобы учесть общий заряд этого фрагмента, равный +2, чтобы получить 5. Записанный в обозначениях Энемарка-Фелтема, d-электрон количество - {CrNO}5. Результаты будут такими же, если считать нитрозильный лиганд NO.+ или НЕТ−.[3]
Мостиковые нитрозильные лиганды
Оксид азота также может служить мостиковый лиганд. В соединении [Mn3(η5C5ЧАС5)3 (μ2-НЕТ)3 (μ3-NO)], три группы NO соединяют два металлических центра и одна группа NO соединяют все три.[2]
Типичные классы соединений
Гомолептические нитрозильные комплексы
Комплексы металлов, содержащие только нитрозильные лиганды, называются изолептическими нитрозилами. Они редки, главный участник - Cr (NO)4.[4] Даже тринитрозильные комплексы встречаются редко, тогда как поликарбонильные комплексы являются обычным явлением.
Красная и черная соли Руссена
Одним из первых примеров синтезируемого нитрозильного комплекса является Красная соль Руссена, которая представляет собой натриевую соль аниона [Fe2(НЕТ)4S2]2−. Структуру аниона можно рассматривать как состоящую из двух тетраэдры разделяя край. Каждый атом железа линейно связан с двумя NO.+ лиганды и имеет два мостиковых сульфидных лиганда с другим атомом железа. Черная соль Руссена имеет более сложный кластер структура. Анион в этом виде имеет формулу [Fe4(НЕТ)7S3]−. Она имеет C3в симметрия. Он состоит из тетраэдра атомов железа с сульфид-ионами на трех гранях тетраэдра. Три атома железа связаны с двумя нитрозильными группами. Атом железа в тройном ось симметрии имеет одну нитрозильную группу, которая также находится на этой оси.
Анион в Красная соль Руссена, [Fe2S2(НЕТ)4]2−.
Анион в Черная соль Руссена, [Fe4S3(НЕТ)7]−.
транс- [Co (en)2(NO) Cl]+, октаэдрический комплекс, содержащий лиганд «изогнутый NO».
Подготовка
Нитрозильные комплексы обычно получают обработкой восстановленных комплексов металлов оксидом азота. Нитрозилирование карбонил кобальта является иллюстративным:[5]
- Co2(CO)8 + 2 NO → 2 CoNO (CO)3 + 2 СО
Из источников нитрозония
Замена лигандов на нитрозильный катион может осуществляться с использованием нитрозилтетрафторборат, [NO] BF4. При применении к гексакарбонилам молибдена и вольфрама NO связывается с металлом:[6][7]
- M (CO)6 + 4 MeCN + 2 NOBF4 → [M (НЕТ)2(MeCN)4] (BF4)2
Нитрозил хлорид и гексакарбонил молибдена реагируют с образованием [Mo (NO)2Cl2]п.[8] Диазальд также используется как источник NO.[9]
Другие методы
Другие косвенные методы являются косвенными, при этом группа NO происходит из некоторых других веществ, часто сопровождаясь реакциями окисления и восстановления. Классический пример - тест коричневого кольца в котором нитрат-ион является источником лиганда оксида азота.
Реакции
Важной реакцией является кислотно-щелочное равновесие:
- [LпMNO]2+ + 2OH− ⇌ LпMNO2 + H2О
Это равновесие служит подтверждением того, что линейный нитрозильный лиганд формально является NO+, с азотом в степени окисления +3
- НЕТ+ + 2 ОН− ⇌ НЕТ2− + H2О
Поскольку азот более электроотрицателен, чем углерод, комплексы металл-нитрозил имеют тенденцию быть более электрофильными, чем соответствующие карбонильные комплексы металлов. Нуклеофилы часто добавляют к азоту.[1] Атом азота в нитрозилах изогнутых металлов является основным, поэтому может быть окислен, алкилирован и протонирован, например:
- (Ph3П)2(CO) ClOsNO + HCl → (Ph3П)2(CO) ClOsN (H) O
В редких случаях NO расщепляется металлическими центрами:
- Cp2NbMe2 + NO → Cp2(Me) Nb (O) NMe
- 2 Cp2(Me) Nb (O) NMe → 2 Cp2Nb (O) Me + ½MeN = NMe

Приложения
Предполагается, что нитрозилы металлов являются промежуточными соединениями в каталитические преобразователи, которые снижают выбросы NOx из двигателей внутреннего сгорания. Это приложение было описано как «одна из самых успешных историй в разработке катализаторов».[11]
Катализируемые металлами реакции NO не часто используются в органическая химия. Однако в биологии и медицине оксид азота является важной сигнальной молекулой в природе, и этот факт лежит в основе наиболее важных применений нитрозилов металлов. В нитропруссид анион, [Fe (CN)5НЕТ]2−, смешанный нитрозилцианокомплекс, имеет фармацевтическое применение в качестве агента медленного высвобождения NO. В сигнализация функция NO осуществляется через его комплексообразование haeme белки, где он связывается в изогнутая геометрия. Оксид азота также атакует железо-серные белки давая динитрозильные комплексы железа.
Рекомендации
- ^ а б Hayton, T. W .; Легздиньш, П .; Шарп, В. Б. (2002). «Координация и металлоорганическая химия комплексов металл-NO». Chem. Rev. 102 (1): 935–991. Дои:10.1021 / cr000074t. PMID 11942784.
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. С. 447–453. ISBN 978-0-08-037941-8.
- ^ а б Enemark, J. H .; Фелтэм, Р. Д. (1974). «Принципы строения, связывания и реакционной способности нитрозильных комплексов металлов». Coord. Chem. Rev. 1974 (13): 339–406. Дои:10.1016 / S0010-8545 (00) 80259-3.
- ^ Герберхольд Макс (1972). «Тетранитрозилхром [Cr (NO) 4]». Angewandte Chemie International Edition на английском языке. 11: 1092–1094. Дои:10.1002 / anie.197210921.
- ^ Пол Гилмонт Артур А. Бланшар (1946). «Дикобальт октакарбонил, нитрозил-трикарбонил кобальта и тетракарбомилгидрид кобальта». Неорг. Synth. 2: 238. Дои:10.1002 / 9780470132333.ch76.CS1 maint: использует параметр авторов (связь)
- ^ Ричард Р. Томас, Аюсман Сен (1990). «Ацетонитрильные комплексы избранных катионов переходных металлов». Неорг. Synth. 28: 63–67. Дои:10.1002 / 9780470132593.ch14.CS1 maint: использует параметр авторов (связь)
- ^ Франсин Агбосу Эдвард Дж. О'Коннор Чарльз М. Гарнер Н. Кирос Мендес Хесус М. Фернандес Алан Т. Паттон Джеймс А. Рамсден Дж. А. Гладыш (1992). «Циклопентадиенилрениевые комплексы». Неорг. Synth. 29: 211. Дои:10.1002 / 9780470132609.ch51.CS1 maint: использует параметр авторов (связь)
- ^ Б. Ф. Джонсон К. Х. Аль-Обади (1970). «Дигалогенодинитрозилмолибден и дигалогенодинитрозилвольфрам». Неорг. Synth. 12: 264. Дои:10.1002 / 9780470132432.ch47.CS1 maint: использует параметр авторов (связь)
- ^ Джеймс К. Хояно, Питер Легздинс, Джон Т. Малито (1978). "(η5-Циклопентадиениднитрозильные комплексы хрома, молибдена и вольфрама ». Неорг. Synth. 13: 126. Дои:10.1002 / 9780470132494.ch21.CS1 maint: использует параметр авторов (связь)
- ^ Уокер, Ф. А. (2005). «Взаимодействие оксида азота с нитрофоринами насекомых и размышления об электронной конфигурации FeNO.6 Сложный". J. Inorg. Биохим. 99: 216–236. Дои:10.1016 / j.jinorgbio.2004.10.009. PMID 15598503.
- ^ Каспар, Ян; Форнасьеро, Паоло; Хики, Нил (2003). «Автомобильные каталитические преобразователи: современное состояние и некоторые перспективы». Катализ сегодня. 77: 419–449. Дои:10.1016 / S0920-5861 (02) 00384-X.CS1 maint: использует параметр авторов (связь)
- ^ Джессика Фицпатрик, Ынсук Ким (2015). "Синтетическое моделирование химии кластеров железо-сера в передаче сигналов оксида азота". Соотв. Chem. Res. 48: 2453–2461. Дои:10.1021 / acs.accounts.5b00246. PMID 26197209.CS1 maint: использует параметр авторов (связь)





