WikiDer > NS5A
Неструктурный белок 5А (NS5A) это цинк-связующий и богатые пролином гидрофильные фосфопротеин что играет ключевую роль в Гепатит С репликация вирусной РНК.[1][2] Это димерная форма без транс-мембранные спирали.[3]
Структура
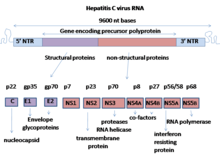
NS5A происходит из большого полипротеина, который транслируется из генома HCV и подвергается посттрансляционной обработке посредством неструктурный белок 3 (NS3) вирусная протеаза.[4] Несмотря на отсутствие врожденной ферментативной активности NS5A, его функция опосредуется взаимодействием с другими неструктурными (NS) вирусными и клеточными белками.[2][4] NS5A имеет две фосфорилированные формы: p56 и p58, которые отличаются электрофоретической подвижностью.[3] p56 в основном фосфорилируется протеинкиназой клетки-хозяина в центре и около С-конца, тогда как p58 представляет собой форму гиперфорилированного NS5A в центре богатой серином области.[3] Было предсказано, что N-концевые 30 аминокислотных остатков NS5A образуют амфипатическую α-спираль с хорошо сохранившимися характеристиками, которые необходимы для модуляции ассоциации между NS5A и Мембрана ER.[3][4] Сообщалось, что область, определяющая чувствительность к IFN (ISDR) на С-конце NS5A, имеет сильную транс-активирующая активность, предполагающая, что NS5A, вероятно, функционирует как активатор транскрипции.[3]
NS5A имеет три структурно различных домена: Домен I был продемонстрирован как альтернативная димерная структура кристаллография, а области II и III остались развернутыми.[1] Кроме того, конформационная гибкость NS5A играет важную роль на нескольких стадиях инфекции HCV.[1] Также возможно, что NS5A является критическим компонентом во время репликации HCV и субклеточной локализации, что может пролить свет на плохо изученный жизненный цикл HCV.[1][4] Кроме того, было показано, что NS5A модулирует полимеразную активность NS5B, РНК-зависимая РНК-полимераза (RdRp).[3] Интересно, что NS5A может быть РНК-связывающий белок потому что он может связываться с 3’UTR положительных и отрицательных цепей РНК HCV.[3] Более того, NS5A является ключевым медиатором в регуляции функции и активности клеток-хозяев при инфицировании HCV.[4] Таким образом, NS5A широко изучался в исследованиях ВГС, в том числе благодаря его способности регулировать интерферон (IFN) ответ клеток-хозяев. Поскольку NS5A оказывает функционально важные эффекты в регуляции репликации, сборки и выхода вируса, он считается потенциальной лекарственной мишенью для противовирусного терапевтического вмешательства.[1][4] Действительно, низкомолекулярные препараты, эффективно нацеленные на NS5A, показали гораздо более высокую эффективность в борьбе с инфекцией ВГС, чем другие препараты.[1] Таким образом, исследования, связанные с NS5A, будут иметь важное значение для разработки одномолекулярных лекарств и комбинированной терапии противовирусных препаратов прямого действия (DAA), не содержащих pegIFN.[1]
Как мишень для наркотиков
Много противовирусное средство препараты нацелены на NS5A, например лечить гепатит С, иногда описывается как Ингибиторы NS5A:
- Даклатасвир, Одобрение FDA 24 июля 2015 г.
- Эльбасвир, Одобрение FDA 28 января 2016 г. для генотипов 1 и 4 гепатита С.
- Ледипасвир
- МК-8408
- Одаласвир
- Омбитасвир
- Равидасвир
- Саматасвир
- Велпатасвир
Внутригенное дополнение
Множественные копии полипептида, кодируемого ген часто может образовывать агрегат, называемый мультимером. Когда мультимер образуется из полипептидов, продуцируемых двумя разными мутант аллели конкретного гена смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. Когда смешанный мультимер демонстрирует повышенную функциональность по сравнению с несмешанными мультимерами, это явление упоминается как внутригенная комплементация.
Белок NS5A является мультимером, в данном случае димером, и внутригенная комплементация аллелей NS5A, дефектных по репликации, была продемонстрирована Fridell et al.[5] На основе тестов попарной комплементации между различными мутантными аллелями NS5A они идентифицировали три группы комплементации, которые, как считалось, определяли три различных и генетически разделяемых функции NS5A в репликации РНК.
Смотрите также
Рекомендации
- ^ а б c d е ж грамм Белда, О; Таргетт-Адамс, П. (2012). «Низкомолекулярные ингибиторы белка NS5A, кодируемого вирусом гепатита С». Вирусные исследования. 170 (1–2): 1–14. Дои:10.1016 / j.virusres.2012.09.007. PMID 23009750.
- ^ а б Хуанг, Y; Сташке, К; Де Франческо, Р. Тан, SL (2007). «Фосфорилирование неструктурного белка NS5A вируса гепатита С: новая парадигма репликации вирусной РНК, зависимой от фосфорилирования?». Вирусология. 364 (1): 1–9. Дои:10.1016 / j.virol.2007.01.042. HDL:2434/662845. PMID 17400273.
- ^ а б c d е ж грамм Макдональд, А; Харрис, М. (2004). "Вирус гепатита C NS5A: рассказы о беспорядочных половых связях". Журнал общей вирусологии. 85 (Pt 9): 2485–502. Дои:10.1099 / vir.0.80204-0. PMID 15302943.
- ^ а б c d е ж Привет; Сташке, К.А.; Tan, SL; Тан, SL (2006). «HCV NS5A: многофункциональный регулятор клеточных путей и репликации вирусов». PMID 21250384. Цитировать журнал требует
| журнал =(помощь) - ^ Фриделл Р.А., Валера Л., Цю Д., Кирк М.Дж., Ван С., Гао М. Внутригенная комплементация аллелей, нарушающих репликацию РНК NS5A вируса гепатита С. J Virol. 2013; 87 (4): 2320-2329. DOI: 10.1128 / JVI.02861-12