WikiDer > Синтез пиперидона Петренко-Критченко
| Синтез пиперидона Петренко-Критченко | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Названный в честь | Павел Петренко-Критченко | ||||||||||||||
| Тип реакции | многокомпонентная кольцевая конденсация | ||||||||||||||
| Реакция | |||||||||||||||
| |||||||||||||||
| Условия | |||||||||||||||
| Типичные растворители | обычно вода или спирты при комнатной температуре | ||||||||||||||
В Петренко-Критченко реакция классический многокомпонентный-имя реакция[1] который тесно связан с Робинсоном – Шёпфом тропинон синтез, но был опубликован 12 годами ранее.
Классическая реакция
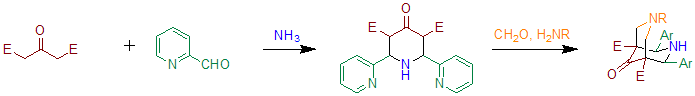
В оригинальной публикации[2] диэтил-α-кетоглурат, производное ацетонедикарбоновая кислота, используется в сочетании с аммиаком и бензальдегидом. Относительная стереохимия не была разъяснена в оригинальной публикации, структурный анализ с использованием рентгеновских лучей или ЯМР в наши дни недоступен. В отсутствие аммиака или солей аммония образуется 4-оксотетрагидропиран.[3]
В отличие от синтеза Робинсона, в нем не используются диальдегиды, такие как янтарный альдегид или же глутаральдегид но более простые альдегиды вроде бензальдегид. Следовательно, продукт реакции не является бициклической структурой (см. тропинон и псевдопеллетерин) но 4-пиперидон. Синтез тропинона можно рассматривать как разновидность реакции Петренко-Критченко, в которой две альдегидные функции ковалентно связаны в одной молекуле. Отдельно от Синтез Ганча Реакция Петренко-Критченко является одним из немногих примеров, в которых симметричный предшественник пиридина может быть получен в реакции многокомпонентной кольцевой конденсации с последующим окислением. Окисление триоксид хрома в уксусной кислоте приводит к симметрично замещенному 4-пиридону, декарбоксилирование дает 3,5-незамещенное производное.[2]
Современные варианты
Ацетоацетат можно использовать вместо диэтил-α-кетоглурата в присутствии индий соли.[4] Об использовании анилина также сообщалось в оригинальной публикации.[2] Продукт этой реакции показывает трансоидную конфигурацию фенильных групп у C-2 и C-6.
Синтез натурального продукта
Реакция была использована для приготовления преокцинеллин, алкалоид, содержащийся в некоторых божьи коровки.[1]
Приложения к координационной химии
Когда бензальдегид замещен 2-пиридинкарбоксальдегидом, реакцию можно использовать для получения предшественников биспидон-лигандов.[5] По сути, этот метод основан на двух последующих реакциях Петренко-Критченко. Эти лиганды можно использовать для получения соединений, содержащих железо с высокой валентностью, которые способны окислять циклогексан в присутствии пероксид водорода.
Рекомендации
- ^ а б Джи-Джек Ли; «Назовите реакции в химии гетероциклов»; 2005 Джон Вили и сыновья; ISBN 0-471-30215-5; pp313
- ^ а б c П. Петренко-Критченко "Убер конденсации ацетоновых углеводородов с альдегиденами, аммонийными ундами", Журнал для практической химии, том 85, выпуск 1, страницы 1–37, 20 мая 1912 г .; Дои:10.1002 / prac.19110850101
- ^ П. Петренко-Критченко "Über Tetrahydropyronverbindungen" Journal für Praktische Chemie; Том 60, выпуск 1, страницы 140–158, 27 декабря 1899 г .; Дои:10.1002 / prac.18990600114
- ^ Кларк, Пол А .; Зайцев, Андрей В .; Уитвуд, Адриан К. "Горшечный, атомный и ступенчатый экономический (PASE) синтез высоко функционализированных пиперидинов: пятикомпонентная конденсация" Tetrahedron Letters, том 48, выпуск 30, 23 июля 2007 г., страницы 5209–5212; Дои:10.1016 / j.tetlet.2007.05.141
- ^ Комба, Питер; Кершер, Марион; Мерц, Майкл; Мюллер, Вера; Прицков, Ганс; Ременьи, Райнер; Шик, Вольфганг; Xiong, Yun "Структурные изменения в соединениях биспидина переходных металлов" - Европейский журнал, том 8, выпуск 24, страницы 5750–5760, 16 декабря 2002; Дои:10.1002 / 1521-3765 (20021216) 8:24 <5750 :: AID-CHEM5750> 3.0.CO; 2-P
внешняя ссылка
- Фотография Павла Петренко-Критченко, сделанная в Казанском химическом училище в 1928 году (1-й ряд, первый слева): http://www.ksu.ru/chmku/images/30b.jpg