WikiDer > Фосфорибозилантранилат изомераза - Википедия
| фосфорибозилантранилат изомераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D-рендеринг фосфорибозилантранилат-изомеразы | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 5.3.1.24 | ||||||||
| Количество CAS | 37259-82-8 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимология, а фосфорибозилантранилат изомераза [PRAI] (ЕС 5.3.1.24) является фермент который катализирует третий шаг синтез аминокислоты триптофана.[1]
Этот фермент участвует в фенилаланин, тирозин и триптофан биосинтез путь, также известный как ароматическая аминокислота путь биосинтеза
В дрожжах это кодируется TRP1 ген.[2]
Номенклатура
Этот фермент принадлежит к семейству изомеразы, особенно те внутримолекулярные оксидоредуктазы взаимопревращение альдозы и кетоз. В систематическое название этого класса ферментов является N- (5-фосфо-бета-D-рибозил) антранилат альдозо-кетозо-изомераза. Другие широко используемые имена включают:
- PRA-изомераза,
- PRAI,
- IGPS: PRAI (индол-3-глицеринфосфат,
- синтетаза / комплекс N-5'-фосфорибозилантранилатизомеразы), и
- N- (5-фосфо-бета-D-рибозил) антранилаткетол-изомераза.
- xPRAI (мономерный вариант в Saccharmyces cerevisiae)[3]
- PRAI [ML256-452] (сконструированный вариант 1- (2-карбоксифениламино) -1-дезокси-D-рибулозо-5-фосфаткарбоксилазы: PRAI)[3]
Реакция[4]
Фосфорибозилантранилат-изомераза - один из многих ферментов в пути биосинтеза триптофана (незаменимой аминокислоты). Субстраты и промежуточные продукты восходящего * пути показаны ниже (Рис. 2).
Как видно на фиг. 3, N- (5'-фосфорибозил) антранилат с помощью этого фермента превращается в 1- (о-карбоксифениламино) -1-дезоксрибулозу 5-фосфат. Как название фосфорибозилантранилат изомераза предполагает, что он функционирует как изомераза, перестраивая части молекулы без добавления или удаления молекул или атомов.
Реакция видна в Рис. 3, представляет собой внутримолекулярную окислительно-восстановительную реакцию (окислительно-восстановительную).[5] Его первый шаг включает перенос протона. Этот промежуточный продукт, еноламин, является флуоресцентным, что полезно для кинетических исследований.
в пределах этого пути.[5] Однако этот продукт нестабилен и быстро превращается в α-амино кето.
- Примечание: вверх / вниз по потоку относятся к соединениям / молекулам, непосредственно участвующим в реакции изомеразы фосфорибозилантранилата.
Кинетика
Кинетика Михаэлиса – Ментен данные приведены в таблице ниже для PRAI и индолглицеринфосфатсинтазы (IGPS, EC 4.1.1.48).[6]
| Фермент | Температура (° C) | Км (мкМ) | kcat (1 сек) |
|---|---|---|---|
| tPRAI | 25 | 0.280 | 3.7 |
| 45 | 0.390 | 13.5 | |
| 60 | 0.730 | 38.5 | |
| 80 | 1.030 | 116.8 | |
| TIGPS | 25 | 0.006 | 0.11 |
| 45 | 0.014 | 0.75 | |
| 60 | 0.053 | 3.24 | |
| 80 | 0.123 | 15.4 |
Структура
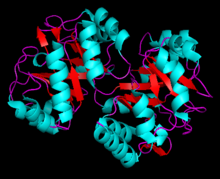
В зависимости от микроорганизма структура PRAI может варьироваться от монофункционального фермента (мономерный и лабильный) или стабильный бифункциональный димерный фермент. В Saccharomyces cerevisiae, Bacillus subtilis, Pseudomonas putida и Acinetobacter calcoaceticus фермент мономерный.[7] Напротив, в гипертермофил Thermotoga maritima, кишечная палочка (Рис. 5), Сальмонелла тифимуриум, и Aerobacter aerogenes, и Serratia marcescens, это бифункциональный фермент с индолеглицеринфосфатсинтазой в качестве парного фермента.[8]
Кристаллическая структура была охарактеризована для множества перечисленных выше микроорганизмов. Известный 2,0 А структура PRAI из Pyrococcus furiosus показывает, что tPRAI имеет ТИМ-ствол складывать (Рис. 6). PRAI получен из Термококк кодакараенсис также выражает аналогичную структуру складки TIM-ствола.[7] В подразделения tPRAI ассоциируются через N-концевые грани их центральных бета-бочки. Два длинных, связанных с симметрией петли которые взаимно выступают в полости другой субъединицы, обеспечивают множественные гидрофобный взаимодействия. Более того, боковые цепи N-терминала метионины и C-терминал лейцины обоих подразделения обездвижены в гидрофобный кластер, а количество соль мосты увеличены в tPRAI. Эти особенности, по-видимому, в основном ответственны за высокий термостойкость tPRAI.[9]
Бифункциональная версия этого фермента, выделенная из E. Coli (Рис. 5) выполняет два этапа пути триптофана. Ссылка Рис. 7, N-конец катализирует реакцию IGPS (остатки ~ 1–289 фиолетового цвета), а C-концевой домен выполняет реакцию PRAI (остатки ~ 158–452 бирюзового цвета). Хотя эти домены перекрываются (оранжевый), активные сайты не перекрываются, и исследования показали, что монофункциональные ферменты, составляющие эти два домена, по-прежнему способны продуцировать функциональный путь биосинтеза триптофана.[10]
Петли βα отвечают за активность этого фермента, а петли αβ участвуют в стабильности белка.[8]
Более подробную информацию об открытии структуры этого фермента можно найти в статье Виллманна.[11]
Активный сайт[7]
В частности, для изомеразы фосфорибозилантранилат, ТкТрпФ, от Thermococcus kodakaraensis. Активный сайт перегруппировки Амадори был определен как Cys8 (действующий как основное основание) и Asp135 (как общая кислота).[12]
Ингибиторы
An ингибитор фермента[13] представляет собой молекулу, которая связывается с ферментом, что снижает активность белка. Было показано, что следующие молекулы ингибируют активность PRAI:
Восстановленный 1- (2-карбоксифениламино) -1-дезокси-D-рибулозо-5-фосфат [5, 6,8); Фосфат индолеглицерина (8); Фосфат индолепропанола (8); MnCI2 CoCI2 [16); CuS04 (16); Больше (химически синтезированный N- (5-фосфо-бетаD-рибозил) антранилат содержит ингибиторы, но не, если он вырабатывается антранилатфосфорибозилтрансферазой)
Молекулярный вес[3]
26300 (Bacillus subtilis, гель-фильтрация)
45000 (Aeromonas formicans, Serratia marinorubra, гель-фильтрация, индол-3-
глицерин-фосфатсинтетаза / N-5'-фосфорибозилантранилат-изомераза
сложный)
46000 (E. coli, седиментационное равновесие)
47000 (Citrobacter ballerupensis, гель-фильтрация, индол-3-глицеринфосфат
синтетаза / комплекс N-5'-фосфорибозилантранилатизомеразы)
48000 (Serratia marcescens, Erwinia carotovora, гель-фильтрация, индол-3-глицеринфосфатсинтетаза / N-5'-фосфорибозилантранилат
изомеразный комплекс)
49370 (E. coli, рассчитано по последовательности гена)
53000 (Proteus vulgaris, гель-фильтрация, индол-3-глицеринфосфат синтетаза /
N-5'-фосфорибозилантранилат изомеразный комплекс)
160000 (Neurospora crassa, гель-фильтрация, компонент антранилата)
комплекс синтетазы содержит N- (5'-фосфорибозил) антранилат-изомеразу и
активности индол-3-глицеринфосфатсинтетазы)
185000 (Hansenula henricii, гель-фильтрация, индол-3-глицеринфосфатсинтетаза /
N-5'-фосфорибозилантранилат изомеразный комплекс)
Гомологичные гены
Есть гомологичный гены, которые продуцируют этот фермент у видов растений, таких как Arabidopsis thaliana и Oryza sativa (Азиатский рис). Одна из форм бактерий, в которой он обнаружен Thermotoga maritima.
Фосфорибозилантранилат-изомераза также содержится в различных формах грибов, таких как Kluyveromyces lactis (дрожжи), Saccharomyces cerevisiae (дрожжи) и Ашбья госсипии.[14]
Список генов, кодирующих PRAI, также можно найти в базе данных KEGG Enzyme.[15]
Рекомендации
- ^ Крейтон Т.Э., Янофски С. (1970). «Хоризмат триптофана (Escherichia coli) - антранилатсинтетаза, PR трансфераза, PRA-изомераза, InGP-синтетаза, триптофансинтетаза». Методы Энзимол. Методы в энзимологии. 17А: 365–380. Дои:10.1016/0076-6879(71)17215-1. ISBN 9780121818746.
- ^ "TRP1 / YDR007W Сводка". База данных генома сахаромицетов. Стэндфордский Университет.
- ^ а б c Шомбург, Дитмар; Стефан, Дёрте (1994). Справочник по ферментам. Springer-Verlag. ISBN 9783642579424. OCLC 859587801.
- ^ Люберт Страйер (2019-03-25). Биохимия. ISBN 9781319114657. OCLC 1052398743.
- ^ а б Хоммель У., Эберхард М., Киршнер К. (апрель 1995 г.). «Фосфорибозилантранилат изомераза катализирует обратимую реакцию амадори». Биохимия. 34 (16): 5429–39. Дои:10.1021 / bi00016a014. PMID 7727401.
- ^ Стернер Р., Мерц А., Тома Р., Киршнер К. (2001). «Фосфорибозилантранилат изомераза и индолеглицерин-фосфатсинтаза: ферменты биосинтеза триптофана из Thermotoga maritima». Методы в энзимологии. 331: 270–80. Дои:10.1016 / S0076-6879 (01) 31064-9. ISBN 9780121822323. PMID 11265469.
- ^ а б c Perveen, S .; Рашид, Н .; Папагеоргиу, A.C. (09.11.2016). «Фосфорибозилантранилат-изомераза из Thermococcus kodakaraensis». Дои:10.2210 / pdb5lhf / pdb. Цитировать журнал требует
| журнал =(помощь) - ^ а б Тома Р., Хенниг М., Стернер Р., Киршнер К. (март 2000 г.). «Структура и функция мутационно генерируемых мономеров димерной фосфорибозилантранилат-изомеразы из Thermotoga maritima». Структура. 8 (3): 265–76. Дои:10.1016 / s0969-2126 (00) 00106-4. PMID 10745009.
- ^ Хенниг М., Стернер Р., Киршнер К., Янсониус Дж. Н. (май 1997 г.). «Кристаллическая структура при разрешении 2,0 А фосфорибозилантранилат изомеразы из гипертермофила Thermotoga maritima: возможные детерминанты стабильности белка». Биохимия. 36 (20): 6009–16. Дои:10.1021 / bi962718q. PMID 9166771.
- ^ Эберхард М., Цай-Пфлугфельдер М., Болевска К., Хоммель Ю., Киршнер К. (апрель 1995 г.). «Индолеглицеринфосфатсинтаза-фосфорибозилантранилат-изомераза: сравнение бифункционального фермента из Escherichia coli с сконструированными монофункциональными доменами». Биохимия. 34 (16): 5419–28. Дои:10.1021 / bi00016a013. PMID 7727400.
- ^ PDB: 1ПИИ; Вильманнс М., Пристл Дж. П., Нирманн Т., Янсониус Дж. Н. (январь 1992 г.). «Трехмерная структура бифункциональной ферментной фосфорибозилантранилат-изомеразы: индолеглицеролфосфатсинтазы из Escherichia coli с разрешением 2,0 A». Журнал молекулярной биологии. 223 (2): 477–507. Дои:10.1016/0022-2836(92)90665-7. PMID 1738159.
- ^ Питт, Чарльз (2002). Саксофон, Адольф (опера). Оксфордская музыка онлайн. Издательство Оксфордского университета. Дои:10.1093 / gmo / 9781561592630.article.o006145.
- ^ «Фермент → Список ингибиторов: M», Справочник по ингибиторам ферментов, Wiley-VCH Verlag GmbH, 1999, стр.894–956, Дои:10.1002 / 9783527618330.ch13, ISBN 9783527618330
- ^ «Взрывной поиск фосфорибозилантранилат-изомеразы». База данных HomoloGene. Национальный центр биотехнологической информации.
- ^ «Фермент КЕГГ».





