WikiDer > Сульфенилхлорид
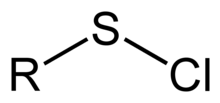
А сульфенилхлорид это функциональная группа со связностью R – S – Cl, где R - алкил[1] или же арил. Сульфенилхлориды - это реакционноспособные соединения, которые действуют как источники RS.+. Они используются при образовании связей RS – N и RS – O. В соответствии с ИЮПАК По номенклатуре их называют алкилтиогипохлоритами, т.е. сложные эфиры тиогипохлорноватистой кислоты.
Подготовка

Сульфенилхлориды обычно получают хлорирование из дисульфиды:[2][3]
- р2S2 + Cl2 → 2 RSCl
Эту реакцию иногда называют реакцией дисульфида Цинке, в знак признания Теодор Зинкке.[4][5] Обычно сульфенилгалогениды стабилизируются электроотрицательными заместителями. Эта тенденция иллюстрируется стабильностью CCl3SCl, полученный хлорированием сероуглерод.
Реакции
Перхлорметилмеркаптан (CCl3SCl) реагирует с N-H-содержащими соединениями в присутствии основания с образованием сульфенамиды:
- CCl3SCl + R2NH → CCl3SNR2 + HCl
Этот метод используется при производстве фунгицидов. Captan и Фолпет.
Сульфенилхлориды добавляют к алкенам:[6]
- CH2= CH2 + RSCl → RSCH2CH2Cl
Они проходят хлорирование к трихлоридам:[3]
- CH3SCl + Cl2 → [CH3SCl2] Cl
Сульфенилхлориды реагируют со спиртами с образованием сульфениловые эфиры, которые имеют формулу RSOR ′:[7]
- C6ЧАС5SCl + ROH → C6ЧАС5SOR + HCl
Путь к сульфинилгалогенидам
Сульфенилхлориды можно превратить в сульфинилхлориды (RS (O) Cl). В одном подходе сульфинилхлорид получают в две стадии, начиная с реакции тиол с сульфурилхлорид, ТАК
2Cl
2 В некоторых случаях вместо этого получается сульфенилхлорид, как это происходит с 2,2,2-трифтор-1,1-дифенилэтантиол. А трифторопераксусная кислота Затем окисление обеспечивает общий подход к образованию сульфинилхлоридов из сульфенилхлоридов:[8]
Родственные соединения
Также известны сульфенилбромиды.[9] Простые сульфенилиодиды неизвестны, поскольку они нестабильны по отношению к дисульфиду и йод:
- 2 RSI → (RS)2 + Я2
Сульфенилиодиды могут быть выделены как стабильные соединения, если они несут стерические алкил-защитные группы как часть каркаса в форме полости, что иллюстрирует метод кинетической стабилизации реакционноспособной функциональности, как в случае сульфеновые кислоты.[10]
Родственным классом соединений являются трихлориды алкилсеры, например трихлорид метилсеры, CH3SCl3.[11]
Соответствующие селененилгалогениды, например C6ЧАС5SeCl чаще встречаются в лаборатории. Сульфенилхлориды используются в производстве агентов, используемых в вулканизация резины.
Рекомендации
- ^ Drabowicz, J .; Kiełbasiński, P .; Łyżwa, P .; Zając, A .; Миколайчик, М. (2008). Камбе, Н. (ред.). Алкансульфенилгалогениды. Наука синтеза. 39. С. 544–550. ISBN 9781588905307.
- ^ Хубахер, Макс Х. (1943). "о-Нитрофенилсера хлорид ". Органический синтез.; Коллективный объем, 2, п. 455
- ^ а б Дуглас, Ирвин Б.; Нортон, Ричард В. (1973). «Метансульфинилхлорид». Органический синтез.; Коллективный объем, 5, стр. 709–715
- ^ Zincke, Th. (1911). "Über eine neue Reihe aromatischer Schwefelverbindungen". Chemische Berichte (на немецком). 44 (1): 769–771. Дои:10.1002 / cber.191104401109.
- ^ Zincke, Th.; Фарр, о. (1912). "Убер о-Nitrophenylschwefelchlorid und Umwandlungsprodukte ". Annalen der Chemie Юстуса Либиха (на немецком). 391 (1): 57–88. Дои:10.1002 / jlac.19123910106.
- ^ Brintzinger, H .; Лангек, М., «Synthesen mit Alkylschwefelchloriden (X. Mitteil. Über organische Schwefelchloride)», Chemische Berichte 1954, том 87, 325–330. Дои:10.1002 / cber.19540870306
- ^ Петрович, Горан; Saicic, Radomir N .; Чекович, Живорад (2005). "Фенилсульфенилирование неактивированного атома углерода фотолизом алкилбензолсульфенированного: получение 2-фенилтио-5-гептанола". Органический синтез. 81: 244. Дои:10.15227 / orgsyn.081.0244.
- ^ Page, P. C. B .; Wilkes, R.D .; Рейнольдс, Д. (1995). «Алкилхалькогениды: функциональные группы на основе серы». В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, соединенным единой связью. Комплексные органические трансформации функциональных групп. Эльзевир. стр.113–276. ISBN 9780080423234.
- ^ Reno, Daniel S .; Париза, Ричард Дж. (1998). «Фенилвинилсульфид». Органический синтез.; Коллективный объем, 9, п. 662
- ^ Sase, S .; Aoki, Y .; Abe, N .; Гото, К. (2009). «Стабильный сульфенилйодид, несущий группу первичной алкилстерической защиты с каркасом в форме полости». Письма по химии. 38 (12): 1188–1189. Дои:10.1246 / cl.2009.1188.
- ^ Браверман, С .; Черкинский, М .; Левингер, С. (2008). «Тригалогениды алкилсеры». Sci. Синтезатор. 39: 187–188. ISBN 9781588905307.
