WikiDer > Гексакарбонил вольфрама
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексакарбонил вольфрам | |
| Другие имена Карбонил вольфрама Гексакарбонилвольфрам | |
| Идентификаторы | |
3D модель (JSmol) | |
| ECHA InfoCard | 100.034.423 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C6О6W | |
| Молярная масса | 351,901 г / моль |
| Внешность | Бесцветное твердое вещество |
| Плотность | 2,65 г / см3 |
| Температура плавления | 170 ° С (338 ° F, 443 К) (разлагается) |
| нерастворимый | |
| Растворимость | экономно в THF |
| Опасности | |
| Главный опасности | Легковоспламеняющийся, источник CO |
| Родственные соединения | |
Другой катионы | Гексакарбонил хрома Гексакарбонил молибдена |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
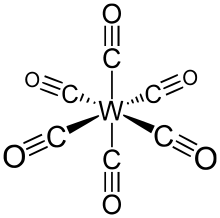
Гексакарбонил вольфрама (также называемый карбонил вольфрама) - химическое соединение с формулой W (CO)6. Этот комплекс дал начало первому примеру дигидрогенного комплекса.[1]
Это бесцветное соединение, как и его хром и молибден аналогов, примечателен как летучая, стабильная на воздухе производная вольфрам в нулевой степени окисления.
Подготовка, свойства и структура
Вт (CO)6 подготовлен снижение из WCl6 под давлением монооксид углерода. Состав относительно устойчив на воздухе. Умеренно растворим в неполярных органических растворителях. Карбонил вольфрама широко используется в электронно-лучевое осаждение техника - он легко испаряется и разлагается электронным пучком, обеспечивая удобный источник атомов вольфрама.[2]
Вт (CO)6 принимает октаэдрическая геометрия состоящий из шести стержневидных СО лиганды исходящий из центрального атома W с дипольный момент 0 D.
Реактивность
Все реакции W (CO)6 начинаются с вытеснения некоторых лигандов CO в W (CO)6. Вт (CO)6 ведет себя аналогично Mo (CO)6 но имеет тенденцию к образованию соединений, которые кинетически более устойчивы.
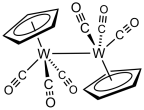
Лечение гексакарбонил вольфрама с циклопентадиенид натрия с последующим окислением образовавшегося NaW (CO)3(C5ЧАС5) дает циклопентадиенилтрикарбонилдимер вольфрама.[3]
Одна производная - это дигидрогенный комплекс Вт (CO)3[ПК6ЧАС11)3]2(ЧАС2).[1]
Три из этих лигандов CO могут быть замещены ацетонитрилом.[4]Вт (CO)6 был использован для обессеривания сероорганических соединений и в качестве предшественника катализаторов для метатезис алкенов.
Безопасность и обращение
Как и все карбонилы металлов, W (CO)6 является опасным источником летучих металлов, а также CO.
Рекомендации
- ^ а б Кубас, Дж. Дж., Металл-дигидроген и комплексы σ-связей, Kluwer Academic / Plenum Publishers: Нью-Йорк, 2001.
- ^ Randolph, S .; Fowlkes, J .; Стойка, П. (2006). «Сфокусированное наномасштабное осаждение и травление под действием электронного луча». Критические обзоры твердого тела и материаловедения. 31 (3): 55. Дои:10.1080/10408430600930438.
- ^ Manning, A.R .; Хакет, Пол; Бердвистелл, Ральф (1990). «Гексакарбонилбис (η5-Циклопентадиенил) дихром, молибден и вольфрам и их аналоги, M2(η5-C5ЧАС4Р)2(CO)6 (M = Cr, Mo и W; R = H, Me или PhCH2)". Неорганические синтезы. 28: 148–149. Дои:10.1002 / 9780470132593.ch39.
- ^ Кубас, Г. Дж .; ван дер Слейс, Л. С. (1990). «Трикарбонилтрис (нитрил) комплексы Cr, Mo и W». Неорганические синтезы. 28: 29–33. Дои:10.1002 / 9780470132593.ch6.