WikiDer > Азид-алкиновое циклоприсоединение Huisgen
| Азид-алкиновое циклоприсоединение Huisgen | |
|---|---|
| Названный в честь | Рольф Хейсген |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | хуисген-1,3-диполярное циклоприсоединение |
| RSC ID онтологии | RXNO: 0000269 |
В азид-алкиновое циклоприсоединение Huisgen это 1,3-диполярное циклоприсоединение между азид и терминал или внутренний алкин дать 1,2,3-триазол. Рольф Хейсген[1] был первым, кто понял масштаб этого органическая реакция. Американец химик Карл Барри Шарплесс упомянул об этом циклоприсоединение как «лучшие из лучших» щелкните по химии[2] и «лучший пример реакции на щелчок».[3]
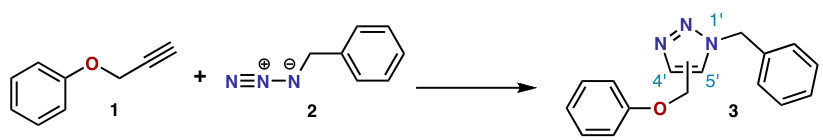
В реакции выше[4] азид 2 аккуратно реагирует с алкином 1 позволить себе триазол 3 в виде смеси 1,4-аддукта и 1,5-аддукта при 98 ° C в течение 18 часов.
Стандартное 1,3-циклоприсоединение между азид-1,3-диполем и алкеном в качестве диполярофила в значительной степени игнорировалось из-за отсутствия реакционной способности в результате бедных электронами олефинов и побочных реакций элиминирования. Определенный успех был достигнут с циклоприсоединениями, не катализируемыми металлами, такими как реакции с использованием диполярофилов, которые являются олефинами с низким содержанием электронов.[5] или алкины.
Хотя азиды не являются наиболее реакционноспособными 1,3-диполями, доступными для реакции, они предпочтительны из-за их относительного отсутствия побочных реакций и стабильности в типичных условиях синтеза.
Медный катализ
Примечательным вариантом 1,3-диполярного циклоприсоединения по Huisgen является вариант, катализируемый медью (I), который больше не является истинным согласованным циклоприсоединением, в котором органические азиды и концевые алкины объединяются с образованием 1,4-региоизомеров 1,2,3 -триазолы в качестве единственных продуктов (замещение в положениях 1 'и 4', как показано выше). Вариант, катализируемый медью (I), впервые был описан в 2002 г. в независимых публикациях Мортен Мелдал в лаборатории Carlsberg в Дании[6] Валерий Фокин и К. Барри Шарплесс в Научно-исследовательский институт Скриппса.[7]В то время как вариант, катализируемый медью (I), дает триазол из концевого алкина и азида, формально он не является 1,3-диполярным циклоприсоединением и, следовательно, не должен называться циклоприсоединением Хьюисгена. Эту реакцию лучше назвать катализируемым медью (I) азид-алкиновым циклоприсоединением (CuAAC).
Хотя реакцию можно проводить с использованием коммерческих источников меди (I), таких как бромид или йодид меди, реакция протекает намного лучше, используя смесь меди (II) (например, сульфата меди (II)) и восстановителя (например, аскорбата натрия. ) для производства Cu (I) на месте. Поскольку Cu (I) нестабилен в водных растворителях, стабилизирующие лиганды эффективны для улучшения результата реакции, особенно если трис- (бензилтриазолилметил) амин (TBTA) используется. Реакцию можно проводить в различных растворителях и смесях воды и различных (частично) смешивающихся органических растворителей, включая спирты, ДМСО, ДМФ, тBuOH и ацетон. Из-за мощной координирующей способности нитрилов по отношению к Cu (I) лучше избегать использования ацетонитрила в качестве растворителя. Исходные реагенты не обязательно должны быть полностью растворимыми для успешной реакции. Во многих случаях продукт можно просто отфильтровать из раствора, что является единственной необходимой стадией очистки.
NH-1,2,3-триазолы также получают из алкинов в последовательности, называемой Каскад Банерта.
Полезность реакции щелчка, катализируемой Cu (I), также была продемонстрирована в полимеризация реакция бис-азида и бис-алкина с медью (I) и ТБТА до сопряженный флуорен основан полимер.[8] В степень полимеризации легко превышает 50. С молекулой, такой как стопора фенилазид, четко определенный фенил конечные группы получены.
Азид-алкиновое циклоприсоединение, опосредованное медью, находит широкое применение в науках о материалах и поверхностях.[9] Было исследовано большинство вариантов сочетания полимеров с другими полимерами или небольшими молекулами. Текущие недостатки заключаются в том, что терминальный алкин, по-видимому, участвует в свободнорадикальная полимеризация. Это требует защиты терминального алкина триметилсилилом. защитная группа и последующее снятие защиты после завершения радикальной реакции. Точно так же использование органических растворителей, меди (I) и инертной атмосферы для осуществления циклоприсоединения со многими полимерами делает метку «щелчок» непригодной для таких реакций. Водный протокол для выполнения циклоприсоединения со свободнорадикальными полимерами весьма желателен.
Реакция щелчка CuAAC также эффективно связывает полистирол и бычий сывороточный альбумин (BSA).[10] В результате амфифильный биогибрид. BSA содержит тиол группа в Cys-34, который функционирует с алкин группа. В воде биогибрид мицеллы с диаметр от 30 до 70 нанометр образуют агрегаты.
Медные катализаторы
Использование Cu-катализатора в воде было улучшением по сравнению с той же реакцией, впервые популяризированной Рольфом Хейсгеном в 1970-х годах, которую он проводил при повышенных температурах.[11] Традиционная реакция протекает медленно и поэтому требует высоких температур. Однако и азиды, и алкины кинетически стабильны.
Как упоминалось выше, реакции щелчка, катализируемые медью, работают в основном с концевыми алкинами. Частицы Cu подвергаются реакции внедрения металла в концевые алкины. Части Cu (I) могут быть либо введены в виде предварительно сформированных комплексов, либо иным образом получены в самом реакционном сосуде одним из следующих способов:
- А Cu2+ соединение добавляют в реакцию в присутствии восстанавливающего агента (например, аскорбат натрия), который восстанавливает Cu из степени окисления (+2) до (+1). Преимущество получения частиц Cu (I) таким способом состоит в том, что он устраняет необходимость в основании в реакции. Также присутствие восстановителя компенсирует любой кислород, который мог попасть в систему. Кислород окисляет Cu (I) до Cu (II), что препятствует реакции и приводит к низким выходам. Одним из наиболее часто используемых соединений Cu является CuSO.4.
- Окисление металла Cu (0)
- Галогениды меди могут использоваться там, где проблема растворимости. Однако йодидные и бромидные соли меди требуют либо присутствия аминов, либо более высоких температур.
Обычно используемые растворители представляют собой полярные апротонные растворители, такие как THF, ДМСО, ацетонитрил, DMF а также в неполярных апротонных растворителях, таких как толуол. Можно использовать чистые растворители или смесь растворителей.
DIPEA (N, N-диизопропилэтиламин) и Et3N (триэтиламин) являются обычно используемыми основаниями.[12]
Механизм
Механизм реакции был предложен на основе теория функционала плотности расчеты.[13] Медь 1-й ряд переходный металл. Имеет электронную конфигурацию [Ar] 3d10 4 с1. Виды меди (I), образующиеся in situ, образуют пи комплекс с тройной связью концевого алкина. В присутствии основания концевой водород, являющийся наиболее кислотным, сначала депротонируется с образованием Cu ацетилид средний. Исследования показали, что реакция второго порядка относительно Cu. Было высказано предположение, что в переходном состоянии участвуют два атома меди.[14][15][16][17][18][19] Один атом меди связан с ацетилидом, а другой атом меди служит для активации азида. Металлический центр координируется с электронами на атоме азота. В этом случае азид и ацетилид не координированы с одним и тем же атомом Cu. Используемые лиганды лабильны и слабо координируются. Азид замещает один лиганд с образованием комплекса медь-азид-ацетилид. На этой точке циклизация происходит. Далее следует протонирование; источником протона является водород, который отводится от концевого ацетилена основанием. Продукт образуется в результате диссоциации, и комплекс катализатор-лиганд регенерируется для дальнейших циклов реакции.
Реакции способствует медь, которая при взаимодействии с ацетилидом снижает pKa алкина C-H до 9,8 единиц. Таким образом, при определенных условиях реакцию можно проводить даже в отсутствие основания.
В некаталитической реакции алкин остается плохим электрофилом. Таким образом, высокие энергетические барьеры приводят к медленной скорости реакции.[20]
Помощь лиганда
В лиганды используемые обычно лабильны, т. е. могут легко перемещаться. Хотя лиганд не играет прямой роли в реакции, присутствие лиганда имеет свои преимущества: лиганд защищает ион Cu от взаимодействий, ведущих к деградации и образованию побочных продуктов, а также предотвращает окисление частиц Cu (I) до Cu (II). Кроме того, лиганд действует как акцептор протонов, что устраняет необходимость в основании.[21]
Рутениевый катализ
В рутений-катализируемое 1,3-диполярное азид-алкиновое циклоприсоединение (RuAAC) дает 1,5-триазол. В отличие от CuAAC, в котором реагируют только концевые алкины, в RuAAC в реакции могут участвовать как концевые, так и внутренние алкины. Это говорит о том, что ацетилиды рутения не участвуют в каталитический цикл.
Предлагаемый механизм предполагает, что на первом этапе зрительские лиганды претерпевают реакцию смещения, чтобы произвести активированный комплекс который преобразуется через окислительная связь алкина и азида в рутенийсодержащий металлоцил (Ruthenacycle). Новый Связь C-N образуется между более электроотрицательным и менее стерически сложным углеродом алкина и концевым азотом азида. Промежуточный металлцикл затем подвергается восстановительному удалению с высвобождением ароматического триазольного продукта и регенерацией катализатора или активированного комплекса для дальнейших циклов реакции.
Cp*RuCl (PPh3)2, Cp*Ru (COD) и Cp*[RuCl4] обычно используются рутениевые катализаторы. Также используются катализаторы, содержащие циклопентадиенильную (Cp) группу. Однако лучшие результаты наблюдаются с пентаметилциклопентадиенилом (Cp*) версия. Это может быть связано с требованием стерильности Cp.* группа, которая способствует вытеснению зрительских лигандов.[22][23]
Серебряный катализ
Недавно сообщалось об открытии общей реакции азид-алкинового циклоприсоединения, катализируемой Ag (I), приводящей к 1,4-триазолам. Механистические особенности аналогичны общепринятому механизму процесса, катализируемого медью (I). Одной соли серебра (I) недостаточно для стимуляции циклоприсоединения. Однако лигированный источник Ag (I) оказался исключительным для реакции AgAAC.[24][25]Любопытно, что предварительно образованные ацетилиды серебра не реагируют с азидами; однако ацетилиды серебра реагируют с азидами при катализе медью (I).[26]
Рекомендации
- ^ Huisgen, R. (1961). «Столетняя лекция - 1,3-диполярные циклоприсоединения». Труды Лондонского химического общества: 357. Дои:10.1039 / PS9610000357.
- ^ Х. К. Колб, М. Г. Финн и К. Б. Шарплесс (2001). «Щелкните Химия: Разнообразная химическая функция из нескольких хороших реакций». Angewandte Chemie International Edition. 40 (11): 2004–2021. Дои:10.1002 / 1521-3773 (20010601) 40:11 <2004 :: AID-ANIE2004> 3.0.CO; 2-5. PMID 11433435.CS1 maint: использует параметр авторов (связь)
- ^ Kolb, H.C .; Шарплесс, Б. (2003). «Растущее влияние химии щелчков на открытие лекарств». Drug Discov сегодня. 8 (24): 1128–1137. Дои:10.1016 / S1359-6446 (03) 02933-7. PMID 14678739.
- ^ Разработка и применение Click Chemistry Грегори С. Паттон 8 ноября г., 2004 http://www.scs.uiuc.edu Интернет[постоянная мертвая ссылка]
- ^ Дэвид Амантини; Франческо Фрингуелли; Ориана Пьерматти; Фердинандо Пиццо; Эннио Зунино и Луиджи Ваккаро (2005). «Синтез 4-арил-1H-1,2,3-триазолов посредством катализируемого TBAF [3 + 2] циклоприсоединения 2-арил-1-нитроэтенов с TMSN3 в условиях отсутствия растворителя». Журнал органической химии. 70 (16): 6526–6529. Дои:10.1021 / jo0507845. PMID 16050724.
- ^ Кристиан В. Торнё; Каспар Кристенсен и Мортен Мелдал (2002). "Пептидотриазолы на твердой фазе: [1,2,3] -Триазолы региоспецифическими медь (I) -катализированными 1,3-диполярными циклоприсоединениями концевых алкинов к азидам". Журнал органической химии. 67 (9): 3057–3064. Дои:10.1021 / jo011148j. PMID 11975567.
- ^ Всеволод В. Ростовцев; Люк Г. Грин; Валерий В. Фокин; К. Барри Шарплесс (2002). «Поэтапный процесс циклоприсоединения Huisgen: медь (I) -катализируемое региоселективное лигирование азидов и концевых алкинов». Angewandte Chemie International Edition. 41 (14): 2596–2599. Дои:10.1002 / 1521-3773 (20020715) 41:14 <2596 :: AID-ANIE2596> 3.0.CO; 2-4. PMID 12203546.
- ^ Д. Дж. В. К. ван Стенис, О. Р. П. Давид, Г. П. Ф. ван Стрейдонк, Дж. Х. ван Маарсевен и Дж. Н. Х. Рик (2005). «Клик-химия как эффективный синтетический инструмент для получения новых сопряженных полимеров». Химические коммуникации. 34 (34): 4333–4335. Дои:10.1039 / b507776a. PMID 16113739.CS1 maint: использует параметр авторов (связь)
- ^ Р.А. Эванс (2007). «Повышение уровня азид-алкинового 1,3-диполярного« щелочного »циклоприсоединения и его применение в науке о полимерах и модификации поверхности». Австралийский химический журнал. 60 (6): 384–395. Дои:10.1071 / CH06457.
- ^ А. Дж. Диркс, С. С. ван Беркель, Н. С. Хатзакис, Дж. А. Опстен, Ф. Л. ван Делфт, Дж. Дж. Л. М. Корнелиссен, А. Э. Роуэн, Дж. К. М. ван Хест, Ф. П. Дж. Т. Рутес, Р. Дж. М. Нольте (2005). «Получение биогибридных амфифилов посредством катализируемой медью реакции диполярного циклоприсоединения Хьюисгена [3 + 2]». Химические коммуникации. 33 (33): 4172–4174. Дои:10.1039 / b508428h. PMID 16100593.CS1 maint: использует параметр авторов (связь)
- ^ 1,3-Dipolar Cycloaddition Chemistry, опубликовано Wiley и обновлено в 2002 г.
- ^ Мортен Мелдал и Кристиан Венцель Торне (2008). "Азид-алкиновое циклоприсоединение, катализируемое медью". Химические обзоры. 108 (8): 2952–3015. Дои:10.1021 / cr0783479. PMID 18698735.
- ^ F Himo; Т. Ловелл; R Hilgraf; В. В. Ростовцев; L Noodleman; КБ Шарплесс; В.В. Фокин (2005). «Катализируемый медью (I) синтез азолов, исследование методом DFT предсказывает беспрецедентную реакционную способность и промежуточные соединения». Журнал Американского химического общества. 127 (1): 210–216. Дои:10.1021 / ja0471525. PMID 15631470.
- ^ Родионов, Валентин О .; Фокин, Валерий В .; Финн, М. Г. (2005-04-08). "Механизм реакции азид-алкинового циклоприсоединения, катализируемой CuI без лиганда". Angewandte Chemie International Edition. 44 (15): 2210–2215. Дои:10.1002 / anie.200461496. ISSN 1521-3773. PMID 15693051.
- ^ Worrell, B.T .; Малик, Дж. А .; Фокин, В. В. (2013-04-26). "Прямые доказательства наличия двухядерного промежуточного соединения меди в Cu (I) -катализированных азид-алкиновых циклоприсоединениях". Наука. 340 (6131): 457–460. Bibcode:2013Наука ... 340..457Вт. Дои:10.1126 / science.1229506. ISSN 0036-8075. ЧВК 3651910. PMID 23558174.
- ^ Якобуччи, Клаудио; Реале, Саманта; Галь, Жан-Франсуа; Де Анжелис, Франческо (02.03.2015). «Двухъядерные промежуточные соединения меди в катализируемом медью (I) азид-алкиновом циклоприсоединении, непосредственно наблюдаемом с помощью масс-спектрометрии с ионизацией электрораспылением». Angewandte Chemie International Edition. 54 (10): 3065–3068. Дои:10.1002 / anie.201410301. ISSN 1521-3773. PMID 25614295.
- ^ Джин, Лицюнь; Толентино, Даниэль Р .; Мелаими, Моханд; Бертран, Гай (01.06.2015). Реакция щелчка "Выделение ключевых бис (медных) промежуточных продуктов в азид-алкиновом катализаторе Cu""". Достижения науки. 1 (5): e1500304. Bibcode:2015SciA .... 1E0304J. Дои:10.1126 / sciadv.1500304. ISSN 2375-2548. ЧВК 4640605. PMID 26601202.
- ^ Озкилыч, Йылмаз; Тюзюн, Нуркан Ş. (2016-08-22). "Исследование двухъядерной реакции CuAAC: механизм в свете новых экспериментов". Металлоорганические соединения. 35 (16): 2589–2599. Дои:10.1021 / acs.organomet.6b00279. ISSN 0276-7333.
- ^ Ziegler, Micah S .; Лакшми, К. В .; Тилли, Т. Дон (2017-04-19). «Комплексы Dicopper Cu (I) Cu (I) и Cu (I) Cu (II) в азидно-алкиновом циклоприсоединении, катализируемом медью». Журнал Американского химического общества. 139 (15): 5378–5386. Дои:10.1021 / jacs.6b13261. ISSN 0002-7863. PMID 28394586.
- ^ В. Д. Бок; Х. Хиемстра; Дж. Х. ван Маарсевен (2006). "Алкин-азид, катализируемый CuI" Щелкните "Циклоприсоединения с механической и синтетической точки зрения". Европейский журнал органической химии. 2006: 51–68. Дои:10.1002 / ejoc.200500483.
- ^ Валентин Олегович Родионов; Станислав И. Пресольский; Давид Диаз Диаз; Валерий В. Фокин и М. Г. Финн (2007). "Лиганд-ускоренное азид-алкиновое циклоприсоединение, катализируемое медью: механистический отчет". Варенье. Chem. Soc. 129 (42): 12705–12712. Дои:10.1021 / ja072679d. PMID 17914817.
- ^ Ли Чжан, Шинго Чен, Пэн Сюэ, Херман Х. Ю. Сун, Ян Д. Уильямс, К. Барри Шарплесс, Валерий В. Фокин и Гуочен Цзя (2005). «Катализируемое рутением циклоприсоединение алкинов и органических азидов». Варенье. Chem. Soc. 127 (46): 15998–15999. Дои:10.1021 / ja054114s. PMID 16287266.CS1 maint: использует параметр авторов (связь)
- ^ Брант К. Борен; Шридхар Нараян; Ларс К. Расмуссен; Ли Чжан; Хайтао Чжао; Чжэньян Линь; Гочен Цзя; Валерий Васильевич Фокин (2008). «Катализированное рутением азид-алкиновое циклоприсоединение: объем и механизм». Варенье. Chem. Soc. 130 (28): 8923–8930. Дои:10.1021 / ja0749993. PMID 18570425.
- ^ McNulty, J .; Кескар, К; Вемула Р. (2011). «Первое хорошо определенное серебро (I) -сложно-катализируемое циклоприсоединение азидов к концевым алкинам при комнатной температуре». Химия: европейский журнал. 17 (52): 14727–14730. Дои:10.1002 / chem.201103244. PMID 22125272.
- ^ McNulty, J .; Кескар, К. (2012). «Открытие надежного и эффективного гомогенного серебряного (I) катализатора для циклоприсоединения азидов к конечным алкинам». Евро. J. Org. Chem. 2012 (28): 5462–5470. Дои:10.1002 / ejoc.201200930.
- ^ Пройетти Сильвестри, И., Андемариан, Ф., Хайраллах, Г.Н., Яп, С., Квач, Т., Цегай, С., Уильямс, К.М., О'Хайр, Р.А.Дж., Доннелли, П.С., Уильямс, С.Дж. (2011). «Катализируемое медью (i) циклоприсоединение ацетилидов и азидов серебра: включение летучих ацетиленов в триазольное ядро». Органическая и биомолекулярная химия. 9 (17): 6082–6088. Дои:10.1039 / c1ob05360d. PMID 21748192.CS1 maint: использует параметр авторов (связь)