WikiDer > Дегидратаза дельта-аминолевулиновой кислоты
| порфобилиногенсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ДАЛА-дегидратаза | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.2.1.24 | ||||||||
| Количество CAS | 9036-37-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Дегидратаза дельта-аминолевулиновой кислоты | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | ALAD | ||||||
| Ген NCBI | 210 | ||||||
| HGNC | 395 | ||||||
| OMIM | 125270 | ||||||
| RefSeq | NM_001003945 | ||||||
| UniProt | P13716 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 4.2.1.24 | ||||||
| Locus | Chr. 9 q32 | ||||||
| |||||||
| ALAD | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура с высоким разрешением mg2-зависимой дегидратазы 5-аминолевулиновой кислоты | |||||||||
| Идентификаторы | |||||||||
| Символ | ALAD | ||||||||
| Pfam | PF00490 | ||||||||
| Pfam клан | CL0036 | ||||||||
| ИнтерПро | IPR001731 | ||||||||
| PROSITE | PDOC00153 | ||||||||
| SCOP2 | 1aw5 / Объем / СУПФАМ | ||||||||
| |||||||||
Дегидратаза дельта-аминолевулиновой кислоты (порфобилиногенсинтаза, или же ALA дегидратаза, или же аминолевулинатдегидратаза) является фермент (EC 4.2.1.24), который у человека кодируется ALAD ген.[5][6] Порфобилиногенсинтаза (или же ALA дегидратаза, или же аминолевулинатдегидратаза) синтезирует порфобилиноген через асимметричный конденсация из двух молекулы из аминолевулиновая кислота. Все естественно тетрапирролы, включая гемы, хлорофиллы и витамин B12, разделяют порфобилиноген как общий предшественник. Порфобилиногенсинтаза - прототип морфеин.[7]
Функция
Он катализирует следующую реакцию, вторую стадию биосинтеза порфирин:
- 2 δ-аминолевулиновая кислота порфобилиноген + 2 часа2О
Следовательно, он катализирует конденсацию 2 молекул дельта-аминолевулината с образованием порфобилиногена (предшественник гем, цитохромы и другие гемопротеины). Эта реакция - первый общий шаг в биосинтезе всех биологических тетрапирролов. Цинк необходим для ферментативной активности.
Структура
Структурная основа для аллостерическая регуляция порфобилиногенсинтазы (PBGS) является модуляцией четвертичный структурное равновесие между октамером и гексамером (через димеры), которое схематически представлено как 6мер * 2мер * ↔ 2мер ↔ 8мер. * Представляет собой переориентацию между двумя доменами каждой субъединицы, которая происходит в диссоциированном состоянии, поскольку это стерически запрещено в более крупных мультимерах.[7]
PBGS кодируется одним ген и каждый мультимер PBGS состоит из нескольких копий одного и того же белка. Каждая субъединица PBGS состоит из ~ 300 остаток αβ-бочкообразный домен, в центре которого находится активный сайт фермента, и N-концевой домен из 25 остатков. Аллостерическая регуляция PBGS может быть описана в терминах ориентации домена αβ-цилиндра по отношению к домену N-концевого плеча.
Каждое N-концевое плечо имеет до двух взаимодействий с другими субъединицами в мультимере PBGS. Одно из этих взаимодействий помогает стабилизировать «закрытый» конформация крышки активного сайта. Другое взаимодействие ограничивает доступ растворителя с другого конца αβ-цилиндра.
В неактивном мультимерном состоянии N-концевой Домен arm не участвует во взаимодействии, стабилизирующем крышку, и в кристаллической структуре неактивной сборки крышка активного центра неупорядочена.
Аллостерические регуляторы
Как почти универсальный фермент с высококонсервативным активным сайтом, PBGS не будет главной мишенью для развития противомикробные препараты и / или гербициды. Напротив, аллостерические сайты могут быть гораздо более филогенетически изменчивыми, чем активные сайты, что открывает больше возможностей для разработки лекарств.[7]
Филогенетический вариации в аллостерии PBGS приводят к обсуждению аллостерической регуляции PBGS с точки зрения внутренних и внешних факторов.
Внутренние аллостерические регуляторы
Магний
Аллостерический магний ион находится на высокогидратированной границе двух димеров про-октамеров. Оказывается, он легко диссоциирует, и было показано, что гексамеры накапливаются при удалении магния. in vitro.[8]
pH
Хотя не принято рассматривать гидроксоний ионы в качестве аллостерических регуляторов, в случае PBGS, протонирование боковой цепи в местах, отличных от активного центра, как было показано, влияет на равновесие четвертичной структуры и, таким образом, влияет также на скорость его катализируемой реакции.
Внешние аллостерические регуляторы
Стабилизация низкомолекулярного гексамера
При осмотре PBGS 6mer * обнаруживается полость на поверхности, которой нет в 8mer. Было высказано предположение, что связывание малых молекул с этой филогенетически изменчивой полостью стабилизирует 6mer * целевого PBGS и, следовательно, ингибирует активность.
Такие аллостерические регуляторы известны как морфлоки потому что они блокируют PBGS в определенной форме морфеина (6mer *).[9]
Отравление свинцом
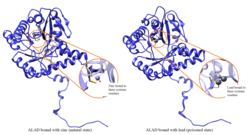
Ферментативная активность ALAD подавляется вести, начиная с уровней свинца в крови, которые когда-то считались безопасными (<10 мкг / дл), и продолжая отрицательно коррелировать в диапазоне от 5 до 95 мкг / дл.[10] Ингибирование ALAD свинцом приводит к анемия в первую очередь потому, что он подавляет синтез гема и сокращает продолжительность жизни циркулирующих красные кровяные тельца, но также стимулируя чрезмерное производство гормона эритропоэтин, что приводит к неадекватному созреванию эритроцитов от их предков. Дефект структурного гена ALAD может вызвать повышенную чувствительность к отравлению свинцом и острым заболеваниям печени. порфирия. Были идентифицированы альтернативно сплайсированные варианты транскриптов, кодирующие разные изоформы.[11]
Дефицит
Дефицит порфобилиногенсинтазы обычно приобретенный (а не наследственный) и может быть вызван: отравление тяжелыми металлами, особенно отравление свинцом, поскольку фермент очень подвержен ингибированию тяжелыми металлами.[12]
Наследственная недостаточность порфобилиногенсинтазы называется дефицит порфобилиногенсинтазы (или ALA-дегидратазы) попририя. Это крайне редкая причина порфирия,[13] было зарегистрировано менее 10 случаев.[14] Все варианты белков, ассоциированных с заболеванием, способствуют образованию гексамеров по сравнению с ферментом дикого типа человека.[13]
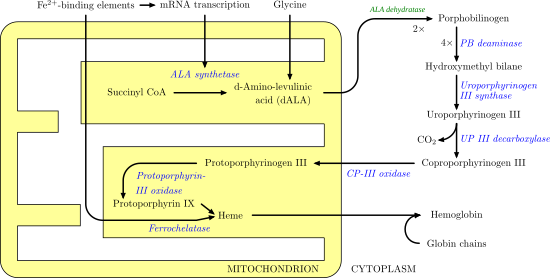 Синтез гема - обратите внимание, что некоторые реакции происходят в цитоплазма и некоторые в митохондрия (желтый) |
PBGS как прототип морфеина
Морфеиновая модель аллостерии, представленная PBGS, добавляет дополнительный уровень понимания потенциальных механизмов регуляции функции белка и дополняет повышенное внимание, которое сообщество белковых ученых уделяет динамике структуры белка.[7]
Эта модель иллюстрирует, как динамика таких явлений, как альтернативные конформации белков, меняет олигомерный состояний, и временные белок-белковые взаимодействия могут быть использованы для аллостерической регуляции каталитической активности.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000148218 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028393 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Эйберг Х., Мор Дж., Нильсен Л.С. (февраль 1983 г.). «дельта-аминолевулинатдегидраза: синтения с ABO-AK1-ORM (и отнесение к хромосоме 9)». Клиническая генетика. 23 (2): 150–4. Дои:10.1111 / j.1399-0004.1983.tb01864.x. PMID 6839527. S2CID 27267679.
- ^ Бомонт С., Фубер С., Грандшамп Б., Вейл Д., Гросс М.С., Нордманн Ю. (май 1984 г.). «Присвоение человеческого гена дельта-аминолевулинатдегидразы хромосоме 9 путем гибридизации соматических клеток и специфического иммуноферментного анализа». Анналы генетики человека. 48 (2): 153–9. Дои:10.1111 / j.1469-1809.1984.tb01010.x. PMID 6378062. S2CID 24098976.
- ^ а б c d Джаффе Е.К., Лоуренс С.Х. (март 2012 г.). «Аллостерия и динамическая олигомеризация порфобилиногенсинтазы». Архивы биохимии и биофизики. 519 (2): 144–53. Дои:10.1016 / j.abb.2011.10.010. ЧВК 3291741. PMID 22037356.
- ^ Брейниг С., Кервинен Дж., Стит Л., Уоссон А.С., Фэрман Р., Влодавер А. и др. (Сентябрь 2003 г.). «Контроль биосинтеза тетрапирролов с помощью альтернативных четвертичных форм порфобилиногенсинтазы». Структурная биология природы. 10 (9): 757–63. Дои:10.1038 / nsb963. PMID 12897770. S2CID 24188785.
- ^ Лоуренс SH, Jaffe EK (2008). «Расширение представлений о взаимосвязи структуры и функции белка и кинетике ферментов: обучение с использованием морфеинов». Биохимия и молекулярная биология образование. 36 (4): 274–283. Дои:10.1002 / bmb.20211. ЧВК 2575429. PMID 19578473.
- ^ Abadin H, Ashizawa A, Stevens YW, Llados F, Diamond G, Sage G, Citra M, Quinones A, Bosch SJ, Swarts SG (август 2007 г.). Токсикологический профиль свинца (PDF). Атланта, Джорджия: Агентство регистрации токсичных веществ и заболеваний (США). С. 22, 30. PMID 24049859. Получено 22 ноября 2015.
- ^ «Энтрез Ген: ALAD, аминолевулинат, дельта, дегидратаза».
- ^ Реакция дегидратазы ALA, от NetBiochem в Университете Юты. Последнее изменение 05.01.95
- ^ а б Джаффе Е.К., Стит Л. (февраль 2007 г.). «Порфирия АЛАД - конформационное заболевание». Американский журнал генетики человека. 80 (2): 329–37. Дои:10.1086/511444. ЧВК 1785348. PMID 17236137.
- ^ Обзор Порфирий В архиве 2011-07-22 на Wayback Machine в Консорциуме Porphyrias (часть сети клинических исследований редких заболеваний NIH (RDCRN)) Дата обращения: июнь 2011 г.
внешняя ссылка
- Человек ALAD расположение генома и ALAD страница сведений о генах в Браузер генома UCSC.
- дельта-аминолевулиновая + кислота + дегидратаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- http://www.omim.org/entry/125270?search=pbgs&highlight=pbgs
дальнейшее чтение
- Бернар А., Лауверис Р. (1988). «Металл-индуцированные изменения дегидратазы дельта-аминолевулиновой кислоты». Летопись Нью-Йоркской академии наук. 514: 41–7. Дои:10.1111 / j.1749-6632.1987.tb48759.x. PMID 3327436. S2CID 41966070.
- Jaffe EK (октябрь 2004 г.). «Механизм катализируемой порфобилиногенсинтазой реакции». Биоорганическая химия. 32 (5): 316–25. Дои:10.1016 / j.bioorg.2004.05.010. PMID 15381398.
- Роэлс Х.А., Букет Дж. П., Лауэрис Р. Р., Сонет Дж. (Август 1975 г.). «Сравнение in vivo эффекта неорганического свинца и кадмия на глутатионредуктазную систему и дельта-аминолевулинатдегидратазу в эритроцитах человека». Британский журнал промышленной медицины. 32 (3): 181–92. Дои:10.1136 / oem.32.3.181. ЧВК 1008057. PMID 1156566.
- Исида Н., Фудзита Х., Фукуда Й., Ногучи Т., Досс М., Каппас А., Сасса С. (май 1992 г.). «Клонирование и экспрессия дефектных генов от пациента с порфирии дельта-аминолевулинатдегидратазы». Журнал клинических исследований. 89 (5): 1431–7. Дои:10.1172 / JCI115732. ЧВК 443012. PMID 1569184.
- Доусон С.Дж., Уайт Л.А. (май 1992 г.). «Лечение эндокардита Haemophilus aphrophilus ципрофлоксацином». Журнал инфекции. 24 (3): 317–20. Дои:10.1016 / S0163-4453 (05) 80037-4. PMID 1602151.
- Астрин К. Х., Кая А. Х., Ветмур Дж. Г., Десник Р.Дж. (Август 1991 г.). «Полиморфизм RsaI в гене дельта-аминолевулинатдегидратазы человека в 9q34». Исследования нуклеиновых кислот. 19 (15): 4307. Дои:10.1093 / nar / 19.15.4307-а. ЧВК 328595. PMID 1678509.
- Ветмур Дж. Г., Кая А. Х., Плевинска М., Десник Р. Дж. (Октябрь 1991 г.). «Молекулярная характеристика аллеля дельта-аминолевулинатдегидратазы 2 человека (ALAD2): значение для молекулярного скрининга людей на генетическую предрасположенность к отравлению свинцом». Американский журнал генетики человека. 49 (4): 757–63. ЧВК 1683158. PMID 1716854.
- Plewinska M, Thunell S, Holmberg L, Wetmur JG, Desnick RJ (июль 1991 г.). «Порфирия с дефицитом дельта-аминолевулинатдегидратазы: идентификация молекулярных повреждений в сильно пораженной гомозиготе». Американский журнал генетики человека. 49 (1): 167–74. ЧВК 1683193. PMID 2063868.
- Потлури В. Р., Астрин К. Х., Ветмур Дж. Г., Бишоп Д. Ф., Десник Р. Дж. (Июль 1987 г.). «Дельта-аминолевулинатдегидратаза человека: хромосомная локализация в 9q34 посредством гибридизации in situ». Генетика человека. 76 (3): 236–9. Дои:10.1007 / BF00283614. PMID 3036687. S2CID 32211471.
- Гиббс П.Н., Джордан П.М. (июнь 1986 г.). «Идентификация лизина в активном центре 5-аминолаэвулинатдегидратазы человека». Биохимический журнал. 236 (2): 447–51. Дои:10.1042 / bj2360447. ЧВК 1146860. PMID 3092810.
- Ветмур Дж. Г., Бишоп Д. Ф., Кантельмо С., Десник Р. Дж. (Октябрь 1986 г.). «Человеческая дельта-аминолевулинатдегидратаза: нуклеотидная последовательность полноразмерного клона кДНК». Труды Национальной академии наук Соединенных Штатов Америки. 83 (20): 7703–7. Bibcode:1986PNAS ... 83.7703W. Дои:10.1073 / pnas.83.20.7703. ЧВК 386789. PMID 3463993.
- Ветмур Дж. Г., Епископ Д. Ф., Остасевич Л., Десник Р. Дж. (1986). «Молекулярное клонирование кДНК дельта-аминолевулинатдегидратазы человека». Ген. 43 (1–2): 123–30. Дои:10.1016/0378-1119(86)90015-6. PMID 3758678.
- Досс М., фон Типерманн Р., Шнайдер Дж. (1981). «Синдром острой печеночной порфирии с дефектом порфобилиногенсинтазы». Международный журнал биохимии. 12 (5–6): 823–6. Дои:10.1016 / 0020-711X (80) 90170-6. PMID 7450139.
- Kaya AH, Plewinska M, Wong DM, Desnick RJ, Wetmur JG (январь 1994 г.). «Ген дельта-аминолевулинатдегидратазы человека (ALAD): структура и альтернативный сплайсинг мРНК эритроида и домашнего хозяйства». Геномика. 19 (2): 242–8. Дои:10.1006 / geno.1994.1054. PMID 8188255.
- Акаги Р., Ясуи Ю., Харпер П., Сасса С. (сентябрь 1999 г.). «Новая мутация дельта-аминолаэвулинатдегидратазы у здорового ребенка с 12% ферментативной активностью эритроцитов». Британский журнал гематологии. 106 (4): 931–7. Дои:10.1046 / j.1365-2141.1999.01647.x. PMID 10519994. S2CID 24044521.
- Акаги Р., Симидзу Р., Фуруяма К., Досс МО, Сасса С. (март 2000 г.). «Новые молекулярные дефекты гена дельта-аминолевулинатдегидратазы у пациента с наследственной острой печеночной порфирией». Гепатология. 31 (3): 704–8. Дои:10.1002 / hep.510310321. PMID 10706561. S2CID 8998084.
- Кервинен Дж., Джаффе Е.К., Штауфер Ф., Нейер Р., Влодавер А., Зданов А. (июль 2001 г.). «Механистическая основа суицидальной инактивации порфобилиногенсинтазы 4,7-диоксобациновой кислотой, ингибитором, который демонстрирует поразительную видовую селективность». Биохимия. 40 (28): 8227–36. CiteSeerX 10.1.1.374.9639. Дои:10.1021 / bi010656k. PMID 11444968.