WikiDer > Дикарбоновая кислота
А дикарбоновая кислота является органическое соединение содержащий два карбоксил функциональные группы (-COOH). Генерал молекулярная формула для дикарбоновых кислот можно записать как HO2C − R − CO2H, где R может быть алифатическим или ароматическим. В целом дикарбоновые кислоты демонстрируют сходное химическое поведение и реакционную способность по отношению к монокарбоновые кислоты. Дикарбоновые кислоты также используются при приготовлении сополимеры Такие как полиамиды и полиэфиры. Наиболее широко используемая дикарбоновая кислота в промышленности - это адипиновая кислота, который является прекурсором, используемым в производстве нейлон. Другие примеры дикарбоновых кислот включают: аспарагиновая кислота и глютаминовая кислота, два аминокислоты в теле человека. Название можно сократить до двухосновная кислота.
Линейные насыщенные дикарбоновые кислоты
Общая формула HO
2C (CH
2)
пCO
2ЧАС.[1] В PubChem ссылки предоставляют доступ к дополнительной информации о соединениях, включая другие названия, идентификаторы, токсичность и безопасность.
п Распространенное имя Систематическое название ИЮПАК Структура pKа1 pKа2 PubChem 0 Щавелевая кислота этандиовая кислота 
1.27 4.27 971 1 Малоновая кислота пропандиовая кислота 
2.85 5.05 867 2 Янтарная кислота бутандиовая кислота 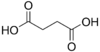
4.21 5.41 1110 3 Глутаровая кислота пентандиовая кислота 
4.34 5.41 743 4 Адипиновая кислота гександиовая кислота 
4.41 5.41 196 5 Пимелиновая кислота гептандиовая кислота 
4.50 5.43 385 6 Субериновая кислота октандиовая кислота 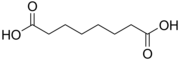
4.526 5.498 10457 7 Азелаиновая кислота нонандиовая кислота 
4.550 5.498 2266 8 Себациновая кислота декандиовая кислота 
4.720 5.450 5192 9 ундекандиовая кислота 
15816 10 додекандиовая кислота 
12736 11 Брассиловая кислота тридекандиовая кислота 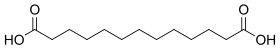
10458 14 Тапсиновая кислота гексадекандиовая кислота 10459 19 Японская кислота генейкозадионовая кислота 9543668 20 Феллогеновая кислота докозандиовая кислота 244872 28 Эквизетоловая кислота триаконтандиовая кислота 5322010
Вхождение
- Адипиновая кислота, несмотря на свое название (на латыни adipis означает жир), не является нормальным компонентом природных липидов, но является продуктом окислительная прогорклость. Впервые был получен окислением касторовое масло (рицинолевая кислота) азотной кислотой. В настоящее время его производят в промышленных масштабах путем окисления циклогексанол или же циклогексан, в основном для производства Нейлон 6-6. Он имеет несколько других промышленных применений в производстве клеи, пластификаторы, желатинизирующие агенты, гидравлические жидкости, смазочные материалы, смягчающие средства, пенополиуретан, дубление кожи, уретан, а также как подкислитель в продуктах питания.
- Пимелиновая кислота (греч. пимель, жир) также впервые был выделен из окисленного масла. Производные пимелиновой кислоты участвуют в биосинтезе лизин.
- Впервые субериновая кислота была получена путем окисления пробки азотной кислотой (лат. Suber). Эта кислота также образуется при окислении касторового масла. Субериновая кислота используется при производстве алкидные смолы и в синтезе полиамиды (нейлон варианты).
- Название азелаиновой кислоты происходит от действия азотной кислоты (азот, азот или азотная, азотная) окисления олеиновая кислота или же элаидиновая кислота. Обнаружен среди продуктов с прогорклыми жирами. Его происхождение объясняется его присутствием в плохо сохранившихся образцах льняное масло и в образцах мази, извлеченных из египетских гробниц возрастом 5000 лет. Азелаиновая кислота была получена окислением олеиновой кислоты перманганат калия, но теперь окислительным расщеплением олеиновой кислоты с хромовая кислота или озонолизом. Азелаиновая кислота используется в виде простых эфиров или сложных эфиров с разветвленной цепью) при производстве пластификаторов (для винилхлорид смолы, резина), смазки и консистентные смазки. Азелаиновая кислота сейчас используется в косметике (лечение прыщей). Обладает бактериостатическим и бактерицидный свойства против множества аэробный и анаэробные микроорганизмы присутствует на коже с акне. . Азелаиновая кислота была идентифицирована как молекула, которая накапливалась в повышенных количествах в некоторых частях растений, и было показано, что она способна повышать устойчивость растений к инфекциям.[2]
- Себациновая кислота, названная от кожного сала (жир). Тенар выделил это соединение из продуктов перегонки говяжьего жира в 1802 году. Его производят в промышленных масштабах путем деления касторового масла щелочью.[3] Себациновая кислота и ее производные находят множество промышленных применений в качестве пластификаторов, смазок, масел для диффузионных насосов, косметики, свечей и т. Д. Она также используется в синтезе полиамида, например нейлона, и алкидных смол. Изомер, изосебациновая кислота, имеет несколько применений в производстве пластификаторов виниловой смолы, экструзионных пластиков, адгезивов, сложноэфирных смазок, полиэфиров, полиуретановых смол и синтетическая резина.
- Брассиловая кислота может производиться из эруковая кислота к озонолиз но также и микроорганизмами (Candida sp.) из тридекан. Эта двухосновная кислота производится в Японии в небольших коммерческих масштабах для изготовления ароматизаторов.[4]
- Додекандиовая кислота используется в производстве нейлона (нейлон-6,12), полиамидов, покрытий, клеев, смазок, полиэфиров, красителей, моющих средств, антипиренов и ароматизаторов. Теперь он производится путем ферментации длинноцепочечных алканов определенным штаммом Candida tropicalis.[4] Травматическая кислота - ее мононенасыщенный аналог.
- Тапсиновую кислоту выделяли из сушеных корней средиземноморской «смертельной моркови», Thapsia garganica (Apiaceae).
Японский воск представляет собой смесь, содержащую триглицериды дикарбоновых кислот C21, C22 и C23, полученные из сумаховое дерево (Rhus sp.).
Большой обзор дикарбоновых кислот, присутствующих в средиземноморских орехах, выявил необычные компоненты.[5] Всего было определено 26 минорных кислот (от 2 в пекане до 8% в арахисе): 8 видов, полученных из Янтарная кислота, вероятно, в связи с фотосинтез, и 18 видов с цепочкой от 5 до 22 атомов углерода. Кислоты с более высоким весом (> C20) находятся в Суберин присутствует на растительных поверхностях (внешняя кора, корневой эпидермис). С16 по С26 a, ω-диовые кислоты считаются диагностическими для суберина. С C18: 1 и C18: 2 их содержание составляет от 24 до 45% от всего суберина. Они присутствуют в низком уровне (<5%) в растении. Cutin, кроме Arabidopsis thaliana где их содержание может быть выше 50%.[6]
Было показано, что гипертермофильный В частности, микроорганизмы содержат большое количество дикарбоновых кислот.[7]Это, наверное, самое важное отличие этих микроорганизмов от других морских бактерий. Диоевые жирные кислоты от C16 до C22 были обнаружены в гипертермофильных Археон, Pyrococcus furiosus. Коротко- и среднецепочечные (до 11 атомов углерода) двуокислоты были обнаружены в Цианобактерии рода Афанизоменон.[8]
Дикарбоновые кислоты могут образовываться путем ω-окисления жирных кислот в процессе их образования. катаболизм. Было обнаружено, что эти соединения появляются в моче после введения трикаприна и триундецилина. Хотя значение их биосинтеза остается плохо изученным, было продемонстрировано, что ω-окисление происходит в печени крысы, но с низкой скоростью, требует кислорода, НАДФН и цитохром P450. Позже было показано, что эта реакция более важна у голодающих или диабетических животных, у которых 15% пальмитиновая кислота подвергается ω-окислению, а затем tob-окислению, при этом образуется малонил-КоА который в дальнейшем используется в синтезе насыщенных жирных кислот.[9]Определение дикарбоновых кислот, образующихся при перманганат-периодатном окислении моноеновых жирных кислот, было полезно для изучения положения двойной связи в углеродной цепи.[10]
Дикарбоновые кислоты с разветвленной цепью
Длинноцепочечные дикарбоновые кислоты, содержащие вицинальный диметильное разветвление около центра углеродной цепи было обнаружено у представителей рода Бутыривибрио, бактерии, которые участвуют в переваривании клетчатки в рубце.[11] Эти жирные кислоты, названные дьявольские кислоты, имеют длину цепи в зависимости от жирной кислоты, используемой в культуральной среде. Самая распространенная диаболовая кислота в Бутыривибрио имел длину цепи из 32 атомов углерода. Дьявольские кислоты также были обнаружены в основных липидах рода Thermotoga порядка Thermotogales, бактерии, живущие в Solfatara Springs, глубоководные морские гидротермальные системы и высокотемпературные морские и континентальные нефтяные месторождения.[12] Было показано, что около 10% их липидной фракции представляют собой симметричные дьявольские кислоты от C30 до C34. Диаболовые кислоты C30 (13,14-диметилоктакозандиовая кислота) и C32 (15,16-диметилтриаконтандиовая кислота) описаны в Thermotoga maritima.[13]
Некоторые исходные двухосновные кислоты от C29 до C32, но с метильными группами на атомах углерода C-13 и C-16, были выделены и охарактеризованы из липидов термофильных анаэробных эубактерий Themanaerobacter ethanolicus.[14] Наиболее распространенной двухосновной кислотой была C30α, ω-13,16-диметилоктакозандиовая кислота.
Бифитановые двухосновные кислоты присутствуют в геологических отложениях и считаются индикаторами анаэробного окисления метана в прошлом.[15] В кайнозойских просачиваемых известняках обнаружено несколько форм без или с одним или двумя пентациклическими кольцами. Эти липиды могут быть неизвестными метаболитами архей.
Кроцетин является основным соединением кроцинов (гликозидов кроцетина), которые являются основными красными пигментами рыльц шафрана (Крокус сативус) и плоды гардении (Гардения жасминоидная). Кроцетин представляет собой дикарбоновую кислоту с 20 углеродными цепями, которая является дитерпененоидом и может рассматриваться как каротиноид. Это был первый растительный каротиноид, который был признан еще в 1818 году, а история выращивания шафрана насчитывает более 3000 лет. Главный активный ингредиент шафрана - желтый пигмент. кроцин 2 (известны три других производных с различным гликозилированием), содержащие гентиобиозную (дисахаридную) группу на каждом конце молекулы. Был разработан простой и специфический метод ВЭЖХ-УФ для количественной оценки пяти основных биологически активных ингредиентов шафрана, а именно четырех кроцинов и кроцетина.[16]
Ненасыщенные дикарбоновые кислоты
Тип Распространенное имя Название ИЮПАК Изомер Структурная формула PubChem Мононенасыщенный Малеиновая кислота (Z) -бутендиовая кислота СНГ 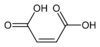
444266 Фумаровая кислота (E) -бутендиовая кислота транс 
444972 Ацетилендикарбоновая кислота Но-2-яндиовая кислота непригодный 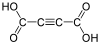
371 Глутаконовая кислота (Z) -Пент-2-ендиовая кислота СНГ 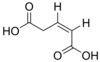
5370328 (E) -Пент-2-ендиовая кислота транс 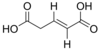
5280498 2-децендиовая кислота транс 
6442613 Травматическая кислота Додек-2-ендиовая кислота транс 
5283028 Ненасыщенный Муконовая кислота (2E, 4E) -Гекса-2,4-диендиовая кислота транс, транс 
5356793 (2Z, 4E) -Гекса-2,4-диендиовая кислота цис, транс 
280518 (2Z, 4Z) -Гекса-2,4-диендиовая кислота СНГ, СНГ 
5280518 Глютиновая кислота
(Аллен-1,3-дикарбоновая кислота)(RS) -Пента-2,3-диендиовая кислота HO2CCH = C = CHCO2ЧАС 5242834 Разветвленный Цитраконовая кислота (2Z) -2-метилбут-2-ендиовая кислота СНГ 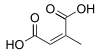
643798 Мезаконовая кислота (2E) -2-метил-2-бутендиовая кислота транс 
638129 Итаконовая кислота 2-Methylidenebutanedioic кислота – 
811
Травматическая кислота была одной из первых биологически активных молекул, выделенных из тканей растений. Было показано, что эта дикарбоновая кислота является сильнодействующим средством для заживления ран у растений, которое стимулирует деление клеток рядом с участком раны,[17]он происходит из 18: 2 или 18: 3 жирной кислоты гидропероксиды после превращения в оксо- жирные кислоты.
транс, транс-Муконовая кислота - это метаболит бензола в организме человека. Поэтому определение его концентрации в моче используется как биомаркер воздействия бензола на рабочем месте или в окружающей среде.[18][19]
Глютиновая кислота, замещенная аллен, был изолирован от Alnus glutinosa (Betulaceae).[20]
Хотя полиненасыщенные жирные кислоты необычны для кутикулы растений, о диненасыщенной дикарбоновой кислоте сообщалось как о компоненте поверхностных восков или сложных полиэфиров некоторых видов растений. Таким образом, октадека-c6, c9-диен-1,18-диоат, производное линолевая кислота, присутствует в Arabidopsis и Brassica napus кутикула.[21]
Алкилитаконаты
Несколько дикарбоновых кислот, имеющих боковую алкильную цепь и итаконатное ядро, были выделены из лишайники и грибы, итаконовая кислота (метилен янтарная кислота) - метаболит, вырабатываемый нитчатыми грибами. Среди этих соединений несколько аналогов, называемых хетомеллиновыми кислотами с разной длиной цепи и степенью ненасыщенности, были выделены из различных видов лишайников. Хетомелла. Было показано, что эти молекулы являются ценными в качестве основы для разработки противоопухолевых препаратов из-за их сильной фарнезилтрансфераза тормозящие эффекты.[22]
Серия алкил- и алкенилитаконатов, известных как церипоровая кислота (Pub Chem 52921868), были обнаружены в культурах селективного лигнин-разрушающий гриб (грибок белой гнили), Ceriporiopsis subvermispora.[23][24] Абсолютная конфигурация церипоровых кислот, их стереоселективный путь биосинтеза и разнообразие их метаболитов были подробно обсуждены.[25]
Замещенные дикарбоновые кислоты
Распространенное имя Название ИЮПАК Структурная формула PubChem Тартроновая кислота 2-гидроксипропандиовая кислота 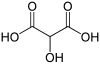
45 Мезоксалевая кислота Оксопропандиовая кислота 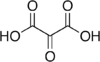
10132 Яблочная кислота Гидроксибутандиовая кислота 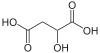
525 Винная кислота 2,3-дигидроксибутандиовая кислота 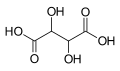
875 Щавелевоуксусная кислота Оксобутандиовая кислота 
970 Аспарагиновая кислота 2-аминобутандиовая кислота 
5960 диоксоянтарная кислота диоксобутандиовая кислота 
82062 α-гидроксиГлутаровая кислота 2-гидроксипентандиовая кислота 
43 Арабинаровая кислота 2,3,4-тригидроксипентандиовая кислота 109475 Ацетонедикарбоновая кислота 3-оксопентандиовая кислота 
68328 α-кетоглутаровая кислота 2-оксопентандиовая кислота 
51 Глютаминовая кислота 2-аминопентандиовая кислота 
611 Диаминопимелиновая кислота (2R, 6S) -2,6-диаминогептандиовая кислота 
865 Сахарная кислота (2S, 3S, 4S, 5R) -2,3,4,5-Тетрагидроксигександиовая кислота 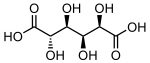
33037
Ароматические дикарбоновые кислоты
Общие имена Название ИЮПАК Структура PubChem Фталевая кислота
о-фталевая кислотаБензол-1,2-дикарбоновая кислота 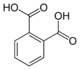
1017 Изофталевая кислота
м-фталевая кислотаБензол-1,3-дикарбоновая кислота 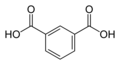
8496 Терефталевая кислота
п-фталевая кислотаБензол-1,4-дикарбоновая кислота 
7489 Дифеновая кислота
Бифенил-2,2'-дикарбоновая кислота2- (2-карбоксифенил) бензойная кислота 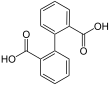
10210 2,6-нафталиндикарбоновая кислота 2,6-нафталиндикарбоновая кислота 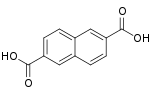
14357
Терефталевая кислота - это товарная химия используется при изготовлении полиэстер известный под торговыми марками, такими как ПЭТ, терилен, дакрон и лавсан.
Характеристики
Дикарбоновые кислоты представляют собой твердые кристаллические вещества. Растворимость в воде и температура плавления α, ω- соединений прогрессируют последовательно по мере того, как углеродные цепи становятся длиннее с чередованием нечетного и четного числа атомов углерода, так что для четного числа атомов углерода температура плавления выше, чем для следующий в серии с нечетным номером.[26] Эти соединения представляют собой слабые двухосновные кислоты с pKа стремясь к значениям ок. 4.5 и 5.5 по мере увеличения расстояния между двумя карбоксилатными группами. Так, в водном растворе при pH около 7, типичном для биологических систем, Уравнение Хендерсона – Хассельбаха указывает на то, что они существуют преимущественно в виде анионов дикарбоксилата.
Дикарбоновые кислоты, особенно маленькие и линейные, можно использовать в качестве сшивающих реагентов.[27] Дикарбоновые кислоты, в которых карбоксильные группы не разделены ни одним атомом углерода, или одним атомом углерода, разлагаются при нагревании с выделением диоксида углерода и оставляют монокарбоновую кислоту.[26]
Правило Бланка гласит, что нагревание бариевой соли дикарбоновой кислоты или ее дегидратация с помощью уксусного ангидрида дает ангидрид циклической кислоты, если атомы углерода, несущие кислотные группы, находятся в положениях 1 и (3,4 или 5). Так янтарная кислота даст янтарный ангидрид. Для кислот с карбоксильными группами в положениях 1 и 6 эта дегидратация вызывает потерю диоксида углерода и воды с образованием циклического кетона, например, образуется адипиновая кислота. циклопентанон.[26]
Производные
Что касается монофункциональных карбоновых кислот, существуют производные тех же типов. Однако существует дополнительная сложность, заключающаяся в том, что одна или две карбоксильные группы могут быть изменены. Если изменен только один, то производное называется «кислотным», а если изменяются оба конца, оно называется «нормальным». Эти производные включают соли, хлориды, сложные эфиры, амиды и ангидриды. В случае ангидридов или амидов две карбоксильные группы могут объединяться с образованием циклического соединения, например сукцинимид.[28]
Смотрите также
Рекомендации
- ^ Бой Корнилс, Питер Лаппе «Дикарбоновые кислоты, алифатические» в Энциклопедии промышленной химии Ульмана 2006, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a08_523
- ^ Юнг, Хо Вон; Чаплински, Тимоти Дж .; Ван, Линь; Глейзбрук, Джейн; Гринберг, Джин Т. (2009). «Прайминг системного иммунитета растений». Наука. 324 (3 апреля 2009 г.): 89–91. Bibcode:2009Sci ... 324 ... 89 Вт. Дои:10.1126 / science.1170025. PMID 19342588.
- ^ Кадеш, Ричард Г. (ноябрь 1954 г.). «Двухосновные кислоты». Журнал Американского общества химиков-нефтяников. 31 (11): 568–573. Дои:10.1007 / BF02638574.
- ^ а б Кроха, Кайл (сентябрь 2004 г.). «Промышленная биотехнология предоставляет возможности для промышленного производства новых длинноцепочечных двухосновных кислот». Сообщить. 15: 568–571.
- ^ Дембицкий Валерий М; Гольдшлаг, Паулина; Сребник, Моррис (апрель 2002 г.). «Встречаемость дикарбоновых (диоевых) кислот в некоторых средиземноморских орехах». Пищевая химия. 76 (4): 469–473. Дои:10.1016 / S0308-8146 (01) 00308-9.
- ^ Поллард, Майк; Бейссон, Фред; Ольрогге, Джон Б. (3 апреля 2009 г.). «Строительство липидных барьеров: биосинтез кутина и суберина». Тенденции в растениеводстве. 13 (5): 89–91. Дои:10.1016 / j.tplants.2008.03.003.
- ^ Carballeira, N.M .; Reyes, M .; Sostre, A .; Huang, H .; Verhagen, M. F .; Адамс, М. В. (2009). «Необычный состав жирных кислот гипертермофильных архей Pyrococcus furiosus и бактерии Thermotoga maritima». J. Bacteriol. 179 (8): 2766–2768. Дои:10.1128 / jb.179.8.2766-2768.1997. ЧВК 179030. PMID 9098079.
- ^ Дембицкий, В. М .; Шкроб, И .; Го, Дж. В. (2001). «Дикарбоновые и жирнокислотные составы цианобактерий рода Aphanizomenon». Биохимия (Москва). 66 (1): 72–76. Дои:10.1023 / А: 1002837830653. PMID 11240396.
- ^ Wada, F .; Усами М. (1997). «Исследования антикетогенного действия жирных кислот ω-окисления и глюконеогенности дикарбоновых кислот». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм. 487 (2): 261–268. Дои:10.1016/0005-2760(77)90002-9.
- ^ Longmuir, Kenneth J .; Росси, Мэри Э .; Резеле-Тиден, Кристина (1987). «Определение положения двойной связи моноеновой жирной кислоты перманганат-периодатным окислением с последующей высокоэффективной жидкостной хроматографией фенациловых эфиров карбоновых кислот». Аналитическая биохимия. 167 (2): 213–221. Дои:10.1016/0003-2697(87)90155-2. PMID 2831753.
- ^ Кляйн, РА; Hazlewood, GP; Кемп, П; Доусон, РМ (1 декабря 1979 г.). «Новая серия длинноцепочечных дикарбоновых кислот с вицинальным диметиловым разветвлением, обнаруженных в качестве основных компонентов липидов Butyrivibrio spp». Биохимический журнал. 183 (3): 691–700. Дои:10.1042 / bj1830691. ЧВК 1161651. PMID 540040.
- ^ Хубер, Роберт; Langworthy, Thomas A .; Кениг, Гельмут; Томм, Майкл; Woese, Carl R .; Sleytr, Uwe B .; Стеттер, Карл О. (май 1986 г.). «Thermotoga maritima sp. Nov. Представляет новый род уникальных чрезвычайно теплолюбивых эубактерий, растущих до 90 ° C». Архив микробиологии. 144 (4): 324–333. Дои:10.1007 / BF00409880.
- ^ Carballeira, NM; Рейес, М; Состре, А; Хуанг, Н; Верхаген, М.Ф .; Адамс, MW (апрель 1997 г.). «Необычный состав жирных кислот гипертермофильных архей Pyrococcus furiosus и бактерии Thermotoga maritima». Журнал бактериологии. 179 (8): 2766–8. Дои:10.1128 / jb.179.8.2766-2768.1997. ЧВК 179030. PMID 9098079.
- ^ Юнг, S; Zeikus, JG; Холлингсуорт, Род-Айленд (июнь 1994 г.). «Новое семейство очень длинноцепочечных альфа, омега-дикарбоновых кислот является основным структурным жирным ацильным компонентом мембранных липидов Thermoanaerobacter ethanolicus 39E». Журнал липидных исследований. 35 (6): 1057–65. PMID 8077844.
- ^ Биргель, Даниэль; Элверт, Маркус; Хан, Xiqiu; Пекманн, Йорн (январь 2008 г.). «Бифитановые двухосновные кислоты, обедненные 13C, как индикаторы анаэробного окисления метана в прошлом». Органическая геохимия. 39 (1): 152–156. Дои:10.1016 / j.orggeochem.2007.08.013.
- ^ Ли, На; Lin, Ge; Кван, Ю-Ва; Минь, Чжи-Да (июль 1999 г.). «Одновременное количественное определение пяти основных биологически активных ингредиентов шафрана с помощью высокоэффективной жидкостной хроматографии». Журнал хроматографии А. 849 (2): 349–355. Дои:10.1016 / S0021-9673 (99) 00600-7. PMID 10457433.
- ^ Фермер, Эдвард Э. (1994). «Передача сигналов жирных кислот в растениях и связанных с ними микроорганизмах». Молекулярная биология растений. 26 (5): 1423–1437. Дои:10.1007 / BF00016483. PMID 7858198.
- ^ Wiwanitkit V, Soogarun S, Suwansaksri J (2007). «Корреляционное исследование параметров эритроцитов и транс-муконовой кислоты в моче у субъектов с профессиональным воздействием бензола». Токсикологическая патология. 35 (2): 268–9. Дои:10.1080/01926230601156278. PMID 17366320.
- ^ Уивер В.М., Даволи С.Т., Хеллер П.Дж. и др. (1996). «Воздействие бензола, оцениваемое с помощью трансмуконовой кислоты в моче, у городских детей с повышенным уровнем свинца в крови». Environ. Перспектива здоровья. 104 (3): 318–23. Дои:10.2307/3432891. JSTOR 3432891. ЧВК 1469300. PMID 8919771.
- ^ Сати, Сушил Чандра; Сати, Нитин; Сати, О. П. (2011). «Биоактивные составляющие и лекарственное значение рода Альнус". Фармакогнозия Отзывы. 5 (10): 174–183. Дои:10.4103/0973-7847.91115. ЧВК 3263052. PMID 22279375.
- ^ Бонавентура, Густаво; Ольрогге, Джон; Поллард, Майк (2004). «Анализ алифатического мономерного состава полиэфиров, связанных с эпидермисом Arabidopsis: наличие октадека-цис-6, цис-9-диен-1,18-диоата в качестве основного компонента». Журнал растений. 40 (6): 920–930. Дои:10.1111 / j.1365-313X.2004.02258.x. PMID 15584957.
- ^ Сингх, SB; Джаясурия, H; Сильверман, KC; Бонфлио, Калифорния; Уильямсон, JM; Лингхэм, РБ (март 2000 г.). «Эффективный синтез, ингибирующая активность фарнезил-протеинтрансферазы человека и дрожжей хетомеллиновых кислот и аналогов». Биоорганическая и медицинская химия. 8 (3): 571–80. Дои:10.1016 / S0968-0896 (99) 00312-0. PMID 10732974. - через ScienceDirect (Может потребоваться подписка или контент может быть доступен в библиотеках.)
- ^ Эноки, Макико; Ватанабэ, Такаши; Хонда, Йоичи; Кувахара, Масааки (2000). «Новая флуоресцентная дикарбоновая кислота, (Z) -1,7-нонадекадиен-2,3-дикарбоновая кислота, продуцируемая грибком белой гнили Ceriporiopsis subvermispora». Письма по химии. 29 (1): 54–55. Дои:10.1246 / кл.2000.54.
- ^ Амирта, Рудианто; Фухимори, Кения; Шираи, Нобуаки; Хонда, Йоичи; Ватанабэ, Такаши (декабрь 2003 г.). «Церипоровая кислота С, гексадеценилитаконат, продуцируемый разлагающим лигнин грибком Ceriporiopsis subvermispora». Химия и физика липидов. 126 (2): 121–131. Дои:10.1016 / S0009-3084 (03) 00098-7. PMID 14623447.
- ^ Нисимура, Хироши; Мураяма, Киоко; Ватанабэ, Такахито; Хонда, Йоичи; Ватанабэ, Такаши (июнь 2009 г.). «Абсолютная конфигурация церипоровых кислот, метаболитов, подавляющих окислительно-восстановительный потенциал железа, вырабатываемых селективным разрушающим лигнин грибком Ceriporiopsis subvermispora». Химия и физика липидов. 159 (2): 77–80. Дои:10.1016 / j.chemphyslip.2009.03.006. PMID 19477313.
- ^ а б c Шмидт, Юлиус (1955). Органическая химия. Лондон: Оливер и Бойд. С. 283–284.
- ^ Могхадас, Бабак; Солоук, Атефе; Садеги, Давуд (24.08.2020). «Разработка хитозановой мембраны с использованием нетоксичных сшивающих агентов для потенциальных применений для перевязки ран». Полимерный бюллетень. Дои:10.1007 / s00289-020-03352-8. ISSN 1436-2449.
- ^ Бернтсен, А. (1922). Органическая химия. Лондон: Блэки и сын. п. 242.
внешняя ссылка
- Липидомический портал Структура База данных Дикарбоновые кислоты
- Дейкстра, Альберт Дж. «Банальные названия жирных кислот - Часть 1». lipidlibrary.aocs.org. Получено 24 июн 2019.





























