WikiDer > Малоновая кислота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Малоновая кислота | |
| Предпочтительное название IUPAC Пропандиовая кислота | |
| Другие имена Метандикарбоновая кислота | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.005.003 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C3ЧАС4О4 | |
| Молярная масса | 104.061 г · моль−1 |
| Плотность | 1,619 г / см3 |
| Температура плавления | От 135 до 137 ° C (от 275 до 279 ° F; от 408 до 410 K) (разлагается) |
| Точка кипения | разлагается |
| 763 г / л | |
| Кислотность (пKа) | pKа1 = 2.83[1] pKа2 = 5.69[1] |
| -46.3·10−6 см3/ моль | |
| Родственные соединения | |
Другой анионы | Малонат |
Связанный карбоновые кислоты | Щавелевая кислота Пропионовая кислота Янтарная кислота Фумаровая кислота |
Родственные соединения | Малоновый диальдегид Диметилмалонат |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
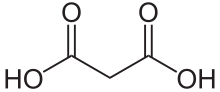
Малоновая кислота (ИЮПАК систематическое название: пропандиовая кислота) это дикарбоновая кислота со структурой CH2(COOH)2. В ионизированный форма малоновой кислоты, а также ее сложные эфиры и соли, известны как малонаты. Например, диэтилмалонат это малоновая кислота диэтил сложный эфир. Название происходит от Греческий слово μᾶλον (малон), что означает «яблоко».
История
Малоновая кислота[2] это естественное вещество, которое содержится во многих фруктах и овощах.[3] Есть предположение, что цитрусовые фрукты, произведенные в органическое земледелие содержат более высокий уровень малоновой кислоты, чем фрукты, выращиваемые в традиционном сельском хозяйстве.[4]
Малоновая кислота была впервые получена в 1858 году французским химиком. Виктор Дессен через окисление яблочная кислота.[5]
Состав и подготовка
Структура была определена рентгеновским кристаллография[6] и обширные данные о свойствах, в том числе для термохимии конденсированной фазы, доступны в Национальный институт стандартов и технологий.[7]Классический препарат малоновой кислоты начинается с хлоруксусная кислота:[8]

Карбонат натрия производит натрий соль, который затем реагирует с цианид натрия обеспечить натриевую соль цианоуксусная кислота через нуклеофильное замещение. В нитрил группа может быть гидролизованный с едкий натр до малоната натрия, а подкисление дает малоновую кислоту. Однако в промышленности малоновую кислоту получают путем гидролиза диметилмалонат или же диэтилмалонат.[9] Он также был получен путем ферментации глюкозы.[10]
Органические реакции
Малоновая кислота реагирует как типичная карбоновая кислота: образуя амид, сложный эфир, ангидрид, и хлористый производные.[11] Малоновый ангидрид может использоваться в качестве промежуточного продукта для моноэфирных или амидных производных, в то время как малонилхлорид наиболее полезен для получения диэфиров или диамидов. В известной реакции малоновая кислота конденсируется с мочевина формировать барбитуровая кислота. Малоновая кислота также может конденсироваться с ацетон формировать Кислота Мелдрама, универсальный посредник в дальнейших преобразованиях. Сложные эфиры малоновой кислоты также используются в качестве −CH2COOH синтон в синтез эфира малоновой кислоты.
Кроме того, кофермент А производное малоната, малонил-КоА, является важным предшественником в биосинтез жирных кислот вместе с ацетил-КоА. Малонил-КоА образуется из ацетил-КоА под действием ацетил-КоА карбоксилаза, а малонат переносится в белок-носитель ацила для добавления в цепь жирных кислот.
Реакция Бриггса – Раушера
Малоновая кислота - ключевой компонент в Реакция Бриггса – Раушера, классический пример колебательная химическая реакция.[12]
Конденсация Кневенагеля
В Конденсация Кневенагеля, малоновая кислота или ее диэфиры реагируют с карбонил группа альдегид или же кетон, за которым следует реакция дегидратации.
Когда используется сама малоновая кислота, это обычно происходит потому, что желаемый продукт представляет собой продукт, в котором произошла вторая стадия с потерей углекислый газ, в так называемом Модификация Добнера.[13]
Так, например, продукт реакции акролеин и малоновая кислота в пиридин является транс-2,4-пентадиеновая кислота с одной группой карбоновой кислоты, а не двумя.[14]
Приготовление недооксида углерода
Недокись углерода готовится путем разогрева сухой смеси пятиокись фосфора (п
4О
10) и малоновой кислоты.[15] Аналогично реагирует на малоновый ангидрид, образуя малонаты.[16]
Приложения
Малоновая кислота - это предшественник полиэфиры. Его можно преобразовать в 1,3-пропандиол для использования в полиэфирах и полимерах, а прогнозируемый размер рынка к 2021 году составит 621,2 миллиона долларов.[нужна цитата] Он также может быть компонентом в алкидные смолы, которые используются в ряде покрытий для защиты от повреждений, вызванных УФ-светом, окислением и коррозией. Одним из применений малоновой кислоты является промышленность покрытий в качестве сшивающего агента для порошковых покрытий, отверждаемых при низких температурах, которые становятся все более ценными для термочувствительных подложек и стремятся ускорить процесс нанесения покрытий.[17] Мировой рынок покрытий для автомобилей оценивался в 18,59 млрд долларов в 2014 году с прогнозируемыми совокупными годовыми темпами роста до 5,1% до 2022 года.[18]
Он используется в ряде производственных процессов в качестве особо ценного химического вещества, включая электроника промышленность, ароматизаторы и парфюмерия,[3] специальные растворители, сшивание полимеров и фармацевтическая промышленность. В 2004 году годовое мировое производство малоновой кислоты и связанных с ней диэфиров превышало 20 000 метрических тонн.[19] Потенциальный рост этих рынков может быть результатом достижений промышленной биотехнологии, которая стремится вытеснить химические вещества на основе нефти в промышленных приложениях.
Министерство энергетики США внесло малоновую кислоту в список 30 основных химических веществ, производимых из биомассы.[20]
В пищевых продуктах и лекарствах малоновая кислота может использоваться для контроля кислотности либо в качестве наполнителя в фармацевтическом составе, либо в качестве натуральной консервантной добавки для пищевых продуктов.[3]
Малоновая кислота используется в качестве строительного материала для производства множества ценных соединений,[21] включая ароматические и ароматические соединения гамма-ноналактон, коричная кислота, и фармацевтическое соединение вальпроат.
Малоновая кислота (до 37,5% масс.) Использовалась для сшивки кукурузного и картофельного крахмалов с целью получения биоразлагаемого термопласта; процесс осуществляется в воде с использованием нетоксичных катализаторов.[22][23] В 2014 году полимеры на основе крахмала составили 38% мирового рынка биоразлагаемых полимеров, причем пищевая упаковка, упаковка из пеноматериала и мешки для компоста являлись крупнейшими сегментами конечного использования.[24]
Eastman Компания Kodak и другие используют малоновую кислоту и ее производные в качестве хирургического клея.[25]
Биохимия
Малоновая кислота - классический пример конкурентный ингибитор из фермент сукцинатдегидрогеназа (комплекс II), в дыхательная цепь переноса электронов.[26] Он привязан к активный сайт фермента, не вступая в реакцию, конкурируя с обычным субстратом сукцинат но без -CH2CH2- группа, необходимая для дегидрирования. Это наблюдение было использовано для определения структуры активного центра сукцинатдегидрогеназы. Подавление этого фермента снижает клеточное дыхание.[27][28] Поскольку малоновая кислота является естественным компонентом многих пищевых продуктов, она присутствует у млекопитающих, включая человека.[29]
Соли и эфиры
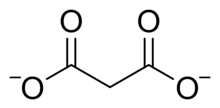
Малоновая кислота - это дипротический; то есть может пожертвовать два протоны на молекулу. Его первый составляет 2,8, а второй - 5,7.[1] Таким образом малонатный ион возможно ЧАСООCCH
2COO− или же CЧАС
2(CОO)2−
2. Малонат или пропандиоат соединения включают соли и сложные эфиры малоновой кислоты, такой как
Рекомендации
- ^ а б c Данные pKa, составленные Р. Уильямсом (pdf; 77 кБ) В архиве 2010-06-02 в Wayback Machine
- ^ Чисхолм, Хью, изд. (1911). . Британская энциклопедия. 1 (11-е изд.). Издательство Кембриджского университета. п. 146.
- ^ а б c «Пропандиовая кислота». Компания Good Scents. Получено 2020-10-07.
- ^ Duarte, A.M .; Caixeirinho, D .; Miguel, M.G .; Sustelo, V .; Nunes, C .; Fernandes, M.M .; Маррейрос, А. (2012). «Концентрация органических кислот в соке цитрусовых при традиционном и органическом земледелии». Acta Horticulturae. 933 (933): 601–606. Дои:10.17660 / actahortic.2012.933.78. HDL:10400.1/2790. ISSN 0567-7572.
- ^ Дессен (1858) "Note sur un acide obtenu par l'oxydation de l'acide malique" (Обратите внимание на кислоту, полученную окислением яблочной кислоты), Comptes rendus, 47 : 76-79.
- ^ Srinivasa Gopalan, R .; Kumaradhas, P .; Кулькарни, Г.У .; Рао, C.N.R. (2000). «Экспериментальное исследование плотности заряда алифатических дикарбоновых кислот». Журнал молекулярной структуры. 521 (1–3): 97–106. Bibcode:2000JMoSt.521 ... 97S. Дои:10.1016 / S0022-2860 (99) 00293-8.
- ^ Интернет-книга NIST по химии. «Пропандиовая кислота».
- ^ Натан Вайнер. «Малоновая кислота». Органический синтез.; Коллективный объем, 2, п. 376
- ^ Патент США 2373011, Britton, E.C. & Ezra, M., "Производство малоновой кислоты", выпущенный 1945-04-03, передан Dow Chemical Co.
- ^ Рекомбинантные клетки-хозяева для производства малоната. PCT / US2013 / 029441 2012.
- ^ Pollak, P .; Ромедер, Г., ред. (2005). «Малоновая кислота и производные». Энциклопедия химии Ван Ностранда. Дои:10.1002 / 0471740039.vec1571. ISBN 0471740039.
- ^ Csepei, L.I .; Болла, К. «Влияние салициловой кислоты на колебательную реакцию Бриггса-Раушера» (PDF). Студия УББ Химия. 1: 285–300.
- ^ Добнер, О. (1902). "Ueber die der Sorbinsäure homologen, ungesättigten Säuren mit zwei Doppelbindungen". Berichte der deutschen chemischen Gesellschaft. 35: 1136–36. Дои:10.1002 / cber.190203501187.
- ^ Питер Дж. Джессап, К. Брюс Петти, Ян Роос и Ларри Э. Оверман (1988). «1-N-Ациламино-1,3-диены из 2,4-пентадиеновых кислот перегруппировкой Курциуса: бензил-транс-1,3-бутадиен-1-карбамат». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 6, п. 95
- ^ Дильс О, Вольф Б. (1906). "Ueber das Kohlensuboxyd. I". Chem. Бер. 39: 689–697. Дои:10.1002 / cber.190603901103.
- ^ Перкс HM, Либман JF (2000). «Парадигмы и парадоксы: аспекты энергетики карбоновых кислот и их ангидридов». Структурная химия. 11 (4): 265–269. Дои:10.1023 / А: 1009270411806.
- ^ Факке Т., Субраманиан Р., Дворчак М., Фен, С. Блокированные диэтилмалонатом изоцианаты в качестве сшивающих агентов для порошковых покрытий, отверждаемых при низких температурах. 2004 Международный симпозиум по водным, высокотвердым и порошковым покрытиям.
- ^ Джеймс С. Глобальный рынок автомобильных покрытий. Отчет Grand View Research за 2015 год
- ^ «Диэфиры малоновой кислоты» (PDF). Inchem. Публикации ЮНЕП.
- ^ Верпи, Т., Петерсен, Г. Химические вещества с высокой добавленной стоимостью из биомассы. 2004 Министерство энергетики США.
- ^ Hildbrand, S .; Поллак П. Малоновая кислота и производные. 15 марта 2001 г. Энциклопедия промышленной химии Ульмана.
- ^ Нетравали А., Дастидар Т. Композиции смол сшитого нативного и восковидного крахмала и способы их производства. 2013 США. Заявление № 14 / 418,940.
- ^ Дастидар Т.Г., Нетравали А.Н., «Зеленое сшивание природных крахмалов малоновой кислотой и их свойства». Углеводные полимеры, 90: 1620-1628 (2012)
- ^ «Биоразлагаемые полимеры», Справочник по химической экономике (май 2015 г.)
- ^ Хокинс, Г., Фассетт, Д. Хирургические адгезивные композиции. Патент США 1971 г. № 3,591,676.
- ^ Парди, Артур Б .; Поттер, Ван Р. (26 октября 1948 г.). «Малонатное ингибирование окисления в цикле трикарбоновой кислоты Кребса» (PDF). Журнал биологической химии (178): 241–250. PMID 18112108. Получено 5 июн 2015.
- ^ Potter, V. R .; Дюбуа, К. П. (1943). «Исследования механизма транспорта водорода в тканях животных: VI. Исследования ингибиторов янтарной дегидрогеназы». Журнал общей физиологии. 26 (4): 391–404. Дои:10.1085 / jgp.26.4.391. ЧВК 2142566. PMID 19873352.
- ^ Дервартанян, Д.В .; Вигер, К. (1964). «Исследования сукцинатдегидрогеназы». Biochimica et Biophysica Acta (BBA) - Специализированная секция по энзимологическим вопросам. 92 (2): 233–247. Дои:10.1016/0926-6569(64)90182-8.
- ^ «Метабокард малоновой кислоты». База данных метаболома человека. 2020-03-13. Получено 2020-10-06.


