WikiDer > НАДФН оксидаза
| НАД (Ф) Н оксидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.6.3.1 | ||||||||
| Количество CAS | 77106-92-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| Ферроредуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | НАДФН оксидаза | ||||||||
| Pfam | PF01794 | ||||||||
| ИнтерПро | IPR013130 | ||||||||
| TCDB | 5.B.1 | ||||||||
| OPM суперсемейство | 464 | ||||||||
| Белок OPM | 5o05 | ||||||||
| |||||||||
НАДФН оксидаза (никотинамидадениндинуклеотидфосфатоксидаза) представляет собой мембраносвязанный фермент комплекс, обращенный во внеклеточное пространство. Его можно найти в плазматической мембране, а также в мембранах фагосомы использован нейтрофил лейкоциты для поглощения микроорганизмов. Человек изоформы каталитического компонента комплекса включают NOX1, NOX2, NOX3, NOX4, NOX5, DUOX1, и DUOX2.[1]
Реакция
НАДФН-оксидаза катализирует образование супероксид свободный радикал, передав один электрон на кислород из НАДФН. Во время этого процесса O2 транспортируется из внеклеточного пространства внутрь клетки, и H+ экспортируется.
- НАДФН + 2О2 ↔ НАДП+ + 2O2− + H+
Биологическая функция
Комплекс НАДФН-оксидазы бездействует при нормальных обстоятельствах, но активируется для сборки в мембранах во время респираторный взрыв. Активированная НАДФН-оксидаза генерирует супероксид, который играет роль в иммунном ответе животных и передаче сигналов растений.
Супероксид может производиться в фагосомы которые проглотили бактерии и грибы, или он может быть произведен вне клетки. Супероксид убивает бактерии и грибки с помощью механизмов, которые еще не полностью изучены.[2] Предполагается, что супероксид убивает бактерии напрямую, поскольку вирулентность многих патогенов резко снижается, когда их супероксиддисмутаза (SOD) гены удалены. Однако супероксид также может спонтанно образовывать перекись водорода, которая подвергается дальнейшим реакциям с образованием других активные формы кислорода (ROS) нравится хлорноватистая кислота (реактивный агент в отбеливать). Он также может инактивировать важные метаболические ферменты, инициировать перекисное окисление липидов, повреждать железо-серные кластеры,[3] и высвобождает окислительно-восстановительно-активное железо, что позволяет генерировать неизбирательные окислители, такие как гидроксильный радикал.[2]
Регулирование
Тщательное регулирование активности НАДФН-оксидазы имеет решающее значение для поддержания здорового уровня АФК в организме. Фермент бездействует в покоящихся клетках, но быстро активируется несколькими стимулами, включая бактериальные продукты и цитокины.[4] НАДФН-оксидаза сосудов регулируется множеством гормонов и факторов, которые, как известно, играют важную роль в ремоделировании сосудов и заболеваниях. К ним относятся тромбин, фактор роста тромбоцитов (PDGF), фактор некроза опухоли (TNFa), лактозилцерамид, интерлейкин-1, и окисленный ЛПНП.[5] Он также стимулируется агонистами и арахидоновая кислота.[5] И наоборот, сборка комплекса может тормозиться апоцинин и дифенилен иодоний. Апоцинин уменьшает вызванное гриппом воспаление легких у мышей in vivo и поэтому может иметь клинические преимущества при лечении гриппа.[6]
Типы
У животных НАДФН-оксидаза встречается двух типов: один в белые кровяные клетки (нейтрофильный), а другой - в сосудистый клетки, различающиеся по биохимическому строению и функциям.[7] Нейтрофильная НАДФН-оксидаза производит супероксид почти мгновенно, тогда как сосудистый фермент производит супероксид за минуты или часы.[8] Более того, в лейкоцитах супероксид переносит электроны через мембрану внеклеточному кислороду, в то время как в сосудистых клетках анион-радикал, по-видимому, высвобождается в основном внутриклеточно.[9][10]
Патология
Супероксиды имеют решающее значение в уничтожении чужеродных бактерий в организме человека. Следовательно, недостаточная активность может привести к повышенной восприимчивости к таким организмам, как каталаза-положительные микробы, а чрезмерная активность может привести к окислительный стресс и повреждение клеток.
Чрезмерное производство АФК в сосудистых клетках вызывает многие формы сердечно-сосудистых заболеваний, включая гипертония, атеросклероз, инфаркт миокарда, и ишемический приступ.[11] Атеросклероз вызывается скоплением макрофагов, содержащих холестерин (пенные ячейки) в стенках артерий (в интима). АФК, продуцируемые НАДФН-оксидазой, активируют фермент, который заставляет макрофаги прикрепляться к стенке артерии (путем полимеризации актиновых волокон). Этот процесс уравновешивается ингибиторами НАДФН-оксидазы и антиоксидантами. Дисбаланс в пользу ROS вызывает атеросклероз. Исследования in vitro показали, что ингибиторы НАДФН-оксидазы апоцинин и дифенилениодоний, наряду с антиоксидантами N-ацетил-цистеином и ресвератролом, деполимеризовали актин, разрушали спайки и позволяли пенистым клеткам мигрировать из интимы.[12][13]
Одно исследование предполагает роль НАДФН-оксидазы в кетамин-индуцированная потеря нейронов парвальбумин и GAD67 выражение.[14] Аналогичная потеря наблюдается в шизофрения, и результаты могут указывать на НАДФН-оксидазу как на возможную роль в патофизиологии заболевания.[15] Нитро синий тетразолий используется в диагностических тестах, в частности, при хронической гранулематозной болезни, заболевании, при котором имеется дефект НАДФН-оксидазы; следовательно, фагоцит не может производить активные формы кислорода или радикалы, необходимые для уничтожения бактерий, что приводит к размножению бактерий внутри фагоцита. Чем выше оценка синего, тем лучше клетка производит активные формы кислорода.
Также было показано, что НАДФН-оксидаза играет роль в механизме, который индуцирует образование sFlt-1, белок, который деактивирует определенные проангиогенные факторы, которые играют роль в развитии плаценты, способствуя образованию активные формы кислорода, которые предположительно являются посредниками в образовании sFlt-1. Эти эффекты частично ответственны за преэклампсию у беременных.[16]
Мутации
Мутации в генах субъединицы НАДФН-оксидазы вызывают несколько Хронические гранулематозные заболевания (CGD), характеризующиеся крайней восприимчивостью к инфекции.[5] К ним относятся:
- Х-сцепленная хроническая гранулематозная болезнь (CGD)
- Аутосомно-рецессивный цитохром b-отрицательный CGD
- Аутосомно-рецессивный цитохром b-положительный ХГБ типа I
- Аутосомно-рецессивный цитохром b-положительный ХГБ типа II.
При этих заболеваниях клетки обладают низкой способностью к фагоцитозу, и возникают стойкие бактериальные инфекции. Зоны инфицированных клеток обычны, гранулемы. Подобное расстройство называется синдром нейтрофильного иммунодефицита связан с мутацией в RAC2, также являющейся частью комплекса.
Торможение
НАДФН-оксидаза может подавляться апоцинин, оксид азота (НЕТ) и дифенилен иодоний. Апоцинин действует, предотвращая сборку субъединиц НАДФН-оксидазы. Апоцинин уменьшает вызванное гриппом воспаление легких у мышей in vivo и поэтому может иметь клинические преимущества при лечении гриппа.[6]
Ингибирование НАДФН-оксидазы NO блокирует источник окислительного стресса в сосудистой сети. НЕТ донорских препаратов (нитровазодилататоры) поэтому более века использовались для лечения ишемическая болезнь сердца, гипертония, и сердечная недостаточность предотвращая разрушение здоровых сосудистых клеток избытком супероксида.[7]
Более продвинутые ингибиторы НАДФН-оксидазы включают: ГКТ-831 (Ранее GKT137831), двойной ингибитор изоформ NOX4 и NOX1[17] который был запатентован в 2007 году.[18] Состав изначально разрабатывался для Идиопатический фиброз легких и получил орфанный препарат обозначение FDA и EMA в конце 2010 г.[19]
Структура
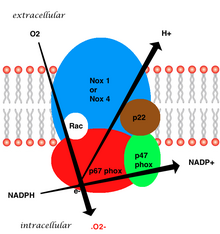
Связанный с мембраной сосудистый фермент состоит из пяти частей: двух цитозольный субъединицы (p47phox и p67phox), цитохром b558, который состоит из gp91phox, p22phox и небольшого G-белка Rac.[7] Генерация супероксида в сосудистом НАДФН происходит за счет одноэлектронного восстановления кислорода через субъединицу gp91phox с использованием восстановленного НАДФН в качестве донора электронов. Малый G-белок играет важную роль в активации оксидазы, переключаясь между GDP-связанной (неактивной) и GTP-связанной (активной) формами.[20]
Нейтрофильный тип
Изоформа, обнаруженная в нейтрофилах, состоит из шести субъединиц. Эти субъединицы:
- а Rho GTPase, обычно Rac1 или же Rac2 (Rac означает Rho-related C3 ботулинический токсин субстрат)
- Пять фагоцитарный субъединицы оксидазы:
- gp91фокс (NOX2)
- p22фокс (CYBA)
- стр. 40фокс (NCF4)
- стр. 47фокс (NCF1)
- стр67фокс (NCF2)
Тип сосудов
Существует несколько сосудистых изоформ комплекса, которые используют паралоги субъединицы NOX2:
Тип щитовидной железы
Есть еще два паралога субъединицы NOX2 в щитовидной железе:
Рекомендации
- ^ Sahoo, S .; Meijles, D. N .; Пагано, П. Дж. (2016). "НАДФН-оксидазы: ключевые модуляторы старения и возрастных сердечно-сосудистых заболеваний?". Клиническая наука. 130 (5): 317–335. Дои:10.1042 / CS20150087. ISSN 0143-5221. ЧВК 4818578. PMID 26814203.
- ^ а б Slauch JM (май 2011 г.). «Как окислительный взрыв макрофагов убивает бактерии? Все еще открытый вопрос».. Молекулярная микробиология. 80 (3): 580–3. Дои:10.1111 / j.1365-2958.2011.07612.x. ЧВК 3109634. PMID 21375590.
- ^ Джаман О., Outten FW, Imlay JA (октябрь 2004 г.). «Ремонт окисленных железо-серных кластеров в Escherichia coli». Журнал биологической химии. 279 (43): 44590–9. Дои:10.1074 / jbc.M406487200. PMID 15308657.
- ^ Geiszt M (июль 2006 г.). «НАДФН-оксидазы: новые дети на пороге». Сердечно-сосудистые исследования. 71 (2): 289–99. Дои:10.1016 / j.cardiores.2006.05.004. PMID 16765921.
- ^ а б c Griendling KK, Sorescu D, Ushio-Fukai M (март 2000 г.). «НАД (Ф) Н оксидаза: роль в сердечно-сосудистой биологии и болезнях». Циркуляционные исследования. 86 (5): 494–501. Дои:10.1161 / 01.res.86.5.494. PMID 10720409.
- ^ а б Влахос Р., Стамбас Дж., Бозиновски С., Бротон Б. Р., Драммонд Г. Р., Селемидис С. (февраль 2011 г.). «Ингибирование активности оксидазы Nox2 уменьшает воспаление легких, вызванное вирусом гриппа A». PLoS Патогены. 7 (2): e1001271. Дои:10.1371 / journal.ppat.1001271. ЧВК 3033375. PMID 21304882.
- ^ а б c Dusting GJ, Selemidis S, Jiang F (март 2005 г.). «Механизмы подавления НАДФН-оксидазы в сосудистой стенке». Memórias do Instituto Oswaldo Cruz. 100 Дополнение 1: 97–103. Дои:10.1590 / S0074-02762005000900016. PMID 15962105.
- ^ Пагано П.Дж., Чанок С.Дж., Сивик Д.А., Колуччи В.С., Кларк Дж.К. (август 1998 г.). «Ангиотензин II индуцирует экспрессию мРНК p67phox и образование супероксида НАДФН-оксидазы в адвентициальных фибробластах аорты кролика». Гипертония. 32 (2): 331–7. Дои:10.1161 / 01.hyp.32.2.331. PMID 9719063.
- ^ Griendling KK, Minieri CA, Ollerenshaw JD, Alexander RW (июнь 1994 г.). «Ангиотензин II стимулирует активность НАДН и НАДФН оксидазы в культивируемых клетках гладких мышц сосудов». Циркуляционные исследования. 74 (6): 1141–8. Дои:10.1161 / 01.res.74.6.1141. PMID 8187280.
- ^ Зафари А.М., Ушио-Фукаи М., Акерс М., Инь К., Шах А., Харрисон Д.Г., Тейлор В.Р., Гриндлинг К.К. (сентябрь 1998 г.). «Роль Н2О2, производной НАДН / НАДФН-оксидазы, в гипертрофии сосудов, вызванной ангиотензином II». Гипертония. 32 (3): 488–95. Дои:10.1161 / 01.hyp.32.3.488. PMID 9740615.
- ^ Wattanapitayakul SK, Bauer JA (февраль 2001 г.). «Окислительные пути при сердечно-сосудистых заболеваниях: роли, механизмы и терапевтические последствия». Фармакология и терапия. 89 (2): 187–206. Дои:10.1016 / S0163-7258 (00) 00114-5. PMID 11316520.
- ^ Парк Ю.М., Феббрайо М., Сильверштейн Р.Л. (2009). «CD36 модулирует миграцию макрофагов мыши и человека в ответ на окисленный ЛПНП и может способствовать улавливанию макрофагов в интиме артерий». J Clin Invest. 119: 136–45.
- ^ Curtiss LK, Clinical, Research B (2009). «Обратный атеросклероз?». N Engl J Med. 360: 1114–1116.
- ^ Беренс М.М., Али С.С., Дао Д.Н., Лусеро Дж., Шехтман Г., Квик К.Л., Дуган Л.Л. (2007). «Кетамин-индуцированная потеря фенотипа интернейронов с быстрым выбросом опосредована НАДФН-оксидазой». Наука. 318 (5856): 1645–7. Bibcode:2007Научный ... 318.1645B. Дои:10.1126 / science.1148045. PMID 18063801.
- ^ Том Фэган. Связан ли оксидативный стресс с гипотезами шизофрении по NMDA и ГАМК? В архиве 2007-12-30 на Wayback Machine Форум по исследованию шизофрении. 09 декабря 2007 г.
- ^ Хуан Ц.Т., Чжан М., Чжун М., Ю Й., Лян В.З., Ханг Л.Л., Гао Ю.Ф., Хуанг Л.П., Ван Ц.Дж. (2013). «Конечные продукты гликозилирования в качестве восходящей молекулы запускают индуцированное ROS производство sFlt-1 во вневорсинчатых трофобластах: новый мост между окислительным стрессом и преэклампсией». Плацента. 34: 1177–1182. Дои:10.1016 / j.placenta.2013.09.017.
- ^ Аояма, Томонори; Пайк, Юн-Хан; Ватанабэ, Сумио; Лале, Бенуа; Гаггини, Франческа; Фьорасо-Картье, Летиция; Моланго, Софи; Хайц, Фредди; Мерло, Седрик (01.12.2012). «Никотинамидадениндинуклеотидфосфатоксидаза при экспериментальном фиброзе печени: GKT137831 как новый потенциальный терапевтический агент». Гепатология. 56 (6): 2316–2327. Дои:10.1002 / hep.25938. ISSN 1527-3350. ЧВК 3493679. PMID 22806357.
- ^ «Эспаснет - Библиографические данные». world.espacenet.com. Получено 2017-05-04.
- ^ «FDA присвоило Genkyotex Орфанное лекарственное средство GKT137831 IPF - Genkyotex S.A.» pauahosting.co.nz. Получено 2017-05-04.[постоянная мертвая ссылка]
- ^ Heyworth PG, Knaus UG, Settleman J, Curnutte JT, Bokoch GM (ноябрь 1993 г.). «Регулирование активности НАДФН-оксидазы с помощью белков, активирующих ГТФазу Rac». Молекулярная биология клетки. 4 (11): 1217–23. Дои:10.1091 / mbc.4.11.1217. ЧВК 275755. PMID 8305740.
внешняя ссылка
- НАДФН + оксидаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- EC 1.6.3.1