WikiDer > Фосфол
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1ЧАС-Фосфол[1] | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС5п | |||
| Молярная масса | 84.058 г · моль−1 | ||
| Родственные соединения | |||
Родственные соединения | Пиррол, бисмоль, стелька, стибола | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
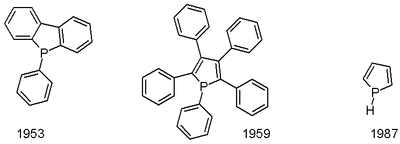
Фосфол это органическое соединение с химическая формула C4ЧАС4PH; это фосфор аналог пиррол. Термин фосфол также относится к замещенным производным исходного гетероцикл. Эти соединения представляют теоретический интерес, но также служат лиганды для переходных металлов и как предшественники более сложных фосфорорганические соединения.
Структура и склеивание
В отличие от родственных 5-членных гетероциклов пиррол, тиофен, и фуран, то ароматичность фосфора уменьшается, отражая сопротивление фосфора делокализовать его одинокая пара.[2] Основным признаком этой разницы является пирамидизация фосфора. На отсутствие ароматичности также указывает реакционная способность фосфол.[3] Фосфолы подвергаются различным реакциям циклоприсоединения, координационные свойства фосфолов также хорошо изучены.[4].
Подготовка
Материнский фосфол был впервые описан в 1983 году. Он был получен путем низкотемпературного протонирования фосфолида лития.[5] О пентафенилфосфоле сообщили в 1953 году.[6] Один путь к фосфолам - через Маккормак реакция, включающий добавление 1,3-диен к фосфонному хлориду (RPCl2) с последующим дегидрогалогенирование.[7] Фенилфосфолы могут быть получены через цирконциклопентадиены реакцией с PhPCl2.[8]
Реактивность
Поведение вторичных фосфолов со связью P-H определяется реакционной способностью этой группы.[5] Родительский фосфол легко перестраивается путем миграции H от P к углероду-2 с последующей димеризацией.
Большинство фосфолов являются третичными, обычно Р-метил или Р-фенил. Неароматичность этих фосфолов проявляется в их реакционной способности, но связи P-C остаются нетронутыми. Например, они проходят Реакции Дильса-Альдера с электрофильный алкины. Они являются основными в P, выступая в качестве лигандов.[5]
2,5-Дифенилфосфолы могут быть функционализированы депротонированием с последующим Р-ацилированием, а затем равновесием 1H, 2H, 3H фосфолидов, что приводит к сдвигу ацильной группы 1: 3.[9]Фосфолы также могут быть превращены в β-функциональные фосфабензолы (фосфинины или фосфор) через функционализацию имидоилхлорид и прошивка.[10]
Смотрите также
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 146. Дои:10.1039/9781849733069-00130. ISBN 978-0-85404-182-4.
- ^ Д. Б. Чеснут; Л. Д. Куин (2007). «Важная роль неподеленной пары фосфора в ароматичности фосфора». Химия гетероатомов. 18: 754. Дои:10.1002 / hc.20364.
- ^ Филип Хинденберг; Карлос Ромеро-Ньето (2016). «Фосфафенален: эволюция гетероциклов фосфора». Synlett. 27: 2293–2300. Дои:10.1055 / с-0035-1562506.
- ^ Алмаз Загидуллин; Василий Александрович Милуйков (2013). «Фосфолы - развитие и последние достижения». Mendeleev Communications. 23: 117–130. Дои:10.1016 / j.mencom.2013.05.001.
- ^ а б c Клод Шаррье; Юбер Боннар; Гийом де Лозон; Франсуа Мэти (1983). «Протонные [1,5] сдвиги в P-незамещенных 1H-фосфолах. Синтез и химия димеров 2H-фосфолов». Варенье. Chem. Soc. 105: 6871–6877. Дои:10.1021 / ja00361a022.
- ^ Руководство по фосфорорганической химии Луи Д. Куин 2000 Джон Уайли и сыновья ISBN 0-471-31824-8
- ^ У. Б. Маккормак (1973). «3-метил-1-фенилфосфоленоксид». Органический синтез.; Коллективный объем, 5, п. 787
- ^ Пол Дж. Фэган и Уильям А. Нуджент (1998). «1-Фенил-2,3,4,5-Тетраметилфосфол». Органический синтез.; Коллективный объем, 9, п. 653
- ^ Магали Клошар; Джоанна Гранди; Бруно Доннадье и Франсуа Мэти (2005). «Непосредственный синтез 3-ацилфосфолов». Органические буквы. 7 (20): 4511–4513. Дои:10.1021 / ol051816d. PMID 16178571.
- ^ Гранди, Дж. И Мэти, Ф. (2005). «Преобразование фосфолидных ионов в β-функциональные фосфинины в одном горшке». Angewandte Chemie International Edition. 44: 1082–1084. Дои:10.1002 / anie.200462020. PMID 15662672.