WikiDer > Биомаркер рака
А биомаркер рака относится к веществу или процессу, которые указывают на присутствие рак в организме. А биомаркер может быть молекулой, секретируемой опухоль или специфическая реакция организма на наличие рака. Генетический,[1] эпигенетический,[2] протеомный,[3] гликомический,[4] биомаркеры визуализации могут быть использованы для диагностики рака, прогноза и эпидемиологии. В идеале такие биомаркеры можно анализировать в биологических жидкостях, собранных неинвазивным способом, таких как кровь или сыворотка.[5]
Несмотря на то, что существуют многочисленные проблемы при внедрении исследований биомаркеров в клиническую практику; номер ген и белок биомаркеры на основе биомаркеров уже использовались на определенном этапе лечения пациентов; включая, AFP (Рак печени), BCR-ABL (Хронический миелоидный лейкоз), BRCA1 / BRCA2 (Грудь/Рак яичников), BRAF V600E (Меланома/Колоректальный рак), CA-125 (Рак яичников), CA19.9 (Панкреатический рак), CEA (Колоректальный рак), EGFR (Немелкоклеточный рак легкого), HER-2 (Рак молочной железы), КОМПЛЕКТ (Опухоль стромы желудочно-кишечного тракта), PSA (Специфический антиген простаты) (Рак простаты), S100 (Меланома) и многие другие.[6][7][8][9][10][11][12][13][14][15] Сами мутантные белки обнаруживаются Мониторинг выбранных реакций (SRM) сообщалось, что они являются наиболее специфическими биомаркерами рака, поскольку они могут исходить только от существующей опухоли.[16] Около 40% случаев рака можно вылечить, если своевременно обнаружить их при обследовании.[17]
Определения биомаркеров рака
Организации и публикации различаются по определению биомаркер. Во многих областях медицины биомаркеры ограничены белки идентифицировать или измерить в кровь или же моча. Однако этот термин часто используется для обозначения любых молекулярных, биохимических, физиологических или анатомических свойств, которые можно количественно определить или измерить.
В Национальный институт рака (NCI), в частности, определяет биомаркер как: «Биологическая молекула, обнаруженная в крови, других жидкостях организма или тканях, которая является признаком нормального или ненормального процесса, состояния или заболевания. Биомаркер можно использовать, чтобы увидеть, насколько хорошо организм реагирует на лечение заболевания или состояния. Также называется молекулярным маркером и сигнатурной молекулой ». [18]
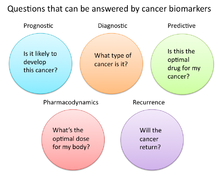
В исследованиях рака и медицине биомаркеры используются тремя основными способами:[19]
- Для помощи в диагностике состояний, как в случае выявления рака на ранней стадии (Диагностика)
- Прогнозировать, насколько агрессивным является состояние, например, в случае определения способности пациента жить без лечения (Прогноз)
- Предсказать, насколько хорошо пациент ответит на лечение (Прогнозирующий)
Роль биомаркеров в исследованиях рака и медицине
Использование биомаркеров в медицине рака
Оценка рисков
Биомаркеры рака, особенно связанные с генетическими мутации или же эпигенетический изменения, часто предлагают количественный способ определить, когда люди предрасположены к определенным типам рака. Известные примеры потенциально предсказательных биомаркеров рака включают мутации в генах. KRAS, p53, EGFR, erbB2 за колоректальный, пищеводный, печень, и панкреатический рак; мутации генов BRCA1 и BRCA2 за грудь и яичник рак; аномальный метилирование из гены-супрессоры опухолей p16, CDKN2B, и p14ARF за рак мозга; гиперметилирование MYOD1, CDH1, и CDH13 за рак шейки матки; и гиперметилирование p16, стр. 14, и RB1, за рак ротовой полости.[20]
Диагностика
Биомаркеры рака также могут быть полезны при постановке конкретного диагноза. Это особенно актуально, когда необходимо определить, являются ли опухоли начальный или же метастатический источник. Чтобы сделать это различие, исследователи могут проверить хромосомный изменения, обнаруженные в клетках, расположенных в первичном очаге опухоли, по сравнению с клетками вторичного очага. Если изменения совпадают, вторичная опухоль может быть идентифицирована как метастатическая; тогда как, если изменения различаются, вторичная опухоль может быть идентифицирована как отдельная первичная опухоль.[21] Например, люди с опухолями имеют высокий уровень циркулирующей опухолевой ДНК (цтДНК) из-за опухолевых клеток, прошедших апоптоз.[22] Этот онкомаркер можно обнаружить в крови, слюне или моче.[17] Возможность выявления эффективного биомаркера для ранней диагностики рака недавно была поставлена под сомнение в свете высокой молекулярной гетерогенности опухолей, наблюдаемой в исследованиях секвенирования следующего поколения.[23]
Прогноз и прогнозы лечения
Еще одно применение биомаркеров в онкологической медицине - лечение болезней. прогноз, которые происходят после того, как у человека был диагностирован рак. Здесь биомаркеры могут быть полезны для определения агрессивности выявленного рака, а также его вероятности ответа на данное лечение. Частично это связано с тем, что опухоли, демонстрирующие определенные биомаркеры, могут реагировать на лечение, связанное с экспрессией или присутствием этого биомаркера. Примеры таких прогностических биомаркеров включают повышенные уровни ингибитор металлопептидазы 1 (TIMP1), маркер, связанный с более агрессивными формами множественная миелома,[24] повышенный рецептор эстрогена (ER) и / или рецептор прогестерона (PR) экспрессия, маркеры, связанные с лучшей общей выживаемостью у пациентов с раком груди;[25][26] HER2 / neu амплификация гена, маркер, указывающий на рак груди, скорее всего, отреагирует на трастузумаб лечение;[27][28] мутация в экзоне 11 протоонкоген c-KIT, маркер, указывающий опухоль стромы желудочно-кишечного тракта (GIST) скорее всего ответит на иматиниб лечение;[29][30] и мутации в тирозинкиназа домен EGFR1, маркер, указывающий на немелкоклеточная карцинома легкого (НМРЛ) скорее всего ответит на гефитиниб или же эрлотиниб лечение.[31][32]
Фармакодинамика и фармакокинетика
Биомаркеры рака также можно использовать для определения наиболее эффективного режима лечения рака конкретного человека.[33] Из-за различий в генетическом составе каждого человека некоторые люди по-разному метаболизируют или изменяют химическую структуру лекарств. В некоторых случаях снижение метаболизма некоторых лекарств может создать опасные условия, при которых в организме накапливается высокий уровень этого лекарства. Таким образом, при принятии решения о дозировке лекарств при лечении рака может быть полезен скрининг таких биомаркеров. Примером может служить ген, кодирующий фермент тиопуринметилтрансфераза (TPMPT).[34] Лица с мутациями в гене TPMT не могут метаболизировать большие количества лейкемия препарат, средство, медикамент, меркаптопурин, что может привести к фатальному падению белая кровь рассчитывать на таких пациентов. Таким образом, пациентам с мутациями TPMT рекомендуется назначать более низкую дозу меркаптопурина из соображений безопасности.[35]
Контроль ответа на лечение
Биомаркеры рака также показали свою полезность в мониторинге эффективности лечения с течением времени. В этой конкретной области проводится много исследований, поскольку успешные биомаркеры могут обеспечить значительное снижение затрат на лечение пациентов, поскольку современные тесты на основе изображений, такие как КТ и МРТ для мониторинга состояния опухоли, очень дороги.[36]
Одним из примечательных биомаркеров, привлекающих значительное внимание, является белок биомаркер S100-бета в мониторинге реакции злокачественных меланома. В таких меланомах меланоциты, клетки, которые производят пигмент в нашей коже, производят белок S100-бета в высоких концентрациях, зависящих от количества раковых клеток. Таким образом, ответ на лечение связан со снижением уровня S100-бета в крови таких людей.[37][38]
Точно так же дополнительные лабораторные исследования показали, что опухолевые клетки подвергаются апоптоз может высвобождать клеточные компоненты, такие как цитохром с, нуклеосомы, расколотый цитокератин-18, и E-кадгерин. Исследования показали, что эти и другие макромолекулы могут быть в обращении во время лечения рака, что является потенциальным источником клинических показателей для мониторинга лечения.[36]
Повторение
Биомаркеры рака также могут быть полезны для прогнозирования или мониторинга рака. повторение. В Онкотип DX® анализ рака молочной железы является одним из таких тестов, используемых для прогнозирования вероятности рецидива рака молочной железы. Этот тест предназначен для женщин с ранняя стадия (Стадия I или II), узел-отрицательный, рецептор эстрогена-положительный (ER +) инвазивный рак груди, который будет лечить гормональная терапия. Oncotype DX рассматривает панель из 21 гена в клетках, взятых во время опухоли биопсия. Результаты теста представлены в форме оценки рецидивов, которая указывает на вероятность рецидива через 10 лет.[39][40]
Использование биомаркеров в исследованиях рака
Разработка мишеней для лекарств
Помимо использования в медицине рака, биомаркеры часто используются на протяжении всего процесса разработки лекарств от рака. Например, в 1960-х годах исследователи обнаружили у большинства пациентов с хронический миелолейкоз обладал определенной генетической аномалией на хромосомы 9 и 22 дублировали Филадельфийская хромосома. Когда эти две хромосомы объединяются, они создают вызывающий рак ген, известный как BCR-ABL. У таких пациентов этот ген действует как основная начальная точка всех физиологических проявлений лейкемии. В течение многих лет BCR-ABL просто использовался как биомаркер для стратификации определенного подтипа лейкемии. Однако в конечном итоге разработчики лекарств смогли разработать иматиниб, мощное лекарство, которое эффективно ингибирует этот белок и значительно снижает продукцию клеток, содержащих филадельфийскую хромосому.[41][42]
Суррогатные конечные точки
Еще одна перспективная область применения биомаркеров - это суррогатные конечные точки. В этом приложении биомаркеры выступают в качестве замены эффектов лекарственного средства на прогрессирование рака и выживаемость. В идеале использование проверенных биомаркеров предотвратит развитие опухоли у пациентов. биопсия и продолжительный клинические испытания чтобы определить, подействовал ли новый препарат. В текущем стандарте лечения метрика для определения эффективности лекарства состоит в том, чтобы проверить, снизило ли оно прогрессирование рака у людей и, в конечном итоге, продлит ли оно выживаемость. Однако успешные суррогаты биомаркеров могут значительно сэкономить время, усилия и деньги, если некачественные препараты можно будет исключить из процесса разработки до того, как они попадут на клинические испытания.
Некоторые идеальные характеристики биомаркеров суррогатных конечных точек включают:[43][44]
- Биомаркер должен участвовать в процессе, вызывающем рак.
- Изменения биомаркера должны коррелировать с изменениями в заболевании.
- Уровни биомаркеров должны быть достаточно высокими, чтобы их можно было легко и надежно измерить.
- Уровни или наличие биомаркера должны легко различать нормальную, злокачественную и предраковую ткань.
- Эффективное лечение рака должно изменить уровень биомаркера.
- Уровень биомаркера не должен изменяться спонтанно или в ответ на другие факторы, не связанные с успешным лечением рака.
В частности, в качестве суррогатных маркеров уделяется внимание двум областям: циркулирующие опухолевые клетки (ЦКО)[45][46] и распространение миРНК.[47][48] Оба эти маркера связаны с количеством опухоль клетки, присутствующие в крови, и как таковые, как предполагается, будут заменять прогрессирование опухоли и метастаз. Однако существенные препятствия на пути их принятия включают сложность обогащения, идентификации и измерения уровней CTC и miRNA в крови. Для их внедрения в клиническую практику, вероятно, потребуются новые технологии и исследования.[49][50][51]
Типы биомаркеров рака
Биомаркеры молекулярного рака
| Тип опухоли | Биомаркер |
|---|---|
| Грудь | ER/PR (рецептор эстрогена / рецептор прогестерона)[52][53] |
| HER-2 / neu [52][53] | |
| Колоректальный | EGFR [52][53] |
| KRAS [52][54] | |
| UGT1A1 [52][54] | |
| Желудочный | HER-2 / neu [52] |
| СУТЬ | c-KIT [52][55] |
| Лейкемия / лимфома | CD20 [52][56] |
| CD30 [52][57] | |
| FIP1L1-PDGFRalpha [52][58] | |
| PDGFR [52][59] | |
| Филадельфийская хромосома (BCR/ABL) [52][60][61] | |
| PML/RAR-альфа [52][62] | |
| TPMT [52][63] | |
| UGT1A1 [52][64] | |
| Легкое | EML4/ALK [52][65][66] |
| EGFR [52][53] | |
| KRAS [52][53] | |
| Меланома | BRAF [52][66] |
| Поджелудочная железа | Повышенные уровни лейцин, изолейцин и валин[67] |
| Яичники | CA-125[68] |
Другие примеры биомаркеров:
- Подавители опухолей, утраченные при раке
- РНК
- Белки, содержащиеся в жидкостях или тканях организма.
- Примеры: Простатоспецифический антиген, и CA-125
- Антитела к раковым антигенам
- Примеры: Полиомавирус клеток Меркеля[70]
- ДНК
Биомаркеры рака без специфики
Не все биомаркеры рака должны быть специфичными для разных типов рака. Некоторые биомаркеры, обнаруженные в системе кровообращения, можно использовать для определения аномального роста клеток, присутствующих в организме. Все эти типы биомаркеров можно определить с помощью диагностических анализов крови, что является одной из основных причин, по которым нужно регулярно проходить тестирование на здоровье. Регулярно проходя анализы, многие проблемы со здоровьем, такие как рак, могут быть обнаружены на ранней стадии, что предотвращает многие смерти.
Было показано, что отношение нейтрофилов к лимфоцитам является неспецифическим определяющим фактором для многих видов рака. Это соотношение фокусируется на активности двух компонентов иммунной системы, которые участвуют в воспалительной реакции, которая, как было показано, выше при наличии злокачественных опухолей.[71] Кроме того, основной фактор роста фибробластов (bFGF) - это белок, участвующий в пролиферации клеток. К сожалению, было показано, что при наличии опухолей он очень активен, что привело к выводу, что он может способствовать более быстрому размножению злокачественных клеток.[72] Исследования показали, что антитела против bFGF могут использоваться для лечения опухолей различного происхождения.[72] Более того, инсулиноподобный фактор роста (IGF-R) участвует в пролиферации и росте клеток. Возможно, он участвует в подавлении апоптоза, запрограммированной гибели клеток из-за какого-либо дефекта.[73] Благодаря этому уровни IGF-R могут быть увеличены при наличии рака груди, простаты, легких и толстой кишки.[74]
| Биомаркер | Описание | Используемый биосенсор |
|---|---|---|
| NLR (отношение нейтрофилов к лимфоцитам) | Снимает воспаление, вызванное раком[75] | Нет |
| Базовый фактор роста фибробластов (bFGF) | Этот уровень увеличивается при наличии опухоли, помогает быстрому размножению опухолевых клеток.[76] | Электрохимический[77] |
| Инсулиноподобный фактор роста (IGF-R) | Высокая активность в раковых клетках, способствует размножению[78] | Датчик спектроскопии электрохимического импеданса[нужна цитата] |
Смотрите также
Рекомендации
- ^ Кальцоне, Кэтлин А. (2012). «Генетические биомаркеры риска рака». Семинары по сестринскому делу онкологии. 28 (2): 122–128. Дои:10.1016 / j.soncn.2012.03.007. PMID 22542320.
- ^ Герцег, Зденко; Эно, Пьер (01.06.2007). «Генетические и эпигенетические изменения как биомаркеры для обнаружения, диагностики и прогноза рака». Молекулярная онкология. 1 (1): 26–41. Дои:10.1016 / j.molonc.2007.01.004. ISSN 1878-0261. ЧВК 5543860. PMID 19383285.
- ^ Ли, Данни; Чан, Дэниел В. (2014-04-01). «Протеомные биомаркеры рака от открытия до утверждения: это того стоит». Экспертный обзор протеомики. 11 (2): 135–136. Дои:10.1586/14789450.2014.897614. ISSN 1478-9450. ЧВК 4079106. PMID 24646122.
- ^ Aizpurua-Olaizola, O .; Тораньо, Х. Састре; Falcon-Perez, J.M .; Уильямс, С .; Reichardt, N .; Бунс, Г.-Дж. (2018). «Масс-спектрометрия для открытия гликановых биомаркеров». Тенденции TrAC в аналитической химии. 100: 7–14. Дои:10.1016 / j.trac.2017.12.015.
- ^ Мишра, Алок; Верма, Мукеш (2010). «Биомаркеры рака: готовы ли мы к лучшему?». Рак. 2 (1): 190–208. Дои:10.3390 / раки2010190. ЧВК 3827599. PMID 24281040.
- ^ Рея, Жанна; Росс Дж. Молинаро (март 2011 г.). «Биомаркеры рака: пережить путь от скамейки к постели». Наблюдатель в медицинской лаборатории. Архивировано из оригинал 14 октября 2013 г.. Получено 26 апреля 2013.
- ^ Бене, Тара; Копур, М. Ситки (1 января 2012 г.). «Биомаркеры гепатоцеллюлярной карциномы». Международный журнал гепатологии. 2012: 859076. Дои:10.1155/2012/859076. ЧВК 3357951. PMID 22655201.
- ^ Мусолино, А; Белла, Массачусетс; Бортеси, Б; Michiara, M; Нальди, N; Zanelli, P; Капеллетти, М; Пеццуоло, D; Camisa, R; Сави, М; Нери, ТМ; Ардиццони, А (июнь 2007 г.). «Мутации BRCA, молекулярные маркеры и клинические переменные при раннем начале рака груди: популяционное исследование». Грудь. 16 (3): 280–92. Дои:10.1016 / j.breast.2006.12.003. PMID 17257844.
- ^ Динстманн, Р. Табернеро, Дж. (Март 2011 г.). «BRAF как мишень для лечения рака». Противораковые средства в медицинской химии. 11 (3): 285–95. Дои:10.2174/187152011795347469. PMID 21426297.
- ^ Лампарелла, N; Барохия, А; Альмокадем, С (2013). Влияние генетических маркеров на лечение немелкоклеточного рака легкого. Достижения экспериментальной медицины и биологии. 779. С. 145–64. Дои:10.1007/978-1-4614-6176-0_6. ISBN 978-1-4614-6175-3. PMID 23288638.
- ^ Орфанос, G; Контоуракис, П. (2012). «Нацеленность на рецептор HER2 при метастатическом раке груди». Гематология / Онкология и терапия стволовыми клетками. 5 (3): 127–37. Дои:10.5144/1658-3876.2012.127. PMID 23095788.
- ^ DePrimo, S.E .; Хуанг, X .; Blackstein, M.E .; Garrett, C.R .; Harmon, C. S .; Schoffski, P .; Shah, M. H .; Verweij, J .; Baum, C.M .; Деметри, Г. Д. (8 сентября 2009 г.). «Уровни циркуляции растворимого KIT служат биомаркером для клинических результатов у пациентов с желудочно-кишечными стромальными опухолями, получающих сунитиниб после неэффективности иматиниба». Клинические исследования рака. 15 (18): 5869–5877. Дои:10.1158 / 1078-0432.CCR-08-2480. ЧВК 3500590. PMID 19737953.
- ^ Бантис, А; Grammaticos, P (сентябрь – декабрь 2012 г.). «Простатический специфический антиген и сканирование костей в диагностике и последующем наблюдении рака простаты. Можно ли повысить диагностическое значение ПСА?». Греческий журнал ядерной медицины. 15 (3): 241–6. PMID 23227460.
- ^ Kruijff, S; Хукстра, HJ (апрель 2012 г.). «Текущее состояние S-100B как биомаркера меланомы». Европейский журнал хирургической онкологии. 38 (4): 281–5. Дои:10.1016 / j.ejso.2011.12.005. PMID 22240030.
- ^ Ludwig, JA; Вайнштейн, Дж. Н. (ноябрь 2005 г.). «Биомаркеры для определения стадии рака, прогноза и выбора лечения». Обзоры природы Рак. 5 (11): 845–56. Дои:10.1038 / nrc1739. PMID 16239904.
- ^ Ван, Цин; Рагхотама Чаркади (декабрь 2010 г.). «Мутантные белки как биомаркеры рака». Труды Национальной академии наук. 108 (6): 2444–2449. Bibcode:2011PNAS..108.2444W. Дои:10.1073 / pnas.1019203108. ЧВК 3038743. PMID 21248225.
- ^ а б c Ли, Сюаньинг; Е, Менша; Чжан, Вэйин; Тан, Дуэт; Яффрезич-Рено, Николь; Ян, Сюй; Го, Чжэньчжун (01.02.2019). «Жидкая биопсия циркулирующей опухолевой ДНК и биосенсорные приложения». Биосенсоры и биоэлектроника. 126: 596–607. Дои:10.1016 / j.bios.2018.11.037. ISSN 0956-5663. PMID 30502682.
- ^ «биомаркер». Словарь терминов NCI по раку. Национальный институт рака. 2011-02-02.
- ^ «Биомаркеры рака: вводное руководство для адвокатов» (PDF). Сеть пропаганды исследований. 2010. Архивировано с оригинал (PDF) в 2013-10-29. Получено 26 апреля 2013.
- ^ Верма, М; Манн, Ю (октябрь 2006 г.). «Генетические и эпигенетические биомаркеры в диагностике рака и выявлении групп высокого риска». Критические обзоры в онкологии / гематологии. 60 (1): 9–18. Дои:10.1016 / j.critrevonc.2006.04.002. PMID 16829121.
- ^ Леонг, ПП; Резаи, Б; Кох, WM; Рид, А; Eisele, D; Ли, диджей; Сидранский, Д; Jen, J; Вестра, штат Вашингтон (1 июля 1998 г.). «Отличие вторых первичных опухолей от метастазов в легких у пациентов с плоскоклеточным раком головы и шеи». Журнал Национального института рака. 90 (13): 972–7. Дои:10.1093 / jnci / 90.13.972. PMID 9665144.
- ^ Лапин, Мортен; Олтедал, Сату; Тьенсволл, Кьерсти; Буль, Тове; Smaaland, Руна; Гарресори, Хериш; Явле, Милинд; Гленен, Нильс Идар; Абельсет, Бенте Кристин; Гилье, Бьёрнар; Нордгард, Оддмунд (6 ноября 2018 г.). «Размер фрагмента и уровень внеклеточной ДНК обеспечивают прогностическую информацию у пациентов с распространенным раком поджелудочной железы». Журнал трансляционной медицины. 16 (1): 300. Дои:10.1186 / s12967-018-1677-2. ISSN 1479-5876. ЧВК 6218961. PMID 30400802.
- ^ Драгани, Т.А.; Матарезе, V; Коломбо, Ф (2020). «Биомаркеры для ранней диагностики рака: перспективы успеха через призму опухолевой генетики». BioEssays. 42 (4): e1900122. Дои:10.1002 / bies.201900122. PMID 32128843.
- ^ Терпос Э., Димопулос М.А., Шривастава В. и др. (Март 2010 г.). «Высокий уровень сывороточного ТИМП-1 коррелирует с запущенным заболеванием и предсказывает плохую выживаемость у пациентов с множественной миеломой, получавших новые препараты». Исследование лейкемии. 34 (3): 399–402. Дои:10.1016 / j.leukres.2009.08.035. PMID 19781774.
- ^ Куукасярви, Т; Кононен, Дж; Helin, H; Холли, К; Изола, Дж. (Сентябрь 1996 г.). «Потеря рецептора эстрогена при рецидивирующем раке груди связана с плохим ответом на эндокринную терапию». Журнал клинической онкологии. 14 (9): 2584–9. Дои:10.1200 / jco.1996.14.9.2584. PMID 8823339.
- ^ Харрис, L; Fritsche, H; Mennel, R; Нортон, L; Равдин, П; Таубе, S; Сомерфилд, MR; Hayes, DF; Bast RC, Jr; Американское общество клинической онкологии (20 ноября 2007 г.). «Американское общество клинической онкологии, обновленное в 2007 г., рекомендации по использованию онкомаркеров при раке груди». Журнал клинической онкологии. 25 (33): 5287–312. Дои:10.1200 / JCO.2007.14.2364. PMID 17954709.
- ^ Kröger, N; Milde-Langosch, K; Ритдорф, S; Schmoor, C; Шумахер, М; Зандер, АР; Лёнинг, Т. (1 января 2006 г.). «Прогностические и прогностические эффекты иммуногистохимических факторов у пациентов с первичным раком молочной железы высокого риска». Клинические исследования рака. 12 (1): 159–68. Дои:10.1158 / 1078-0432.CCR-05-1340. PMID 16397038.
- ^ Врбич, S; Пейчич, я; Филипович, S; Кочич, Б; Врбич, М. (январь – март 2013 г.). «Текущая и будущая терапия против HER2 при раке груди». Журнал Балканского союза онкологов. 18 (1): 4–16. PMID 23613383.
- ^ Yoo, C; Рю, MH; Ryoo, BY; Бек, MY; Канг, YK (17 апреля 2013 г.). «Эффективность, безопасность и фармакокинетика увеличения дозы иматиниба до 800 мг / день у пациентов с распространенными опухолями стромы желудочно-кишечного тракта». Новые исследуемые препараты. 31 (5): 1367–74. Дои:10.1007 / s10637-013-9961-8. PMID 23591629.
- ^ Деметри, Г.Д .; van Oosterom, AT; Гарретт, CR; Blackstein, ME; Шах, MH; Verweij, J; McArthur, G; Джадсон, IR; Генрих, MC; Morgan, JA; Desai, J; Флетчер, CD; Джордж, S; Bello, CL; Хуанг, X; Баум, СМ; Casali, PG (14 октября 2006 г.). «Эффективность и безопасность сунитиниба у пациентов с запущенной стромальной опухолью желудочно-кишечного тракта после неэффективности иматиниба: рандомизированное контролируемое исследование». Ланцет. 368 (9544): 1329–38. Дои:10.1016 / S0140-6736 (06) 69446-4. PMID 17046465.
- ^ Herbst, RS; Prager, D; Hermann, R; Ференбахер, Л; Джонсон, BE; Сандлер, А; Крис, MG; Тран, HT; Klein, P; Ли, Х; Ramies, D; Джонсон, DH; Миллер, Вирджиния; Исследовательская группа TRIBUTE (1 сентября 2005 г.). «TRIBUTE: фаза III испытания гидрохлорида эрлотиниба (OSI-774) в сочетании с химиотерапией карбоплатином и паклитакселом при запущенном немелкоклеточном раке легкого». Журнал клинической онкологии. 23 (25): 5892–9. Дои:10.1200 / JCO.2005.02.840. PMID 16043829.
- ^ Линч, TJ; Белл, DW; Sordella, R; Гурубхагаватула, S; Окимото, РА; Бранниган, BW; Harris, PL; Хазерлат, С.М. Супко, Ю.Г.; Халуська Ф.Г .; Луи, DN; Кристиани, округ Колумбия; Сеттлман, Дж; Габер, Д.А. (20 мая 2004 г.). «Активирующие мутации в рецепторе эпидермального фактора роста, лежащие в основе реакции немелкоклеточного рака легкого на гефитиниб» (PDF). Медицинский журнал Новой Англии. 350 (21): 2129–39. Дои:10.1056 / NEJMoa040938. PMID 15118073.
- ^ Sawyers CL (апрель 2008 г.). «Проблема биомаркера рака». Природа. 452 (7187): 548–52. Bibcode:2008Натура.452..548S. Дои:10.1038 / природа06913. PMID 18385728.
- ^ Карась-Кузелицкий, Н; Млинарич-Раскан, I (август 2009 г.). «Индивидуализация тиопуриновой терапии: тиопурин-S-метилтрансфераза и не только». Фармакогеномика. 10 (8): 1309–22. Дои:10.2217 / стр.09.78. PMID 19663675.
- ^ Реллинг М.В., Хэнкок М.Л., Ривера Г.К. и др. (Декабрь 1999 г.). «Непереносимость меркаптопуриновой терапии и гетерозиготность по локусу гена тиопурин-S-метилтрансферазы». Журнал Национального института рака. 91 (23): 2001–8. Дои:10.1093 / jnci / 91.23.2001. PMID 10580024.
- ^ а б Шнайдер, Джон; Манприт К. Сидху; Синтия Дусе; Ноэми Кисс; Роберт Л. Осфельдт; Дональд Чалфин (2012). «Экономика онкологических биомаркеров». Персонализированная медицина. 9 (8): 829–837. Дои:10.2217 / pme.12.87. PMID 29776231.
- ^ Хенце, G; Даммер, Р. Joller-Jemelka, HI; Böni, R; Бург, Г. (1997). «Сыворотка S100 - маркер для мониторинга болезни при метастатической меланоме». Дерматология. 194 (3): 208–12. Дои:10.1159/000246103. PMID 9187834.
- ^ Harpio, R; Эйнарссон, Р. (июль 2004 г.). «Белки S100 как биомаркеры рака с акцентом на S100B при злокачественной меланоме». Клиническая биохимия. 37 (7): 512–8. Дои:10.1016 / j.clinbiochem.2004.05.012. PMID 15234232.
- ^ Ламонд, Северо-Запад; Skedgel, C; Юнис, Т. (апрель 2013 г.). «Является ли оценка рецидива 21 гена экономически эффективным методом при эндокринно-чувствительном раке молочной железы без лимфоузлов?». Экспертный обзор фармакоэкономических исследований и исследований результатов. 13 (2): 243–50. Дои:10.1586 / erp.13.4. PMID 23570435.
- ^ Бирощак-младший; Шварц, Г.Ф .; Палаццо, Япония; Плата, AD; Brill, KL; Джаслоу, RJ; Ли, SY (май 2013 г.). «Влияние Oncotype DX на решения о лечении при ER-положительном, отрицательном по узлу раке молочной железы с гистологической корреляцией». Журнал груди. 19 (3): 269–75. Дои:10.1111 / tbj.12099. PMID 23614365.
- ^ Моен, доктор медицины; McKeage, K; Плоскер, Г.Л .; Сиддики, Массачусетс (2007). «Иматиниб: обзор его использования при хроническом миелоидном лейкозе». Наркотики. 67 (2): 299–320. Дои:10.2165/00003495-200767020-00010. PMID 17284091.
- ^ Лимоник, Майкл; Алиса Парк (28 мая 2001 г.). «Новая надежда на рак». Журнал Тайм. Получено 26 апреля 2013.
- ^ Цена, C; Макдоннелл, Д. (февраль 1991 г.). «Влияние фильтрации ниобия и постоянного потенциала на сенситометрические отклики стоматологических рентгенографических пленок». Челюстно-лицевая радиология. 20 (1): 11–6. Дои:10.1259 / dmfr.20.1.1884846. PMID 1884846.
- ^ Коэн, Виктор; Фадло Хури (2003). «Прогресс в химиопрофилактике рака легких» (PDF). Борьба с раком. 10 (4): 315–324. Дои:10.1177/107327480301000406. PMID 12915810. Получено 26 апреля 2013.[постоянная мертвая ссылка]
- ^ Лу, CY; Цай, HL; Uen, YH; Ху, HM; Чен, CW; Cheng, TL; Lin, SR; Ван, JY (5 марта 2013 г.). «Циркулирующие опухолевые клетки как суррогатный маркер для определения клинического исхода химиотерапии mFOLFOX у пациентов с раком толстой кишки III стадии». Британский журнал рака. 108 (4): 791–7. Дои:10.1038 / bjc.2012.595. ЧВК 3590657. PMID 23422758.
- ^ Балич, М; Уильямс, А; Lin, H; Датар, Р; Кот, RJ (2013). «Циркулирующие опухолевые клетки: от скамейки к постели». Ежегодный обзор медицины. 64: 31–44. Дои:10.1146 / annurev-med-050311-163404. ЧВК 3809995. PMID 23092385.
- ^ Мадхаван, D; Цукник, М; Wallwiener, M; Цук, К; Modugno, C; Шарпфф, М; Schott, S; Хайль, Дж; Турчинович А; Ян, Р; Беннер, А; Ритдорф, S; Трамп, А; Sohn, C; Пантел, К; Schneeweiss, A; Burwinkel, B (1 ноября 2012 г.). «Циркулирующие миРНК как суррогатные маркеры циркулирующих опухолевых клеток и прогностические маркеры при метастатическом раке молочной железы». Клинические исследования рака. 18 (21): 5972–82. Дои:10.1158 / 1078-0432.CCR-12-1407. PMID 22952344.
- ^ Редова, М; Сана, Дж; Слаби, О (март 2013). «Циркулирующие миРНК как новые биомаркеры крови для солидного рака». Будущая онкология. 9 (3): 387–402. Дои:10.2217 / fon.12.192. PMID 23469974.
- ^ Joosse, SA; Пантель, К. (1 января 2013 г.). «Биологические проблемы при обнаружении циркулирующих опухолевых клеток». Исследования рака. 73 (1): 8–11. Дои:10.1158 / 0008-5472.CAN-12-3422. PMID 23271724.
- ^ Hou, HW; Варкиани, Мэн; Khoo, BL; Li, ZR; Су, РА; Tan, DS; Lim, WT; Хан, Дж; Бхагат, АА; Лим, CT (2013). «Выделение и извлечение циркулирующих опухолевых клеток с использованием центробежных сил». Научные отчеты. 3: 1259. Bibcode:2013НатСР ... 3Э1259Н. Дои:10.1038 / srep01259. ЧВК 3569917. PMID 23405273.
- ^ Дхондт, Берт; Де Блезер, Элиза; Клэйс, Том; Бюленс, Сара; Люмен, Николаас; Вандесомпеле, Джо; Бекерс, Аннелин; Фонтейн, Валери; Ван дер Экен, Ким; Де Брюйкер, Орели; Поль, Жером; Грамм, Пьер; Ост, Пит (21 декабря 2018 г.). «Обнаружение и проверка сигнатуры сывороточной микроРНК для характеристики олиго- и полиметастатического рака простаты: пока не готовы». Всемирный журнал урологии. 37 (12): 2557–2564. Дои:10.1007 / s00345-018-2609-8. HDL:1854 / LU-8586484. PMID 30578441.
- ^ а б c d е ж грамм час я j k л м п о п q р s «Таблица фармакогеномных биомаркеров на этикетках лекарств». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
- ^ а б c d е «Информационный бюллетень о онкомаркерах» (PDF). Американское онкологическое общество.
- ^ а б Хайнц-Йозеф Ленц (18.09.2012). Биомаркеры в онкологии: прогноз и прогноз. Springer Science & Business Media. п. 263. ISBN 978-1-4419-9754-8.
- ^ Гонсалес Р.С., Карлсон Г., Пейдж А.Дж., Коэн С. (июль 2011 г.). «Маркеры стромальных опухолей желудочно-кишечного тракта при меланомах кожи: взаимосвязь с прогностическими факторами и исходом». Американский журнал клинической патологии. 136 (1): 74–80. Дои:10.1309 / AJCP9KHD7DCHWLMO. PMID 21685034.
- ^ Там С.С., Отеро-Паласиос Дж., Абруццо Л.В. и др. (Апрель 2008 г.). «Экспрессия CD20 хронического лимфоцитарного лейкоза зависит от генетического подтипа: исследование количественной проточной цитометрии и флуоресцентной гибридизации in-situ у 510 пациентов». Британский журнал гематологии. 141 (1): 36–40. Дои:10.1111 / j.1365-2141.2008.07012.x. PMID 18324964.
- ^ Чжан М., Яо З., Патель Х и др. (Май 2007 г.). «Эффективная терапия мышиных моделей лейкемии и лимфомы человека радиоактивно меченным анти-CD30 антителом HeFi-1». Труды Национальной академии наук Соединенных Штатов Америки. 104 (20): 8444–8. Bibcode:2007PNAS..104.8444Z. Дои:10.1073 / pnas.0702496104. ЧВК 1895969. PMID 17488826.
- ^ Ямада Ю., Санчес-Агилера А., Брандт Э. Б. и др. (Сентябрь 2008 г.). «FIP1L1 / PDGFRalpha взаимодействует с SCF для индукции системного мастоцитоза на мышиной модели хронического эозинофильного лейкоза / гиперэозинофильного синдрома». Кровь. 112 (6): 2500–7. Дои:10.1182 / кровь-2007-11-126268. PMID 18539901.
- ^ Нимер SD (май 2008 г.). «Миелодиспластические синдромы». Кровь. 111 (10): 4841–51. Дои:10.1182 / кровь-2007-08-078139. PMID 18467609. S2CID 6802096.
- ^ Оттманн О., Домбрет Х., Мартинелли Г. и др. (Октябрь 2007 г.). «Дазатиниб вызывает быстрые гематологические и цитогенетические ответы у взрослых пациентов с острым лимфобластным лейкозом с положительной филадельфийской хромосомой с устойчивостью или непереносимостью иматиниба: промежуточные результаты исследования фазы 2». Кровь. 110 (7): 2309–15. Дои:10.1182 / кровь-2007-02-073528. PMID 17496201.
- ^ Булос Н., Малдер Х.Л., Калабрезе С.Р. и др. (Март 2011 г.). «Химиотерапевтические агенты предотвращают появление устойчивых к дазатинибу мутаций киназы BCR-ABL в точной мышиной модели острого лимфобластного лейкоза с положительной хромосомой в Филадельфии». Кровь. 117 (13): 3585–95. Дои:10.1182 / blood-2010-08-301267. ЧВК 3072880. PMID 21263154.
- ^ О'Коннелл, Пенсильвания, Мадурейра, Берман, Дж. Н., Ливски, Р. С., Вайсман, Д. М. (апрель 2011 г.). «Регулирование S100A10 онкобелком PML-RAR-α». Кровь. 117 (15): 4095–105. Дои:10.1182 / blood-2010-07-298851. PMID 21310922.
- ^ Даффи MJ, Crown J (ноябрь 2008 г.). «Индивидуальный подход к лечению рака: как могут помочь биомаркеры». Клиническая химия. 54 (11): 1770–9. Дои:10.1373 / Clinchem.2008.110056. PMID 18801934.
- ^ Ribrag V, Koscielny S, Casasnovas O, et al. (Апрель 2009 г.). «Фармакогенетическое исследование лимфомы Ходжкина показывает влияние полиморфизма UGT1A1 на прогноз пациента». Кровь. 113 (14): 3307–13. Дои:10.1182 / кровь-2008-03-148874. PMID 18768784.
- ^ Ли Й, Е Икс, Лю Дж, Чжа Дж, Пей Л. (январь 2011 г.). «Оценка слитых белков EML4-ALK при немелкоклеточном раке легкого с использованием низкомолекулярных ингибиторов». Неоплазия. 13 (1): 1–11. Дои:10.1593 / neo.101120. ЧВК 3022423. PMID 21245935.
- ^ а б Пао В., Жирар Н. (февраль 2011 г.). «Новые мутации драйвера при немелкоклеточном раке легкого». Ланцет Онкология. 12 (2): 175–80. Дои:10.1016 / S1470-2045 (10) 70087-5. PMID 21277552.
- ^ Хьюс, Арлингтон (2 октября 2014 г.). «Перспективный метод выявления рака поджелудочной железы за несколько лет до традиционной диагностики». Singularity HUB. Получено 2016-04-22.
- ^ Гупта, дигант; Лис, Кристофер Г. (2009-10-09). «Роль CA125 в прогнозировании выживаемости при раке яичников - обзор эпидемиологической литературы». Журнал исследований яичников. 2 (1): 13. Дои:10.1186/1757-2215-2-13. ISSN 1757-2215. ЧВК 2764643. PMID 19818123.
- ^ Бартельс К.Л., Цонгалис Г.Дж. (апрель 2009 г.). «МикроРНК: новые биомаркеры рака человека». Клиническая химия. 55 (4): 623–31. Дои:10.1373 / Clinchem.2008.112805. PMID 19246618.
- ^ Полсон, Келли Дж .; Льюис, Кристофер В .; Редман, Мэри В .; Саймонсон, Уильям Т .; Лисберг, Аарон; Риттер, Дебора; Моришима, Тихиро; Хатчинсон, Кэтлин; Мудгистратова, Лола; Блом, Астрид; Айер, Джаясри; Мошири, Ата С .; Тарабадкар, Эрика С .; Картер, Джозеф Дж .; Бхатия, Шайлендер; Кавасуми, Масаоки; Galloway, Denise A .; Wener, Mark H .; Нгием, Пол (2017). «Вирусные онкопротеиновые антитела как маркер рецидива карциномы из клеток Меркеля: проспективное валидационное исследование». Рак. 123 (8): 1464–1474. Дои:10.1002 / cncr.30475. ЧВК 5384867. PMID 27925665.
- ^ Проктор, М Дж; Макмиллан, округ Колумбия; Моррисон, Д. С.; Флетчер, К. Д.; Horgan, PG; Кларк, С. Дж. (24 июля 2012 г.). «Производное соотношение нейтрофилов и лимфоцитов позволяет прогнозировать выживаемость больных раком». Британский журнал рака. 107 (4): 695–699. Дои:10.1038 / bjc.2012.292. ISSN 0007-0920. ЧВК 3419948. PMID 22828611.
- ^ а б Лю, человек; Син, Лу-Ци (2017-06-07). «Базовый фактор роста фибробластов как потенциальный биомаркер для диагностики метастазов злокачественных опухолей у женщин». Письма об онкологии. 14 (2): 1561–1567. Дои:10.3892 / ol.2017.6335. ISSN 1792-1074. ЧВК 5529833. PMID 28789380.
- ^ Фюрстенбергер, Грегор; Сенн, Ханс-Йорг (май 2002 г.). «Инсулиноподобные факторы роста и рак». Ланцет онкологии. 3 (5): 298–302. Дои:10.1016 / с1470-2045 (02) 00731-3. ISSN 1470-2045. PMID 12067807.
- ^ Ю, Герберт; Рохан, Томас (2000-09-20). «Роль семейства инсулиноподобных факторов роста в развитии и прогрессировании рака». JNCI: журнал Национального института рака. 92 (18): 1472–1489. Дои:10.1093 / jnci / 92.18.1472. ISSN 0027-8874. PMID 10995803.
- ^ Вано, Янн-Александр; Удар, Стефан; Автор, Мари-Аньес; Тету, Полина; Тибо, Констанция; Абудагга, приветствую! Скотте, Флориан; Элаиди, Реза (2018-04-06). «Оптимальный порог соотношения нейтрофилов и лимфоцитов: факт или вымысел? Проспективное когортное исследование у пациентов с метастатическим раком». PLOS ONE. 13 (4): e0195042. Bibcode:2018PLoSO..1395042V. Дои:10.1371 / journal.pone.0195042. ISSN 1932-6203. ЧВК 5889159. PMID 29624591.
- ^ Лю, человек; Син, Лу-Ци (2017-08-01). «Базовый фактор роста фибробластов как потенциальный биомаркер для диагностики метастазов злокачественных опухолей у женщин». Письма об онкологии. 14 (2): 1561–1567. Дои:10.3892 / ol.2017.6335. ISSN 1792-1074. ЧВК 5529833. PMID 28789380.
- ^ Торренте-Родригес, Ребека М .; Руис-Вальдепеньяс Монтьель, Виктор; Кампузано, Сусана; Педреро, Мария; Фарчадо, Мерьем; Варгас, Ева; Мануэль де Вильена, Ф. Хавьер; Гарранцо-Асенсио, Мария; Бардерас, Родриго; Пингаррон, Хосе М. (4 апреля 2017 г.). «Электрохимический датчик для быстрого определения рецептора 4 фактора роста фибробластов в сырых лизатах раковых клеток». PLOS ONE. 12 (4): e0175056. Bibcode:2017PLoSO..1275056T. Дои:10.1371 / journal.pone.0175056. ISSN 1932-6203. ЧВК 5380347. PMID 28376106.
- ^ Дендулури, Сахитья К .; Идову, Олумуива; Ван, Чжунлян; Ляо, Чжань; Ян, Чжэнцзянь; Мохаммед, Марьям К .; Е, Цзиксин; Вэй, Цян; Ван, Цзин; Чжао, Лянгун; Луу, Хюэ Х. (март 2015 г.). «Передача сигналов инсулиноподобного фактора роста (IGF) при онкогенезе и развитии лекарственной устойчивости рака». Гены и болезни. 2 (1): 13–25. Дои:10.1016 / j.gendis.2014.10.004. ISSN 2352-3042. ЧВК 4431759. PMID 25984556.