WikiDer > Колоректальный рак
| Колоректальный рак | |
|---|---|
| Другие имена | Рак толстой кишки, рак прямой кишки, рак кишечника |
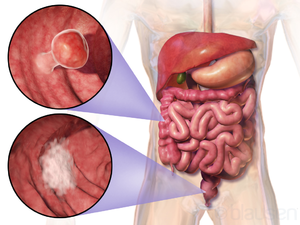 | |
| Расположение и внешний вид двух примеров колоректальных опухолей | |
| Специальность | Гастроэнтерология Общая хирургия Онкология |
| Симптомы | рвота кровью, Кровь в стуле, изменение дефекации, потеря веса, усталость.[1] |
| Причины | Старость, факторы образа жизни, генетические нарушения[2][3] |
| Факторы риска | Рацион питания, ожирение, курение, отсутствие физическая активность, употребление алкоголя[2][4] |
| Диагностический метод | Биопсия ткани во время ректороманоскопия или же колоноскопия[1] |
| Профилактика | Скрининг от 50 до 75 лет[5] |
| Уход | Хирургия, радиационная терапия, химиотерапия, таргетная терапия[6] |
| Прогноз | Пятилетняя выживаемость 65% (США)[7] |
| Частота | 9,4 миллиона (2015)[8] |
| Летальные исходы | 551,000 (2018)[9] |
Колоректальный рак (CRC), также известный как рак кишечника, рак толстой кишки, или же рак прямой кишки, это развитие рак от двоеточие или же прямая кишка (части толстая кишка).[6] Признаки и симптомы могут включать: кровь в стуле, изменение в испражнения, потеря веса и усталость.[1]
Большинство случаев колоректального рака возникает из-за старости и факторов образа жизни, и лишь небольшое количество случаев связано с основными генетическими нарушениями.[2][3] Факторы риска включают диету, ожирение, курение и отсутствие физическая активность.[2] Диетические факторы, повышающие риск, включают: красное мясо, обработанное мясо, и алкоголь.[2][4] Еще один фактор риска: воспалительное заболевание кишечника, который включает болезнь Крона и язвенный колит.[2] Некоторые из унаследованных генетические нарушения которые могут вызвать колоректальный рак, включают семейный аденоматозный полипоз и наследственный неполипозный рак толстой кишки; однако это составляет менее 5% случаев.[2][3] Обычно он начинается как доброкачественная опухоль, часто в виде полип, который со временем становится раковый.[2]
Рак кишечника можно диагностировать: получение образца толстой кишки во время ректороманоскопия или же колоноскопия.[1] Затем следует медицинская визуализация чтобы определить, распространилась ли болезнь.[6] Скрининг эффективен для предотвращения и снижения смертности от колоректального рака.[5] Обследование одним из нескольких методов рекомендуется в возрасте от 50 до 75 лет.[5] При обнаружении во время колоноскопии небольшие полипы могут быть удалены.[2] Если обнаружен большой полип или опухоль, может быть выполнена биопсия, чтобы проверить, злокачественен ли он. Аспирин и другие нестероидные противовоспалительные препараты снизить риск.[2][10] Однако их общее использование для этой цели не рекомендуется из-за побочных эффектов.[11]
Лечение колоректального рака может включать в себя комбинацию хирургического вмешательства, радиационная терапия, химиотерапия и таргетная терапия.[6] Раковые образования, ограниченные стенкой толстой кишки, можно вылечить хирургическим путем, в то время как рак, который широко распространился обычно неизлечим, и руководство направлено на улучшение качество жизни и симптомы.[6] В пятилетняя выживаемость в США - около 65%.[7] Индивидуальная вероятность выживания зависит от того, насколько прогрессирует рак, можно ли удалить весь рак хирургическим путем и от общего состояния здоровья человека.[1] В глобальном масштабе колоректальный рак является третьим по распространенности типом рака, составляющим около 10% всех случаев.[12] В 2018 году было зарегистрировано 1,09 миллиона новых случаев заболевания и 551 тысяча смертей от этого заболевания.[9] Это чаще встречается в развитые страны, где обнаруживается более 65% случаев.[2] У женщин встречается реже, чем у мужчин.[2]
Признаки и симптомы
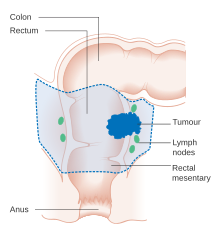
Признаки и симптомы колоректального рака зависят от локализации опухоли в кишечник, и распространился ли он на другие части тела (метастаз). К классическим предупреждающим признакам относятся: ухудшение запор, кровь в стуле, уменьшение калибра (толщины) стула, потеря аппетита, потеря веса и тошнота или же рвота у кого-то старше 50 лет.[13] Около 50% людей с колоректальным раком не сообщают о каких-либо симптомах.[14]
Ректальное кровотечение или же анемия являются симптомами высокого риска у людей старше 50 лет.[15] Потеря веса и изменения в привычке кишечника обычно вызывают беспокойство только в том случае, если они связаны с ректальным кровотечением.[15][16]
Причина
Более 75–95% случаев колоректального рака возникает у людей с небольшим генетическим риском или без него.[17][18] Факторы риска включают пожилой возраст, мужской пол,[18] высокое потребление жиров, сахар, алкоголь, красное мясо, обработанное мясо, ожирение, курение, и отсутствие физическое упражнение.[17][19] Примерно 10% случаев связаны с недостаточной активностью.[20] Риск употребления алкоголя увеличивается при употреблении более одного напитка в день.[21] Питье 5 стаканов воды в день снижает риск колоректального рака и аденоматозных полипов.[22] Streptococcus gallolyticus связан с колоректальным раком.[23] Некоторые штаммы Streptococcus bovis / Streptococcus equinus комплекс ежедневно потребляют миллионы людей и поэтому могут быть безопасными.[24] От 25 до 80% людей с Streptococcus bovis / gallolyticus бактериемия имеет сопутствующие колоректальные опухоли.[25] Серопространственность Streptococcus bovis / gallolyticus считается потенциальным практическим маркером для раннего прогнозирования основного поражения кишечника в популяции с высоким риском.[25] Было высказано предположение, что наличие антител к Streptococcus bovis / gallolyticus Антигены или сами антигены в кровотоке могут действовать как маркеры канцерогенеза в толстой кишке.[25]
Воспалительное заболевание кишечника
Люди с воспалительное заболевание кишечника (язвенный колит и болезнь Крона) имеют повышенный риск рака толстой кишки.[26][27] Риск увеличивается, чем дольше человек болеет, и тем сильнее тяжесть воспаления.[28] В этих группах высокого риска обе меры профилактики с аспирин и регулярный колоноскопии рекомендуются.[29] Эндоскопическое наблюдение в этой группе высокого риска может снизить риск развития колоректального рака за счет ранней диагностики, а также может снизить вероятность смерти от рака толстой кишки.[29] Люди с воспалительными заболеваниями кишечника ежегодно составляют менее 2% случаев рака толстой кишки.[28] Среди пациентов с болезнью Крона 2% заболевают колоректальным раком через 10 лет, 8% - через 20 лет и 18% - через 30 лет.[28] У людей с язвенным колитом примерно у 16% развивается либо предшественник рака или рак толстой кишки старше 30 лет.[28]
Генетика
Те, у кого есть семейная история из двух или более родственники первой степени родства (например, родитель или брат или сестра) имеют в два-три раза больший риск заболевания, и на эту группу приходится около 20% всех случаев. Ряд генетических синдромов также связаны с более высокими показателями колоректального рака. Наиболее распространенным из них является наследственный неполипозный колоректальный рак (HNPCC или синдром Линча), который присутствует примерно у 3% людей с колоректальным раком.[18] Другие синдромы, которые сильно связаны с колоректальным раком, включают: Синдром Гарднера и семейный аденоматозный полипоз (ФАП).[30] У людей с этими синдромами рак почти всегда возникает и составляет 1% всех случаев рака.[31] Всего проктоколэктомия может быть рекомендован людям с ФАП в качестве профилактической меры из-за высокого риска злокачественных новообразований. Колэктомия - удаление толстой кишки - может оказаться недостаточной профилактической мерой из-за высокого риска рака прямой кишки, если прямая кишка останется.[32] Наиболее распространенным синдромом полипоза толстой кишки является синдром зубчатого полипоза,[33] что связано с 25-40% риском CRC.[34]
Мутации в паре генов (СТОЛБ и POLD1) были связаны с семейным раком толстой кишки.[35]
Большинство смертей от рака толстой кишки связано с метастатическим заболеванием. Ген, который, по-видимому, способствует развитию метастазов, связанных с метастазами рака толстой кишки 1 (MACC1), был изолирован.[36] Это транскрипционный фактор, который влияет на экспрессию фактор роста гепатоцитов. Этот ген связан с пролиферацией, инвазией и рассеянием клеток рака толстой кишки в клеточной культуре, а также с ростом опухоли и метастазированием у мышей. MACC1 может быть потенциальной мишенью для лечения рака, но эту возможность необходимо подтвердить клиническими исследованиями.[37]
Эпигенетические факторы, такие как аномальное метилирование ДНК промоторов-супрессоров опухолей, играют роль в развитии колоректального рака.[38]
У евреев ашкенази на 6% выше риск получить аденомы, а затем рак толстой кишки из-за мутаций в Ген APC быть более распространенным.[39]
Патогенез
Колоректальный рак - это заболевание, возникающее из-за эпителиальные клетки выстилает толстую или прямую кишку желудочно-кишечный тракт, чаще всего в результате мутаций в Сигнальный путь Wnt которые увеличивают сигнальную активность. Мутации могут быть унаследованный или же приобретенный, и, скорее всего, происходят в кишечный крипта стволовая клетка.[40][41][42] Наиболее часто мутирующий ген при любом колоректальном раке - это APC ген, который продуцирует белок APC. Белок APC предотвращает накопление β-катенин белок. Без APC β-катенин накапливается до высоких уровней и перемещается (перемещается) в ядро, связывается с ДНК и активирует транскрипция прото-онкогены. Эти гены обычно важны для обновления и дифференциации стволовых клеток, но при неправильной экспрессии на высоких уровнях они могут вызвать рак. В то время как APC мутирует при большинстве видов рака толстой кишки, некоторые виды рака имеют повышенный уровень β-катенина из-за мутаций в β-катенин (CTNNB1), которые блокируют его собственный распад или имеют мутации в других генах с функцией, аналогичной APC, например AXIN1, AXIN2, TCF7L2, или же NKD1.[43]
Помимо дефектов в Сигнальный путь Wntдругие мутации должны произойти, чтобы клетка стала злокачественной. В p53 белок, продуцируемый TP53 ген, обычно контролирует деление клеток и вызывает их запрограммированная смерть если у них есть дефекты пути Wnt. В конце концов, клеточная линия приобретает мутацию в TP53 ген и трансформирует ткань из доброкачественная эпителиальная опухоль в агрессивный эпителиально-клеточный рак. Иногда мутировал не ген, кодирующий p53, а другой защитный белок, названный BAX вместо этого видоизменяется.[43]
Другие белки, ответственные за запрограммированную гибель клеток, которые обычно деактивируются при колоректальном раке: TGF-β и DCC (Удалено при колоректальном раке). TGF-β имеет деактивирующую мутацию по крайней мере в половине случаев колоректального рака. Иногда деактивируется не TGF-β, а нижестоящий белок, называемый SMAD деактивирован.[43] DCC обычно имеет удаленный сегмент хромосомы при колоректальном раке.[44]
Приблизительно 70% всех генов человека экспрессируются при колоректальном раке, и чуть более 1% имеют повышенную экспрессию при колоректальном раке по сравнению с другими формами рака.[45] Некоторые гены онкогены: они сверхэкспрессируются при колоректальном раке. Например, гены, кодирующие белки KRAS, РАФ, и PI3K, которые обычно стимулируют ячейка для деления в ответ на факторы роста могут приобретать мутации, приводящие к чрезмерной активации пролиферации клеток. Иногда важен хронологический порядок мутаций. Если произошла предыдущая мутация APC, первичная мутация KRAS часто переходит в рак, а не в самоограничивающееся гиперпластическое или пограничное поражение.[46] PTEN, опухолевый супрессор, обычно ингибирует PI3K, но иногда может мутировать и деактивироваться.[43]
Всесторонний анализ в масштабе генома показал, что колоректальные карциномы можно разделить на гипермутированные и негипермутированные типы опухолей.[47] В дополнение к онкогенным и инактивирующим мутациям, описанным для указанных выше генов, негипермутированные образцы также содержат мутировавшие CTNNB1, FAM123B, SOX9, Банкомат, и ARID1A. Прогрессируя через определенный набор генетических событий, гипермутировавшие опухоли демонстрируют мутировавшие формы ACVR2A, TGFBR2, MSH3, MSH6, SLC9A9, TCF7L2, и BRAF. Общей темой среди этих генов для обоих типов опухолей является их участие в сигнальных путях Wnt и TGF-β, что приводит к повышенной активности МОЙ С, центральный игрок в колоректальном раке.[47]
Исправление несоответствия (MMR) дефицитные опухоли характеризуются относительно высоким количеством полинуклеотидных тандемных повторов.[48] Это вызвано дефицитом белков MMR, которые обычно вызваны: эпигенетический молчание и / или унаследованные мутации (например, Синдром Линча).[49] От 15 до 18 процентов опухолей колоректального рака имеют дефицит MMR, причем 3 процента развиваются из-за синдрома Линча.[50] Роль системы исправления несоответствий заключается в защите целостности генетического материала внутри клеток (то есть: обнаружение и исправление ошибок).[49] Следовательно, дефицит белков MMR может привести к неспособности выявлять и восстанавливать генетические повреждения, что приводит к возникновению дальнейших мутаций, вызывающих рак, и развитию колоректального рака.[49]
Последовательность прогрессирования полипа в рак является классической моделью патогенеза колоректального рака.[51] Последовательность от полипа к раку описывает фазы перехода от доброкачественной опухоли к колоректальному раку на протяжении многих лет.[51] Центральное место в последовательности полипа CRC занимают генные мутации, эпигенетические изменения и местные воспалительные изменения.[51] Последовательность полипа в CRC может быть использована в качестве основы для иллюстрации того, как конкретные молекулярные изменения приводят к различным подтипам рака.[51]
Полевые дефекты

Термин «полевая канцеризация» был впервые использован в 1953 году для описания области или «поля» эпителия, которое было предварительно кондиционировано (в то время в значительной степени неизвестными процессами), чтобы предрасполагать его к развитию рака.[52] С тех пор появились термины «канцеризация поля», «канцерогенез поля», «дефект поля» и «полевой эффект«использовались для описания предраковых или предопухолевых тканей, в которых вероятно возникновение новых видов рака.[53]
Дефекты поля важны для прогрессирования рака толстой кишки.[54][55]
Однако, как указывает Рубин, «подавляющее большинство исследований рака проводилось на четко определенных опухолях. in vivo, или на дискретных неопластических очагах in vitro. Однако есть свидетельства того, что более 80% соматических мутаций, обнаруживаемых в опухолях толстой кишки человека с мутаторным фенотипом, происходят до начала терминальной клональной экспансии ». [56][57] Аналогичным образом Vogelstein et al.[58] указали, что более половины соматических мутаций, выявленных в опухолях, происходят в предопухолевой фазе (в поле дефекта), во время роста явно нормальных клеток. Точно так же эпигенетические изменения, присутствующие в опухолях, могут возникать в предопухолевых полевых дефектах.
Расширенное представление о полевом эффекте было названо «этиологическим полевым эффектом», который включает не только молекулярные и патологические изменения в предопухолевых клетках, но также влияние экзогенных факторов окружающей среды и молекулярные изменения в локальных клетках. микросреда на неопластической эволюции от зарождения опухоли до смерти.[59]
Эпигенетика
Эпигенетический При раке толстой кишки изменения встречаются гораздо чаще, чем генетические (мутационные). Как описано Vogelstein et al.,[58] в среднем рак толстой кишки имеет только 1 или 2 мутации онкогена и от 1 до 5 мутаций-супрессоров опухоли (вместе называемых «мутациями-драйверами»), с примерно 60 дополнительными мутациями-пассажирами. Онкогены и гены-супрессоры опухолей хорошо изучены и описаны выше в разделе Патогенез.
Помимо эпигенетического изменения экспрессии miRNA, другие распространенные типы эпигенетических изменений при раке, которые изменяют уровни экспрессии генов, включают прямое гиперметилирование или гипометилирование CpG-островков генов, кодирующих белок, и изменения гистонов и хромосомной архитектуры, которые влияют на экспрессию генов.[60] Например, 147 гиперметилирований и 27 гипометилирований генов, кодирующих белок, часто были связаны с колоректальным раком. Из гиперметилированных генов 10 были гиперметилированы в 100% случаев рака толстой кишки, а многие другие были гиперметилированы более чем в 50% случаев рака толстой кишки.[61] Кроме того, 11 гиперметилирований и 96 гипометилирований miRNAs также были связаны с колоректальным раком.[61] Аномальный (ненормальный) метилирование возникает как нормальное следствие нормального старения, и риск развития колоректального рака увеличивается с возрастом.[62] Источник и триггер этого возрастного метилирования неизвестны.[62][63] Примерно половина генов, показывающих возрастные изменения метилирования, - это те же гены, которые, как было установлено, участвуют в развитии колоректального рака.[62] Эти данные могут указывать на причину, по которой возраст связан с повышенным риском развития колоректального рака.[62]
Эпигенетическое снижение экспрессии фермента репарации ДНК может, вероятно, привести к геномной и эпигеномной нестабильности, характерной для рака.[64][65][66] Как сказано в статьях Канцерогенез и Новообразованиедля спорадических видов рака в целом недостаточность репарации ДНК иногда возникает из-за мутации в гене репарации ДНК, но гораздо чаще из-за эпигенетических изменений, которые снижают или подавляют экспрессию генов репарации ДНК.[нужна цитата]
Эпигенетические изменения, участвующие в развитии колоректального рака, могут повлиять на реакцию человека на химиотерапию.[67]
Диагностика
Диагностика рака прямой кишки выполняется путем отбора проб из участков толстой кишки, подозрительных на возможное развитие опухоли, обычно во время колоноскопии или ректороманоскопии, в зависимости от локализации поражения.[18] Это подтверждается микроскопическим исследованием образца ткани.
Медицинская визуализация
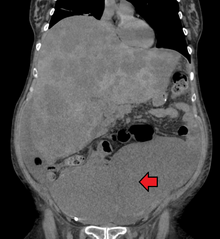
Колоректальный рак иногда первоначально обнаруживают на компьютерная томография.
Присутствие метастазы определяется компьютерная томография груди, живота и таза.[18] Другие потенциальные визуализационные тесты, такие как ДОМАШНИЙ ПИТОМЕЦ и МРТ может использоваться в определенных случаях.[18] Последний часто используется при поражении прямой кишки, чтобы определить его локальную стадию и облегчить предоперационное планирование.
Гистопатология

В гистопатологический характеристики опухоль сообщается на основе анализа ткани, взятой при биопсии или хирургическом вмешательстве. Отчет о патологии содержит описание микроскопических характеристик опухолевой ткани, включая как опухолевые клетки, так и то, как опухоль проникает в здоровые ткани, и, наконец, если опухоль полностью удалена. Наиболее распространенной формой рака толстой кишки является аденокарцинома, составляя от 95%[69] до 98%[70] всех случаев колоректального рака. Другие, более редкие типы включают лимфома, аденосквамозный и плоскоклеточная карцинома. Некоторые подтипы оказались более агрессивными.[71] Иммуногистохимия может использоваться в неопределенных случаях.
Постановка
Постановка рака основывается как на радиологических, так и на патологических данных. Как и в случае с большинством других форм рака, стадия опухоли основана на Система TNM который учитывает степень распространения первоначальной опухоли и наличие метастазов в лимфатических узлах и более отдаленных органах.[18] 8-е издание AJCC было опубликовано в 2018 году.[72]
Профилактика
Было подсчитано, что около половины случаев колоректального рака вызваны факторами образа жизни, и около четверти всех случаев можно предотвратить.[73] Усиление эпиднадзора, физическая активность, диета с высоким содержанием клетчатки, сокращение курения и алкоголя снижают риск.[74][75]
Стиль жизни
Факторы риска, связанные с образом жизни, с убедительными доказательствами включают отсутствие физических упражнений, курение сигарет, алкоголь и ожирение.[76][77] Риск рака толстой кишки можно снизить, поддерживая нормальную массу тела за счет сочетания достаточных физических упражнений и правильного питания. Здоровая диета.[78]
Начиная с 1970-х годов, диетические рекомендации по предотвращению колоректального рака часто включали увеличение потребления цельнозерновых, фруктов и овощей и сокращение потребления красное мясо и обработанное мясо. Это было основано на исследованиях на животных и ретроспективных наблюдательных исследованиях. Однако крупномасштабные проспективные исследования не смогли продемонстрировать значительный защитный эффект, и из-за множества причин рака и сложности изучения корреляций между диетой и здоровьем неясно, есть ли какие-либо конкретные диетические вмешательства (помимо здорового питания) будет иметь значительные защитные эффекты.[79]:432–433[80]:125–126 В 2018 г. Национальный институт рака заявил, что «нет надежных доказательств того, что диета, начатая в зрелом возрасте, с низким содержанием жира и мяса и с высоким содержанием клетчатки, фруктов и овощей, снижает риск CRC в клинически важной степени».[76][81]
Что касается пищевых волокон, то в отчете Всемирной организации здравоохранения о раке за 2014 год отмечается, что была выдвинута гипотеза, что клетчатка может помочь предотвратить колоректальный рак, но большинство исследований не подтвердили это, и состояние науки по состоянию на 2014 год оставалось неясным.[80] Однако обзор 2019 года обнаружил доказательства пользы пищевых волокон и цельного зерна.[82] В Всемирный фонд исследования рака перечислили пользу клетчатки для предотвращения колоректального рака как «вероятную» по состоянию на 2017 год.[83]
Рекомендуется более высокая физическая активность.[19][84] Физическое упражнение связан с умеренным снижением риска рака прямой кишки, но не рака прямой кишки.[85][86] Высокий уровень физической активности снижает риск рака толстой кишки примерно на 21%.[87] Сидя регулярно в течение продолжительных периодов времени ассоциируется с более высокой смертностью от рака толстой кишки. Риск не отменяется регулярными упражнениями, хотя и снижается.[88]
Лекарства и добавки
Аспирин и целекоксиб по-видимому, снижает риск развития колоректального рака у лиц с высоким риском.[89][90] Аспирин рекомендуется людям в возрасте от 50 до 60 лет, у которых нет повышенного риска кровотечения и имеется риск сердечно-сосудистых заболеваний для предотвращения колоректального рака.[91] Не рекомендуется людям из группы среднего риска.[92]
Есть предварительные доказательства кальций добавки, но этого недостаточно, чтобы дать рекомендацию.[93] Витамин Д потребление и уровни в крови связаны с более низким риском рака толстой кишки.[94][95]
Скрининг
Поскольку более 80% случаев колоректального рака возникают из аденоматозные полипы, скрининг на этот рак эффективен как для раннего выявления, так и для профилактики.[18][96] Диагностика случаев колоректального рака посредством скрининга обычно проводится за 2–3 года до диагностики случаев с симптомами.[18] Любые обнаруженные полипы можно удалить, обычно колоноскопия или же ректороманоскопия, и тем самым предотвратить их превращение в рак. Скрининг может снизить смертность от колоректального рака на 60%.[97]
Три основных скрининговых теста: колоноскопия, фекальная скрытая кровь тестирование и гибкая ректороманоскопия. Из трех только ректороманоскопия не может проверить правая часть толстой кишки где обнаруживается 42% раковых заболеваний.[98] Однако гибкая ректороманоскопия является лучшим доказательством снижения риска смерти от любой причины.[99]
Анализ кала на скрытую кровь (FOBT) кала обычно рекомендуется каждые два года и может быть либо на основе гваяка или же иммунохимический.[18] Если обнаруживаются ненормальные результаты FOBT, участников обычно направляют на контрольное обследование с помощью колоноскопии. При проведении один раз в 1-2 года скрининг FOBT снижает смертность от колоректального рака на 16%, а среди тех, кто участвует в скрининге, смертность от колоректального рака может быть снижена до 23%, хотя не было доказано, что он снижает смертность от всех причин.[100] Иммунохимические тесты точны и не требуют изменения диеты или лекарств перед тестированием.[101]
Другие варианты включают виртуальная колоноскопия и скрининговое тестирование ДНК стула (FIT-ДНК). Виртуальная колоноскопия через компьютерная томография выглядит так же хорошо, как стандартная колоноскопия для обнаружения рака и больших аденом, но стоит дорого, связано с радиационным воздействием и не может удалить какие-либо обнаруженные аномальные новообразования, как при стандартной колоноскопии.[18] Скрининговый тест на ДНК стула ищет биомаркеры связанные с колоректальным раком и предраковыми поражениями, включая измененные ДНК и гемоглобин крови. Положительный результат должен сопровождаться колоноскопия. FIT-ДНК имеет больше ложноположительных результатов, чем FIT, и, следовательно, приводит к большему количеству побочных эффектов.[5] По состоянию на 2016 год требуются дальнейшие исследования, чтобы определить, является ли трехлетний интервал между проверками правильным.[5]
Рекомендации
В США обследование обычно рекомендуется в возрасте от 50 до 75 лет.[5][102] В Американское онкологическое общество рекомендует начинать с 45 лет.[103] Для людей в возрасте от 76 до 85 лет решение о проверке должно быть индивидуальным.[5] Для людей из группы повышенного риска обследования обычно начинаются примерно в 40 лет.[18][104]
Рекомендуется несколько методов скрининга, в том числе анализ кала каждые 2 года, ректороманоскопия каждые 10 лет с иммунохимический анализ кала каждые два года, и колоноскопия каждые 10 лет.[102] Неясно, какой из этих двух методов лучше.[105] Колоноскопия может обнаружить больше раковых образований в первой части толстой кишки, но связана с более высокими затратами и большим количеством осложнений.[105] Для людей со средним риском, у которых была качественная колоноскопия с нормальными результатами, Американская гастроэнтерологическая ассоциация не рекомендует никаких обследований в течение 10 лет после колоноскопии.[106][107] Людям старше 75 или с ожидаемой продолжительностью жизни менее 10 лет скрининг не рекомендуется.[108] После обследования у одного человека из 1000 проходит около 10 лет.[109] USPSTF перечисляет семь потенциальных стратегий для скрининга, наиболее важным из которых является то, что по крайней мере одна из этих стратегий используется надлежащим образом.[5]
В Канаде людям в возрасте от 50 до 75 лет с нормальным риском рекомендуется иммунохимическое исследование кала или FOBT каждые два года или ректороманоскопия каждые 10 лет.[110] Колоноскопия менее предпочтительна.[110]
В некоторых странах есть национальные программы колоректального скрининга, которые предлагают скрининг FOBT для всех взрослых в определенной возрастной группе, как правило, в возрасте от 50 до 60 лет. Примеры стран с организованным скринингом включают Соединенное Королевство,[111] Австралия,[112] Нидерланды,[113] Гонконг и Тайвань.[114]
Уход
Лечение колоректального рака может быть направлено на излечение или временное облегчение. Решение о том, какую цель выбрать, зависит от различных факторов, в том числе от состояния здоровья и предпочтений человека, а также от стадии опухоли.[115] Когда колоректальный рак обнаружен на ранней стадии, операция может быть излечивающей. Однако, когда это обнаруживается на более поздних стадиях (для которых метастазы присутствуют), это менее вероятно, и лечение часто направлено на паллиативное лечение, чтобы облегчить симптомы, вызванные опухолью, и обеспечить максимально комфортное состояние человека.[18]
Хирургия
Если рак обнаружен на очень ранней стадии, его можно удалить во время колоноскопии с помощью различных методов, включая EMR и ESD.[6] Для людей с локализованным раком предпочтительным лечением является полное хирургическое удаление с адекватными границами с попыткой излечения. Процедура выбора - частичная колэктомия (или проктоколэктомия при поражении прямой кишки), когда пораженная часть толстой или прямой кишки удаляется вместе с частями ее мезоколон и кровоснабжение для облегчения удаления дренажа лимфатический узел. Это можно сделать либо открытым лапаротомия или же лапароскопически, в зависимости от пациента и факторов поражения.[18] Затем толстая кишка может быть повторно соединена, или у человека может быть колостома.[6]
Если есть всего несколько метастазов в печени или легких, их также можно удалить. Иногда химиотерапия используется перед операцией, чтобы уменьшить опухоль перед попыткой ее удаления. Двумя наиболее частыми участками рецидива колоректального рака являются: печень и легкие.[18]
В "Хирургическая резекция метастазов в печень от выживания колоректальной карциномы по данным радикальной резекции печени и прогностическим факторам«Авторы заявили, что хирургическая резекция метастазов в печени считается наиболее эффективным методом лечения метастазов в печени у пациентов с колоректальной карциномой (LMCC) и потенциально является единственным лечебным средством. Их результаты показывают, что если была достигнута радикальная (R0) резекция печени, количество метастазов, их расположение (однодолбарное или двулопастное) и возникновение внепеченочных метастазов не влияли на 3-летнюю выживаемость пациентов.[116]
Химиотерапия
В обоих случаях рака двоеточие и прямая кишка, химиотерапия в некоторых случаях может использоваться в дополнение к хирургическому вмешательству. Решение о добавлении химиотерапии при лечении рака прямой и толстой кишки зависит от стадии заболевания.
При раке толстой кишки I стадии химиотерапия не предлагается, и хирургическое вмешательство является окончательным лечением. Роль химиотерапии при раке толстой кишки II стадии является дискуссионным и обычно не предлагается, если не выявлены такие факторы риска, как опухоль Т4, недифференцированная опухоль, сосудистая и периневральная инвазия или неадекватный забор лимфатических узлов.[117] Также известно, что люди, несущие аномалии генов восстановления несоответствия, не получают пользы от химиотерапии. При раке толстой кишки III и IV стадии химиотерапия является неотъемлемой частью лечения.[18]
Если рак распространился на лимфатический узел или отдаленные органы, что имеет место при раке толстой кишки III и IV стадии соответственно, добавляя химиотерапевтические агенты фторурацил, капецитабин или же оксалиплатин увеличивает продолжительность жизни. Если лимфатические узлы не содержат рака, преимущества химиотерапии спорны. Если рак является широко метастатическим или неоперабельным, лечение проводится. паллиативный. Обычно в этой ситуации может использоваться ряд различных химиотерапевтических препаратов.[18] Химиотерапевтические препараты для этого состояния могут включать: капецитабин, фторурацил, иринотекан, оксалиплатин и UFT.[118] Лекарства капецитабин и фторурацил взаимозаменяемы, при этом капецитабин является пероральным препаратом, а фторурацил - внутривенным лекарством. Некоторые конкретные режимы для CRC используются CAPOX, FOLFOX, ФОЛЬФОКСИРИ, и ФОЛЬФИРИ.[119] Антиангиогенные препараты, такие как бевацизумаб часто добавляются в терапию первой линии. Другой класс препаратов, используемых во второй линии, - это рецептор эпидермального фактора роста ингибиторы, два из которых одобрены FDA. цетуксимаб и панитумумаб.[120]
Основное отличие подхода к лечению рака прямой кишки на низкой стадии заключается во включении лучевой терапии. Часто он используется в сочетании с химиотерапией в неоадъювантной форме, чтобы обеспечить возможность хирургической резекции, так что в конечном итоге колостома не требуется. Однако это может быть невозможно при низкорасположенных опухолях, и в этом случае может потребоваться постоянная колостома. Рак прямой кишки IV стадии лечится аналогично раку толстой кишки IV стадии.
Колоректальный рак IV стадии из-за перитонеальный карциноматоз можно лечить с помощью HIPEC у отдельных пациентов.[121][122][123]
Радиационная терапия
Хотя сочетание радиация и химиотерапия может быть полезна для рак прямой кишки,[18] его использование при раке толстой кишки не является рутинным из-за чувствительности кишечника к радиации.[124] Как и для химиотерапия, лучевая терапия может использоваться в неоадъювантный и адъювант настройка для некоторых этапов рак прямой кишки. При местнораспространенном раке прямой кишки неоадъювантная химиолучевая терапия стала стандартным лечением.[125]
Иммунотерапия
Иммунотерапия с ингибиторами иммунных контрольных точек было обнаружено, что они полезны для типа колоректального рака с несоответствие ремонта дефицит и микроспутниковая нестабильность.[126][127] Пембролизумаб одобрен для лечения запущенных опухолей CRC с дефицитом MMR и неэффективным обычным лечением.[128] Однако у большинства людей, у которых наблюдается улучшение, состояние все равно ухудшается через месяцы или годы.[127] Другие виды колоректального рака по состоянию на 2017 год все еще изучаются.[126][127]
Паллиативная помощь
Паллиативная помощь рекомендуется для любого человека, у которого рак толстой кишки на поздней стадии или у кого есть серьезные симптомы.[129][130]
Привлечение к паллиативной помощи может быть полезным для улучшения качества жизни как человека, так и его или ее семьи за счет улучшения симптомов, беспокойства и предотвращения госпитализации.[131]
У людей с неизлечимым колоректальным раком паллиативная помощь может состоять из процедур, которые облегчают симптомы или осложнения рака, но не пытаются вылечить основной рак, тем самым улучшая качество жизни. Хирургические варианты могут включать немедленное хирургическое удаление части раковой ткани, обход части кишечника или установку стента. Эти процедуры можно рассматривать для улучшения симптомов и уменьшения осложнений, таких как кровотечение из опухоли, боль в животе и кишечная непроходимость.[132] Безоперационные методы симптоматического лечения включают лучевую терапию для уменьшения размера опухоли, а также обезболивающие.[133]
Следовать за
Целью последующего наблюдения является диагностика на самой ранней стадии любых метастазов или опухолей, которые развиваются позже, но не произошли от исходного рака (метахронные поражения).
Соединенные штаты. Национальная комплексная онкологическая сеть и Американское общество клинической онкологии предоставить рекомендации по наблюдению за раком толстой кишки.[134][135] А история болезни и физический осмотр рекомендуются каждые 3-6 месяцев в течение 2 лет, затем каждые 6 месяцев в течение 5 лет. Карциноэмбриональный антиген Измерения уровня в крови выполняются в те же сроки, но рекомендуются только для людей с поражениями T2 или выше, которые являются кандидатами на вмешательство. А Компьютерная томография грудной клетки, брюшной полости и таза можно рассматривать ежегодно в течение первых 3 лет для людей с высоким риском рецидива (например, тех, у кого были плохо дифференцированные опухоли или венозная или лимфатическая инвазия) и которые являются кандидатами на лечебную операцию (с цель вылечить). А колоноскопия может быть выполнено через 1 год, за исключением случаев, когда это нельзя было сделать во время начальной стадии из-за препятствующей массы, и в этом случае это должно быть выполнено через 3–6 месяцев. Если обнаружен ворсинчатый полип, полип> 1 сантиметра или дисплазия высокой степени, это можно повторить через 3 года, а затем каждые 5 лет. При других патологиях колоноскопию можно повторить через 1 год.
Рутина ДОМАШНИЙ ПИТОМЕЦ или же ультразвуковое сканирование, рентген грудной клетки, полный анализ крови или же функциональные пробы печени не рекомендуются.[134][135]
Для людей, перенесших лечебную операцию или адъювантную терапию (или и то, и другое) для лечения неметастатического колоректального рака, не было доказано, что интенсивное наблюдение и тщательное наблюдение обеспечивают дополнительную выживаемость.[136]
Упражнение
В будущем можно рекомендовать упражнения в качестве вторичной терапии выжившим после рака. Согласно эпидемиологическим исследованиям, упражнения могут снизить смертность от рака прямой и прямой кишки и смертность от всех причин. Результаты для определенного количества упражнений, необходимых для наблюдения за положительным эффектом, были противоречивыми. Эти различия могут отражать различия в биологии опухоли и экспрессии биомаркеров. Пациенты с опухолями, которых не хватало CTNNB1 экспрессия (β-катенин), участвующая в Сигнальный путь Wnt, требуется более 18 Метаболический эквивалент (MET) часов в неделю, мера физических упражнений для наблюдения за снижением смертности от колоректального рака. Механизм того, как упражнения приносят пользу выживанию, может быть задействован в иммунном надзоре и путях воспаления. В клинических исследованиях провоспалительный ответ был обнаружен у пациентов с колоректальным раком II-III стадии, которые после завершения первичной терапии в течение 2 недель выполняли умеренные упражнения. Окислительный баланс может быть еще одним возможным механизмом наблюдаемых преимуществ. Значительное снижение уровня 8-oxo-dG было обнаружено в моче пациентов, которые после первичной терапии выполняли 2 недели умеренных физических упражнений. Другие возможные механизмы могут включать метаболические гормоны и половые стероидные гормоны, хотя эти пути могут быть вовлечены в другие типы рака.[137][138]
Другой потенциальный биомаркер может быть стр. 27. Было обнаружено, что выжившие с опухолями, экспрессирующими p27 и выполнявшими больше и равных 18 часам MET в неделю, имели более низкую выживаемость при колоректальном раке по сравнению с теми, у которых было менее 18 часов MET в неделю. У выживших без экспрессии p27, которые тренировались, результаты были хуже. Конститутивная активация Путь PI3K / AKT / mTOR может объяснить потерю p27, а избыточный энергетический баланс может активировать p27, чтобы остановить деление раковых клеток.[138]
Прогноз
В Европе пятилетняя выживаемость для колоректального рака - менее 60%. в разработанный мир около трети заболевших умирают от нее.[18]
Выживаемость напрямую связана с обнаружением и типом рака, но в целом для симптоматических видов рака они плохи, поскольку они, как правило, находятся на довольно поздней стадии. Показатели выживаемости при раннем выявлении рака примерно в пять раз выше, чем при поздних стадиях рака. Люди с опухолью, которая не нарушила мышечная слизистая оболочка (TNM стадии Tis, N0, M0) имеют пятилетнюю выживаемость 100%, тогда как пациенты с инвазивным раком T1 (в подслизистом слое) или T2 (в мышечном слое) имеют средний пятилетний коэффициент выживаемости примерно 90%. Пациенты с более инвазивной опухолью, но без поражения узлов (T3-4, N0, M0), имеют среднюю пятилетнюю выживаемость примерно 70%. Пациенты с положительными регионарными лимфатическими узлами (любые T, N1-3, M0) имеют среднюю пятилетнюю выживаемость примерно 40%, в то время как пациенты с отдаленными метастазами (любые T, любые N, M1) имеют среднюю пятилетнюю выживаемость. около 5% и среднее время выживания 13 месяцев.[139][140]
Средняя пятилетняя частота рецидивов у людей, у которых операция была успешной, составляет 5% для рака I стадии, 12% - для стадии II и 33% - для стадии III. Однако в зависимости от количества факторов риска он колеблется от 9–22% при II стадии до 17–44% при III стадии.[141]
Менее 600 генов связаны с исходами колоректального рака.[45] К ним относятся оба неблагоприятных гена, высокая экспрессия которых связана с плохим исходом, например, белок 1 теплового шока 70 кДа (HSPA1A), и благоприятные гены, где высокая экспрессия связана с лучшей выживаемостью, например предполагаемый РНК-связывающий белок 3 (RBM3).[45]
Эпидемиология
Ежегодно более 1 миллиона человек во всем мире заболевают колоректальным раком.[18] в результате чего по состоянию на 2010 год погибло около 715 000 человек по сравнению с 490 000 в 1990 году.[142]
По состоянию на 2012 год[Обновить], это вторая по частоте причина рака у женщин (9,2% диагнозов) и третья по частоте у мужчин (10,0%).[12]:16 он является четвертой по частоте причиной смерти от рака после легкое, желудок, и рак печени.[143] Это чаще встречается в развитых, чем в развивающихся странах.[144] Заболеваемость во всем мире различается в 10 раз: самые высокие показатели в Австралии, Новой Зеландии, Европе и США, а самые низкие - в Африке и Южной и Центральной Азии.[145]
Соединенные Штаты
Колоректальный рак является второй по величине причиной возникновения рака и смерти мужчин и женщин в Соединенных Штатах вместе взятых. По оценкам, в 2011 году было диагностировано 141 210 случаев.[146]
По данным с 2007 по 2009 год, у 5,0% рожденных сегодня мужчин и женщин в США будет диагностирован колоректальный рак в течение их жизни.[147] С 2005 по 2009 год средний возраст постановки диагноза рака толстой и прямой кишки в США составлял 69 лет. Примерно 0,1% были диагностированы в возрасте до 20 лет; 1,1% от 20 до 34 лет; 4,0% в возрасте от 35 до 44 лет; 13,4% в возрасте от 45 до 54 лет; 20,4% в возрасте от 55 до 64 лет; 24,0% в возрасте от 65 до 74 лет; 25,0% от 75 до 84; и 12,0% в возрасте 85+ лет. Показатели выше среди мужчин (54 на 100 000 c.f. 40 на 100 000 для женщин).
объединенное Королевство
В Великобритании около 41 000 человек в год заболевают раком толстой кишки, что делает его четвертым по распространенности типом.[148]
Австралия
Каждый 19 мужчина и каждая 28 женщина в Австралии заболевают колоректальным раком в возрасте до 75 лет; у каждого 10-го мужчины и у каждой 15-й женщины оно разовьется к 85 годам.[149]
История
Рак прямой кишки был диагностирован еще в Древнем Египте. Мама кто жил в Дахле Оазис вовремя Птолемеев период.[150]
Общество и культура
В США март месяц осведомленности о колоректальном раке.[97]
Исследование
Предварительный in vitro доказательства предполагают молочнокислые бактерии (например., лактобациллы, стрептококки или же лактококки) может защищать от развития и прогрессирования колоректального рака с помощью нескольких механизмов, таких как антиоксидант Мероприятия, иммуномодуляция, продвижение запрограммированная гибель клеток, антипролиферативные эффекты, и эпигенетический модификация раковых клеток.[151]
Мышиные модели колоректального и кишечного рака разработаны и используются в исследованиях.[152][153][154]
- Атлас генома рака[47]
- Был разработан Атлас колоректального рака, объединяющий геномные и протеомные данные, относящиеся к тканям и клеточным линиям колоректального рака.[155]
Рекомендации
- ^ а б c d е «Общие сведения о раке толстой кишки». NCI. 12 мая 2014 года. В архиве из оригинала 4 июля 2014 г.. Получено 29 июня, 2014.
- ^ а б c d е ж грамм час я j k л Bosman FT (2014). «Глава 5.5: Колоректальный рак». В Stewart BW, Wild CP (ред.). Всемирный доклад о раке. Международное агентство по изучению рака Всемирной организации здравоохранения. С. 392–402. ISBN 978-92-832-0443-5.
- ^ а б c «Профилактика колоректального рака (PDQ®)». Национальный институт рака. 27 февраля 2014 г. В архиве из оригинала 5 июля 2014 г.. Получено 29 июня, 2014.
- ^ а б Теодорату Э., Тимофеева М., Ли X, Менг X, Иоаннидис JP (август 2017 г.). «Природа, питание и риски рака: генетические факторы и влияние питания на рак». Ежегодный обзор питания (Рассмотрение). 37: 293–320. Дои:10.1146 / annurev-nutr-071715-051004. ЧВК 6143166. PMID 28826375.
- ^ а б c d е ж грамм час Биббинс-Доминго К., Гроссман Д.К., Карри С.Дж., Дэвидсон К.В., Эплинг Д.В., Гарсия Ф.А., Гиллман М.В., Харпер Д.М., Кемпер А.Р., Крист А.Х., Курт А.Э., Ландефельд К.С., Манджоне С.М., Оуэнс Д.К., Филлипс В. Pignone MP, Siu AL (июнь 2016 г.). «Скрининг колоректального рака: Рекомендация рабочей группы США по профилактическим услугам». JAMA. 315 (23): 2564–2575. Дои:10.1001 / jama.2016.5989. PMID 27304597.
- ^ а б c d е ж грамм «Лечение рака толстой кишки (PDQ®)». NCI. 12 мая 2014 года. В архиве из оригинала 5 июля 2014 г.. Получено 29 июня, 2014.
- ^ а б "Информационные бюллетени SEER Stat: рак толстой и прямой кишки". NCI. В архиве с оригинала от 24 июня 2014 г.. Получено 18 июня, 2014.
- ^ Вос Т., Барбер Р.М., Белл Б., Бертоцци-Вилла А, Бирюков С., Боллигер И. и др. (Соавторы исследования ГББ 2015 по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 310 заболеваний и травм, 1990–2015 гг .: систематический анализ для исследования глобального бремени болезней 2015 г.». Ланцет. 388 (10053): 1545–1602. Дои:10.1016 / S0140-6736 (16) 31678-6. ЧВК 5055577. PMID 27733282.
- ^ а б Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. (ноябрь 2018 г.). «Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире». Ca. 68 (6): 394–424. Дои:10.3322 / caac.21492. PMID 30207593. S2CID 52188256.
- ^ Торат М.А., Кузик Дж. (Декабрь 2013 г.). «Роль аспирина в профилактике рака». Текущие онкологические отчеты. 15 (6): 533–540. Дои:10.1007 / s11912-013-0351-3. PMID 24114189. S2CID 40187047.
- ^ «Обычный прием аспирина или нестероидных противовоспалительных препаратов для первичной профилактики колоректального рака: изложение рекомендаций». Американский семейный врач. 76 (1): 109–113. Июль 2007 г. PMID 17668849. В архиве из оригинала 14 июля 2014 г.
- ^ а б Форман Д., Ферлей Дж. (2014). «Глава 1.1: Глобальное и региональное бремя рака». В Stewart BW, Wild CP (ред.). Всемирный доклад о раке. Международное агентство по изучению рака Всемирной организации здравоохранения. С. 16–53. ISBN 978-92-832-0443-5.
- ^ Альперс Д.Х., Каллоо А.Н., Капловиц Н., Овьянг С., Пауэлл Д.В. (2008). Ямада Т. (ред.). Принципы клинической гастроэнтерологии. Чичестер, Западный Сассекс: Уайли-Блэквелл. п. 381. ISBN 978-1-4051-6910-3. В архиве из оригинала от 28 сентября 2015 г.
- ^ Юул Дж. С., Хорнунг Н., Андерсен Б., Лаурберг С., Олесен Ф., Ведстед П. (август 2018 г.). «Ценность использования иммунохимического теста фекалий в общей практике у пациентов с нетревожными симптомами колоректального рака». Британский журнал рака. 119 (4): 471–479. Дои:10.1038 / s41416-018-0178-7. ЧВК 6133998. PMID 30065255.
- ^ а б Эстин М., Гриффин, Т., Нил, Р. Д., Роуз, П., Гамильтон, В. (май 2011 г.). «Диагностическая ценность симптомов колоректального рака в первичной медико-санитарной помощи: систематический обзор». Британский журнал общей практики. 61 (586): 231–243. Дои:10.3399 / bjgp11X572427. ЧВК 3080228. PMID 21619747.
- ^ Адельштейн Б.А., Макаскилл П., Чан С.Ф., Кателарис П.Х., Ирвиг Л. (май 2011 г.). «Большинство симптомов рака кишечника не указывают на колоректальный рак и полипы: систематический обзор». BMC Гастроэнтерология. 11: 65. Дои:10.1186 / 1471-230X-11-65. ЧВК 3120795. PMID 21624112.
- ^ а б Уотсон А.Дж., Коллинз П.Д. (2011). «Рак толстой кишки: цивилизационное расстройство». Пищеварительные заболевания. 29 (2): 222–228. Дои:10.1159/000323926. PMID 21734388. S2CID 7640363.
- ^ а б c d е ж грамм час я j k л м п о п q р s т Каннингем Д., Аткин В., Ленц Х. Дж., Линч Х. Т., Мински Б., Нордлингер Б., Старлинг Н. (март 2010 г.). "Колоректальный рак". Ланцет. 375 (9719): 1030–1047. Дои:10.1016 / S0140-6736 (10) 60353-4. PMID 20304247. S2CID 25299272.
- ^ а б «Отчет о колоректальном раке за 2011 год: еда, питание, физическая активность и профилактика колоректального рака» (PDF). Всемирный фонд исследований рака и Американский институт исследований рака. 2011 г. В архиве (PDF) из оригинала от 9 сентября 2016 г.
- ^ Ли И.М., Широма Э.Д., Лобело Ф., Пуска П., Блэр С.Н., Кацмарзик П.Т. (июль 2012 г.). «Влияние отсутствия физической активности на основные неинфекционные заболевания во всем мире: анализ бремени болезней и ожидаемой продолжительности жизни». Ланцет. 380 (9838): 219–229. Дои:10.1016 / S0140-6736 (12) 61031-9. ЧВК 3645500. PMID 22818936.
- ^ Fedirko V, Tramacere I, Bagnardi V, Rota M, Scotti L, Islami F, Negri E, Straif K, Romieu I, La Vecchia C, Boffetta P, Jenab M (сентябрь 2011 г.). «Риск употребления алкоголя и колоректального рака: общий метаанализ и метаанализ зависимости от дозы опубликованных исследований». Анналы онкологии. 22 (9): 1958–1972. Дои:10.1093 / annonc / mdq653. PMID 21307158.
- ^ Валтин Х (ноябрь 2002 г.). ""Выпивайте не менее восьми стаканов воды в день. »Правда? Есть ли научные доказательства того, что« 8 x 8 »?». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 283 (5): R993–1004. Дои:10.1152 / ajpregu.00365.2002. PMID 12376390. S2CID 2256436.
- ^ Болей А., ван Гельдер М. М., Свинкельс Д. В., Тьялсма Н. (ноябрь 2011 г.). «Клиническое значение инфекции Streptococcus gallolyticus среди пациентов с колоректальным раком: систематический обзор и метаанализ». Клинические инфекционные болезни. 53 (9): 870–878. Дои:10.1093 / cid / cir609. PMID 21960713.
- ^ Янс С., Мейле Л., Лакруа С., Стивенс М.Дж. (июль 2015 г.). «Геномика, эволюция и молекулярная эпидемиология комплекса Streptococcus bovis / Streptococcus equinus (SBSEC)». Инфекция, генетика и эволюция. 33: 419–436. Дои:10.1016 / j.meegid.2014.09.017. PMID 25233845.
- ^ а б c Абдуламир А.С., Хафиз Р.Р., Абу Бакар Ф. (январь 2011 г.). «Связь Streptococcus bovis / gallolyticus с колоректальными опухолями: природа и механизмы, лежащие в основе его этиологической роли». Журнал экспериментальных и клинических исследований рака. 30 (1): 11. Дои:10.1186/1756-9966-30-11. ЧВК 3032743. PMID 21247505.
 Эта статья включает текст Ахмед С. Абдуламир, Ранд Р. Хафид и Фатима Абу Бакар, доступный под CC BY 2.0 лицензия.
Эта статья включает текст Ахмед С. Абдуламир, Ранд Р. Хафид и Фатима Абу Бакар, доступный под CC BY 2.0 лицензия. - ^ Джавад Н., Дирекзе Н., Лидхэм С.Дж. (2011). «Воспалительное заболевание кишечника и рак толстой кишки». Воспаление и рак желудочно-кишечного тракта. Последние результаты исследований рака. 185. С. 99–115. Дои:10.1007/978-3-642-03503-6_6. ISBN 978-3-642-03502-9. PMID 21822822.
- ^ Ху Т, Ли Л.Ф., Шен Дж., Чжан Л., Чо Ч. (2015). «Хроническое воспаление и колоректальный рак: роль фактора роста эндотелия сосудов». Текущий фармацевтический дизайн. 21 (21): 2960–2967. Дои:10.2174/1381612821666150514104244. PMID 26004415.
- ^ а б c d Триантафиллидис Дж. К., Насиулас Г., Космидис П. А. (июль 2009 г.). «Колоректальный рак и воспалительные заболевания кишечника: эпидемиология, факторы риска, механизмы канцерогенеза и стратегии профилактики». Противораковые исследования. 29 (7): 2727–2737. PMID 19596953.
- ^ а б Пока, WA, Nguyen TM, Parker CE, Jairath V, East JE (сентябрь 2017 г.). «Стратегии выявления рака толстой кишки у пациентов с воспалительным заболеванием кишечника». Кокрановская база данных систематических обзоров. 9: CD000279. Дои:10.1002 / 14651858.cd000279.pub4. ЧВК 6483622. PMID 28922695.
- ^ Джун Э., Хачемун А. (2010). «Синдром Гарднера: кожные проявления, дифференциальная диагностика и лечение». Американский журнал клинической дерматологии. 11 (2): 117–122. Дои:10.2165/11311180-000000000-00000. PMID 20141232. S2CID 36836169.
- ^ Половина Е, Беркович Д., Розен П. (октябрь 2009 г.). «Семейный аденоматозный полипоз». Журнал редких заболеваний Orphanet. 4: 22. Дои:10.1186/1750-1172-4-22. ЧВК 2772987. PMID 19822006.
- ^ Möslein G, Pistorius S, Saeger H, Schackert HK (февраль 2003 г.). «Профилактическая хирургия рака толстой кишки при семейном аденоматозном полипозе и синдроме наследственного неполипоза колоректального рака». Langenbecks Arch. Surg. 388 (1): 9–16. Дои:10.1007 / s00423-003-0364-8. PMID 12690475. S2CID 21385340.
- ^ Манканей Дж., Руфаэль С., Берк, Калифорния (апрель 2020 г.). «Синдром зубчатого полипоза». Клиническая гастроэнтерология и гепатология. 18 (4): 777–779. Дои:10.1016 / j.cgh.2019.09.006. PMID 31520728.
- ^ Вентилятор C, Юнис A, Bookhout CE, Crockett SD (март 2018 г.). «Лечение зубчатых полипов толстой кишки». Современные варианты лечения в гастроэнтерологии. 16 (1): 182–202. Дои:10.1007 / s11938-018-0176-0. ЧВК 6284520. PMID 29445907.
- ^ Бурдэ Р., Руссо Б., Пухальс А., Буссион Н., Жоли С., Гийемен А. и др. (Май 2017). «Мутации домена корректирующего считывания полимеразы: новые возможности иммунотерапии при гипермутированном колоректальном раке помимо дефицита MMR». Критические обзоры в онкологии / гематологии. 113: 242–248. Дои:10.1016 / j.critrevonc.2017.03.027. PMID 28427513.
- ^ Штейн Ю., Вальтер В., Арльт Ф., Швабе Х., Смит Дж., Фихтнер И., Бирчмайер В., Шлаг PM (январь 2009 г.). «MACC1, недавно идентифицированный ключевой регулятор передачи сигналов HGF-MET, предсказывает метастазирование рака толстой кишки». Природа Медицина. 15 (1): 59–67. Дои:10,1038 / нм.1889. PMID 19098908. S2CID 8854895.
- ^ Stein U (2013) MACC1 - новая мишень для солидного рака. Экспертное мнение Ther Target
- ^ Schuebel KE, Chen W, Cope L, Glöckner SC, Suzuki H, Yi JM, Chan TA, Van Neste L, Van Criekinge W., van den Bosch S, van Engeland M, Ting AH, Jair K, Yu W, Toyota M, Имаи К, Ахуджа Н, Герман Дж. Г., Байлин С.Б. (Сентябрь 2007 г.). «Сравнение гиперметилома ДНК с генными мутациями при колоректальном раке человека». PLOS Genetics. 3 (9): 1709–1723. Дои:10.1371 / journal.pgen.0030157. ЧВК 1988850. PMID 17892325.
- ^ «Какая связь между евреями-ашкеназами и колоректальным раком?». WebMD. Получено 17 октября, 2019.
- ^ Ионов Ю., Пейнадо М.А., Малхосян С., Шибата Д., Перучо М. (1993). «Повсеместные соматические мутации в простых повторяющихся последовательностях раскрывают новый механизм канцерогенеза толстой кишки». Природа. 363 (6429): 558–561. Bibcode:1993Натура.363..558I. Дои:10.1038 / 363558a0. PMID 8505985. S2CID 4254940.
- ^ Чакраварти С., Кришнан Б., Мадхаван М. (1999). «Апоптоз и экспрессия р53 в колоректальных новообразованиях». Indian J. Med. Res. 86 (7): 95–102.
- ^ Халек Ф.Дж., Галликано Г.И., Мишра Л. (май 2010 г.). «Стволовые клетки рака толстой кишки». Гастроинтест. Cancer Res. (Приложение 1): S16 – S23. ЧВК 3047031. PMID 21472043.
- ^ а б c d Марковиц С.Д., Бертаньолли М.М. (декабрь 2009 г.). «Молекулярное происхождение рака: молекулярная основа колоректального рака». N. Engl. J. Med. 361 (25): 2449–2460. Дои:10.1056 / NEJMra0804588. ЧВК 2843693. PMID 20018966.
- ^ Mehlen P, Fearon ER (август 2004 г.). «Роль рецепторной зависимости DCC в патогенезе колоректального рака». J. Clin. Онкол. 22 (16): 3420–3428. Дои:10.1200 / JCO.2004.02.019. PMID 15310786.
- ^ а б c Uhlen M, Zhang C, Lee S, Sjöstedt E, Fagerberg L, Bidkhori G, Benfeitas R, Arif M, Liu Z, Edfors F, Sanli K, von Feilitzen K, Oksvold P, Lundberg E, Hober S, Nilsson P, Mattsson J, Schwenk JM, Brunnström H, Glimelius B, Sjöblom T., Edqvist PH, Djureinovic D, Micke P, Lindskog C, Mardinoglu A, Ponten F (август 2017 г.). «Атлас патологии транскриптома рака человека». Наука. 357 (6352): eaan2507. Дои:10.1126 / science.aan2507. PMID 28818916.
- ^ Фогельштейн Б., Кинцлер К.В. (август 2004 г.). «Раковые гены и пути, которые они контролируют». Природа Медицина. 10 (8): 789–799. Дои:10,1038 / нм1087. PMID 15286780. S2CID 205383514.
- ^ а б c Сеть Атласа генома рака (июль 2012 г.). «Комплексная молекулярная характеристика рака толстой и прямой кишки человека». Природа. 487 (7407): 330–337. Bibcode:2012Натура 487..330Т. Дои:10.1038 / природа11252. ЧВК 3401966. PMID 22810696.
- ^ Gatalica Z, Vranic S, Xiu J, Swensen J, Reddy S (июль 2016 г.). «Колоректальная карцинома с высокой микросателлитной нестабильностью (MSI-H): краткий обзор прогностических биомаркеров в эпоху персонализированной медицины». Семейный рак. 15 (3): 405–12. Дои:10.1007 / s10689-016-9884-6. ЧВК 4901118. PMID 26875156.
- ^ а б c Райан Э., Шихан К., Кревин Б., Мохан Х.М., Зимний округ Колумбия (август 2017 г.). «Текущее значение определения статуса несоответствия восстановления колоректального рака: обоснование для рутинного тестирования». Критические обзоры в онкологии / гематологии. 116: 38–57. Дои:10.1016 / j.critrevonc.2017.05.006. PMID 28693799.
- ^ Hissong E, Crowe EP, Yantiss RK, Chen YT (ноябрь 2018 г.). «Оценка статуса исправления несоответствия при колоректальном раке в современную эпоху: обзор текущей практики и переоценка роли тестирования микросателлитной нестабильности». Современная патология. 31 (11): 1756–1766. Дои:10.1038 / s41379-018-0094-7. PMID 29955148.
- ^ а б c d Грэди В. М., Марковиц С. Д. (март 2015 г.). «Молекулярный патогенез колоректального рака и его потенциальное применение для скрининга колоректального рака». Пищеварительные заболевания и науки. 60 (3): 762–772. Дои:10.1007 / s10620-014-3444-4. ЧВК 4779895. PMID 25492499.
- ^ Slaughter DP, Southwick HW, Smejkal W (сентябрь 1953 г.). «Полевая канцеризация в многослойном плоском эпителии полости рта; клинические последствия мультицентрического происхождения». Рак. 6 (5): 963–968. Дои:10.1002 / 1097-0142 (195309) 6: 5 <963 :: AID-CNCR2820060515> 3.0.CO; 2-Q. PMID 13094644.
- ^ Джованнуччи Э, Огино С (сентябрь 2005 г.). «Метилирование ДНК, эффекты поля и колоректальный рак». Журнал Национального института рака. 97 (18): 1317–1319. Дои:10.1093 / jnci / dji305. PMID 16174847.
- ^ Бернштейн С., Бернштейн Х., Пейн С.М., Дворжак К., Гарвал Х. (февраль 2008 г.). «Дефекты поля в прогрессировании рака желудочно-кишечного тракта». Письма о раке. 260 (1–2): 1–10. Дои:10.1016 / j.canlet.2007.11.027. ЧВК 2744582. PMID 18164807.
- ^ Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (июль 2010 г.). «Дефицит Pms2, ERCC1, Ku86, CcOI в полевых дефектах при прогрессировании рака толстой кишки». Журнал визуализированных экспериментов (41): 1931. Дои:10.3791/1931. ЧВК 3149991. PMID 20689513. 28-минутное видео
- ^ Рубин Х (март 2011 г.). «Поля и полевая канцеризация: пренеопластическое происхождение рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отслеживать по плотности насыщения в культуре». BioEssays. 33 (3): 224–231. Дои:10.1002 / bies.201000067. PMID 21254148.
- ^ Цао Дж. Л., Ятабэ Ю., Саловаара Р., Ярвинен Х. Дж., Меклин Дж. П., Аалтонен Л. А., Таваре С., Шибата Д. (февраль 2000 г.). «Генетическая реконструкция истории индивидуальных колоректальных опухолей». Труды Национальной академии наук Соединенных Штатов Америки. 97 (3): 1236–1241. Bibcode:2000PNAS ... 97.1236T. Дои:10.1073 / pnas.97.3.1236. ЧВК 15581. PMID 10655514.
- ^ а б Фогельштейн Б., Пападопулос Н., Велкулеску В.Э., Чжоу С., Диас Л.А., Кинзлер К.В. (март 2013 г.). «Пейзажи генома рака». Наука. 339 (6127): 1546–1558. Bibcode:2013Научный ... 339.1546V. Дои:10.1126 / наука.1235122. ЧВК 3749880. PMID 23539594.
- ^ Лоххед П., Чан А.Т., Нишихара Р., Фукс С.С., Бек А.Х., Джованнуччи Е., Огино С. (январь 2015 г.). «Этиологический полевой эффект: переоценка концепции полевого эффекта в предрасположенности и прогрессировании рака». Современная патология. 28 (1): 14–29. Дои:10.1038 / modpathol.2014.81. ЧВК 4265316. PMID 24925058.
- ^ Канвал Р., Гупта С. (апрель 2012 г.). «Эпигенетические модификации рака». Клиническая генетика. 81 (4): 303–311. Дои:10.1111 / j.1399-0004.2011.01809.x. ЧВК 3590802. PMID 22082348.
- ^ а б Шнекенбургер М., Дидерих М. (март 2012 г.). «Эпигенетика открывает новые горизонты профилактики колоректального рака». Текущие отчеты о колоректальном раке. 8 (1): 66–81. Дои:10.1007 / s11888-011-0116-z. ЧВК 3277709. PMID 22389639.
- ^ а б c d Лао В.В., Грэди В.М. (октябрь 2011 г.). «Эпигенетика и колоректальный рак». Обзоры природы. Гастроэнтерология и гепатология. 8 (12): 686–700. Дои:10.1038 / nrgastro.2011.173. ЧВК 3391545. PMID 22009203.
- ^ Klutstein M, Nejman D, Greenfield R, Cedar H (июнь 2016 г.). «Метилирование ДНК при раке и старении». Исследования рака. 76 (12): 3446–3450. Дои:10.1158 / 0008-5472.CAN-15-3278. PMID 27256564.
- ^ Хасинто Ф.В., Эстеллер М (июль 2007 г.). «Мутаторные пути, вызванные эпигенетическим подавлением рака человека». Мутагенез. 22 (4): 247–253. Дои:10.1093 / mutage / gem009. PMID 17412712.
- ^ Lahtz C, Pfeifer GP (февраль 2011 г.). «Эпигенетические изменения генов репарации ДНК при раке». Журнал молекулярной клеточной биологии. 3 (1): 51–58. Дои:10.1093 / jmcb / mjq053. ЧВК 3030973. PMID 21278452.
- ^ Бернштейн С., Нфонсам В., Прасад А. Р., Бернштейн Н. (март 2013 г.). «Дефекты эпигенетического поля в прогрессировании рака». Всемирный журнал онкологии желудочно-кишечного тракта. 5 (3): 43–49. Дои:10.4251 / wjgo.v5.i3.43. ЧВК 3648662. PMID 23671730.
- ^ Coppedè F, Lopomo A, Spisni R, Migliore L (январь 2014 г.). «Генетические и эпигенетические биомаркеры для диагностики, прогноза и лечения колоректального рака». Всемирный журнал гастроэнтерологии. 20 (4): 943–956. Дои:10.3748 / wjg.v20.i4.943. ЧВК 3921546. PMID 24574767.
- ^ Канг Х., О'Коннелл Дж. Б., Леонарди М. Дж., Маггард М. А., МакГори М. Л., Ко CY (февраль 2007 г.). «Редкие опухоли толстой и прямой кишки: национальный обзор». Международный журнал колоректальных заболеваний. 22 (2): 183–9. Дои:10.1007 / s00384-006-0145-2. PMID 16845516. S2CID 34693873.
- ^ «Эквивалентные термины и определения толстой кишки, ректосигмоидной и прямой кишки C180-C189, C199, C209 (за исключением лимфомы и лейкемии M9590 - M9992 и саркомы Капоши M9140) - Правила для солидных опухолей толстой кишки 2018 г. Обновление за июль 2019 г.» (PDF). Национальный институт рака.
- ^ «Типы колоректального рака». Центры лечения рака Америки. 4 октября 2018 г.. Получено 16 января, 2020.
- ^ Ди Комо Дж. А., Махендрарадж К., Лау К. С., Чемберлен Р. С. (октябрь 2015 г.). «Аденосквамозная карцинома толстой и прямой кишки: популяционное исследование клинических результатов с участием 578 пациентов из базы данных эпидемиологии и конечных результатов эпиднадзора (SEER) (1973–2010)». Журнал Американского колледжа хирургов. 221 (4): 56. Дои:10.1016 / j.jamcollsurg.2015.08.044.
- ^ «Определение стадии колоректального рака по TNM (8-е издание AJCC)». www.pathologyoutlines.com. Получено 24 февраля, 2019.
- ^ Паркин Д.М., Бойд Л., Уокер Л.С. (декабрь 2011 г.). «16. Доля рака, связанного с образом жизни и факторами окружающей среды в Великобритании в 2010 г.». Британский журнал рака. 105 Дополнение 2 (S2): S77–81. Дои:10.1038 / bjc.2011.489. ЧВК 3252065. PMID 22158327.
- ^ Сирк Д. (2006). Эпидемиология и профилактика рака (3-е изд.). Издательство Оксфордского университета. п. 809. ISBN 978-0199747979. В архиве из оригинала от 28 сентября 2015 г.
- ^ Реннерт Дж. (2007). Профилактика рака. Springer. п. 179. ISBN 978-3540376965. В архиве с оригинала 3 октября 2015 г.
- ^ а б «Обзор профилактики колоректального рака». Национальный институт рака. 1 марта 2018 г.. Получено 26 октября, 2018.
- ^ «Профилактика рака». Всемирная организация здоровья. Получено 27 октября, 2018.
- ^ Лауби-Секретан Б., Скоччанти С., Лумис Д., Гросс Ю., Бьянкини Ф., Стрейф К. (август 2016 г.). «Жирность и рак - точка зрения рабочей группы МАИР» (PDF). Медицинский журнал Новой Англии. 375 (8): 794–798. Дои:10.1056 / неймср1606602. ЧВК 6754861. PMID 27557308.
- ^ Уиллетт WC (2014). «Диета, питание и рак: что дальше с общественным здравоохранением?». В Stewart BW, Wild CP (ред.). Всемирный доклад о раке. Международное агентство по изучению рака Всемирной организации здравоохранения. С. 432–435. ISBN 978-92-832-0443-5.
- ^ а б Виллетт WC, Ки Т, Ромье I (2014). «Глава 2.6: Диета, ожирение и физическая активность». В Stewart BW, Wild CP (ред.). Всемирный доклад о раке. Международное агентство по изучению рака Всемирной организации здравоохранения. С. 124–133. ISBN 978-92-832-0443-5.
Несколько крупных проспективных когортных исследований диетической клетчатки и риска рака толстой кишки не подтвердили связь, хотя обратная связь была замечена в большом исследовании European Prospective Investigation of Cancer and Nutrition (EPIC) и недавнем метаанализе. Необходимо лучше понять различия в результатах проспективных исследований; пищевые волокна сложны и неоднородны, и связь с колоректальным раком может различаться в зависимости от источника питания. (стр.127)
- ^ "Описание доказательств профилактики колоректального рака". Национальный институт рака. 1 марта 2018 г.. Получено 26 октября, 2018.
- ^ Рейнольдс А., Манн Дж., Каммингс Дж., Винтер Н., Мете Э, Те Моренга Л. (февраль 2019 г.). «Качество углеводов и здоровье человека: серия систематических обзоров и метаанализов». Ланцет. 393 (10170): 434–445. Дои:10.1016 / S0140-6736 (18) 31809-9. PMID 30638909. S2CID 58632705.
- ^ Song M, Chan AT (январь 2019). «Факторы окружающей среды, кишечная микробиота и профилактика колоректального рака». Клиническая гастроэнтерология и гепатология. 17 (2): 275–289. Дои:10.1016 / j.cgh.2018.07.012. ЧВК 6314893. PMID 30031175.
Несмотря на давнюю гипотезу о том, что диета с высоким содержанием клетчатки может защитить от колоректального рака ... эпидемиологические исследования, связывающие потребление пищевых волокон с последующим риском колоректального рака, дали противоречивые результаты ... Тем не менее, на основе имеющихся данных самый последний экспертный отчет от Всемирный фонд исследований рака и Американский институт исследований рака в 2017 году пришли к выводу, что есть вероятные доказательства
- ^ Перес-Куэто FJ, Verbeke W (апрель 2012 г.). «Потребительские последствия постоянного обновления WCRF по колоректальному раку». Наука о мясе. 90 (4): 977–978. Дои:10.1016 / j.meatsci.2011.11.032. PMID 22196090.
- ^ Харрис Д. Д., Аткинсон Дж., Баттерхэм А., Джордж К., Кейбл Н. Т., Рейли Т., Хабуби Н., Ренехан А. Г. (сентябрь 2009 г.). «Факторы образа жизни и риск колоректального рака (2): систематический обзор и метаанализ ассоциаций с физической активностью в свободное время». Колоректальное заболевание. 11 (7): 689–701. Дои:10.1111 / j.1463-1318.2009.01767.x. PMID 19207713.
- ^ Робсам Т.Е., Агнес Б., Хьяртокер А., Лангсет Х., Брей ФИ, Ларсен И.К. (ноябрь 2013 г.). «Индекс массы тела, физическая активность и колоректальный рак по анатомическим подразделам: систематический обзор и метаанализ когортных исследований». Европейский журнал профилактики рака. 22 (6): 492–505. Дои:10.1097 / CEJ.0b013e328360f434. PMID 23591454. S2CID 24764995.
- ^ Кю Х. Х., Бахман В. Ф., Александр Л. Т., Мамфорд Дж. Э., Афшин А., Эстеп К., Вирман Дж. Л., Делвиче К., Ианнарон М. Л., Мойер М. Л., Серси К., Вос Т., Мюррей С. Дж., Фоузанфар М. «Физическая активность и риск рака груди, рака толстой кишки, диабета, ишемической болезни сердца и ишемического инсульта: систематический обзор и метаанализ« доза-реакция »для исследования глобального бремени болезней 2013». BMJ. 354: i3857. Дои:10.1136 / bmj.i3857. ЧВК 4979358. PMID 27510511.
- ^ Бисвас А., О, П.И., Фолкнер Г.Е., Баджадж Р.Р., Сильвер М.А., Митчелл М.С., Альтер Д.А. (январь 2015 г.). «Малоподвижный образ жизни и его связь с риском заболеваемости, смертности и госпитализации взрослых: систематический обзор и метаанализ». Анналы внутренней медицины. 162 (2): 123–132. Дои:10.7326 / M14-1651. PMID 25599350. S2CID 7256176.
- ^ Купер К., Сквайрс Х., Кэрролл С., Папайоанну Д., Бут А, Логан Р.Ф., Магуайр С., Хинд Д., Таппенден П. (июнь 2010 г.). «Химиопрофилактика колоректального рака: систематический обзор и экономическая оценка». Оценка медицинских технологий. 14 (32): 1–206. Дои:10,3310 / hta14320. PMID 20594533.
- ^ Эмильссон Л., Холм Э, Бреттауэр М., Кук Н. Р., Бьюринг Дж. Э., Лёберг М., Адами Х.О., Sesso HD, Газиано М. Дж., Калагер М. (январь 2017 г.). «Систематический обзор с метаанализом: сравнительная эффективность аспирина по сравнению со скринингом для профилактики колоректального рака». Пищевая фармакология и терапия. 45 (2): 193–204. Дои:10.1111 / apt.13857. PMID 27859394.
- ^ Биббинс-Доминго К. (июнь 2016 г.). «Использование аспирина для первичной профилактики сердечно-сосудистых заболеваний и колоректального рака: Рекомендация рабочей группы США по профилактическим услугам». Анналы внутренней медицины. 164 (12): 836–845. Дои:10.7326 / M16-0577. PMID 27064677.
- ^ Агентство медицинских исследований и качества. «Аспирин или нестероидные противовоспалительные препараты для первичной профилактики колоректального рака». Министерство здравоохранения и социальных служб США. В архиве с оригинала от 5 января 2016 г.
2010/2011
- ^ Weingarten MA, Zalmanovici A, Yaphe J (январь 2008 г.). «Пищевые добавки с кальцием для предотвращения колоректального рака и аденоматозных полипов». Кокрановская база данных систематических обзоров (1): CD003548. Дои:10.1002 / 14651858.CD003548.pub4. PMID 18254022.
- ^ Ма И, Чжан П, Ван Ф, Ян Дж, Лю З, Цинь Х (октябрь 2011 г.). «Связь между витамином D и риском колоректального рака: систематический обзор проспективных исследований». Журнал клинической онкологии. 29 (28): 3775–3782. Дои:10.1200 / JCO.2011.35.7566. PMID 21876081.
- ^ Инь Л., Гранди Н., Раум Э, Хауг Ю., Арндт В., Бреннер Х (2011). «Мета-анализ: витамин D в сыворотке крови и риск колоректальной аденомы». Профилактическая медицина. 53 (1–2): 10–16. Дои:10.1016 / j.ypmed.2011.05.013. PMID 21672549.
- ^ «Что я могу сделать, чтобы снизить риск развития колоректального рака?». Центры по контролю и профилактике заболеваний. 2 апреля 2014 г. В архиве из оригинала 26 февраля 2015 г.. Получено 5 марта, 2015.
- ^ а б He J, Efron JE (2011). «Скрининг на колоректальный рак». Достижения в хирургии. 45: 31–44. Дои:10.1016 / j.yasu.2011.03.006. HDL:2328/11906. PMID 21954677.
- ^ Сигел Р.Л., Уорд Э.М., Джемал А. (март 2012 г.). «Тенденции заболеваемости колоректальным раком в США по локализации и стадии опухоли, 1992–2008 гг.». Эпидемиология, биомаркеры и профилактика рака. 21 (3): 411–416. Дои:10.1158 / 1055-9965.EPI-11-1020. PMID 22219318.
- ^ Swartz AW, Eberth JM, Josey MJ, Strayer SM (октябрь 2017 г.). «Повторный анализ смертности от всех причин в Докладе о фактических данных Целевой группы по профилактическим услугам США за 2016 год по скринингу на колоректальный рак». Анналы внутренней медицины. 167 (8): 602–603. Дои:10.7326 / M17-0859. ЧВК 5823607. PMID 28828493.
- ^ Hewitson P, Glasziou P, Watson E, Towler B, Irwig L (июнь 2008 г.). «Кокрановский систематический обзор скрининга колоректального рака с использованием анализа кала на скрытую кровь (гемоккульт): обновленная информация». Американский журнал гастроэнтерологии. 103 (6): 1541–1549. PMID 18479499.
- ^ Ли Дж. К., Лайлс Э. Г., Бент С., Левин Т. Р., Корли Д. А. (февраль 2014 г.). «Точность иммунохимических тестов кала на колоректальный рак: систематический обзор и метаанализ». Анналы внутренней медицины. 160 (3): 171–181. Дои:10.7326 / M13-1484. ЧВК 4189821. PMID 24658694.
- ^ а б Касим А., Крэндалл СиДжей, Мустафа Р.А., Хикс Л.А., Уилт Т.Дж. (ноябрь 2019 г.). «Скрининг колоректального рака у бессимптомных взрослых со средним риском: руководство Американского колледжа врачей». Анналы внутренней медицины. 171 (9): 643–654. Дои:10.7326 / M19-0642. PMID 31683290.
- ^ Вольф AM, Fontham ET, Church TR, Flowers CR, Guerra CE, LaMonte SJ и др. (Июль 2018). «Скрининг на рак прямой кишки для взрослых со средним риском: обновленные рекомендации Американского онкологического общества, 2018 г.». Ca. 68 (4): 250–281. Дои:10.3322 / caac.21457. PMID 29846947.
- ^ «Скрининг колоректального рака». Целевая группа по профилактическим услугам США. 2008. Архивировано с оригинал 7 февраля 2015 г.. Получено 19 декабря, 2011.
- ^ а б Бреннер Х, Сток С, Хоффмайстер М (апрель 2014 г.). «Влияние скрининг-сигмоидоскопии и скрининг-колоноскопии на заболеваемость и смертность от рака прямой кишки: систематический обзор и метаанализ рандомизированных контролируемых испытаний и обсервационных исследований». BMJ. 348 (апрель 09): g2467. Дои:10.1136 / bmj.g2467. ЧВК 3980789. PMID 24922745.
- ^ Американская гастроэнтерологическая ассоциация. «Пять вещей, которые должны задать вопросы врачам и пациентам» (PDF). Мудрый выбор: инициатива ABIM Foundation. Архивировано из оригинал (PDF) 9 августа 2012 г.. Получено 17 августа, 2012.
- ^ Винавер С., Флетчер Р., Рекс Д., Бонд Дж., Берт Р., Ферруччи Дж., Ганиатс Т., Левин Т., Вульф С., Джонсон Д., Кирк Л., Литин С., Симманг С. (февраль 2003 г.). «Скрининг и наблюдение за колоректальным раком: клинические рекомендации и обоснование - обновление на основе новых данных». Гастроэнтерология. 124 (2): 544–560. Дои:10.1053 / gast.2003.50044. PMID 12557158. S2CID 29354772.
- ^ Казим А., Денберг Т.Д., Хопкинс Р.Х., Хамфри Л.Л., Левин Дж., Sweet DE, Шекель П. (март 2012 г.). «Скрининг на колоректальный рак: руководство Американского колледжа врачей». Анналы внутренней медицины. 156 (5): 378–386. Дои:10.7326/0003-4819-156-5-201203060-00010. PMID 22393133.
- ^ Тан В., Боскардин В.Дж., Стиджачич-Кензер И., Ли С.Дж. (апрель 2015 г.). «Время воспользоваться преимуществами скрининга на колоректальный рак: метаанализ выживаемости гибких исследований с помощью сигмоидоскопии». BMJ. 350: h1662. Дои:10.1136 / bmj.h1662. ЧВК 4399600. PMID 25881903.
- ^ а б Bacchus CM, Dunfield L, Gorber SC, Holmes NM, Birtwhistle R, Dickinson JA, Lewin G, Singh H, Klarenbach S, Mai V, Tonelli M (март 2016 г.). «Рекомендации по скринингу на колоректальный рак в первичной медико-санитарной помощи». CMAJ. 188 (5): 340–348. Дои:10.1503 / cmaj.151125. ЧВК 4786388. PMID 26903355.
- ^ "Программа скрининга рака кишечника NHS". Cancerscreening.nhs.uk. В архиве с оригинала от 29 ноября 2014 г.
- ^ "Главная - Рак кишечника Австралия". Bowelcanceraustralia.org. Архивировано из оригинал 24 декабря 2014 г.
- ^ "Bevolkingsonderzoek darmkanker". rivm.nl. В архиве с оригинала 17 декабря 2014 г.
- ^ Тепус М., Яу ТО (20 мая 2020 г.). «Неинвазивный скрининг колоректального рака: обзор». Опухоли желудочно-кишечного тракта. 7 (3): 62–73. Дои:10.1159/000507701.
- ^ Штейн А., Атанакович Д., Бокемейер С. (сентябрь 2011 г.). «Современные стандарты и новые тенденции в первичном лечении колоректального рака». Европейский журнал рака (Оксфорд, Англия: 1990). 47 Приложение 3: S312–314. Дои:10.1016 / S0959-8049 (11) 70183-6. PMID 21943995.
- ^ Fantola, G .; Тондоло Mater_Olbia_Hospital, V .; Mantovani, G .; Ранфола, М .; Замбони, Ф. (сентябрь 2011 г.). "6077 ПОСТЕРНАЯ Хирургическая резекция метастазов в печень при колоректальной карциноме - выживание согласно радикальной резекции печени и прогностическим факторам". Европейский журнал рака. 47: S414. Дои:10.1016 / s0959-8049 (11) 71722-1. ISSN 0959-8049.
- ^ Бёкельман С., Энгельманн Б.Э., Каприо Т., Хансен Т.Ф., Глимелиус Б. (январь 2015 г.). «Риск рецидива у пациентов с раком толстой кишки II и III стадии: систематический обзор и метаанализ недавней литературы». Acta Oncologica. 54 (1): 5–16. Дои:10.3109 / 0284186x.2014.975839. PMID 25430983.
- ^ «Химиотерапия метастатического колоректального рака». Prescrire International. 19 (109): 219–224. Октябрь 2010 г. PMID 21180382.
- ^ Факих М.Г. (июнь 2015 г.). «Метастатический колоректальный рак: текущее состояние и направления на будущее». Журнал клинической онкологии. 33 (16): 1809–1824. Дои:10.1200 / JCO.2014.59.7633. PMID 25918280.
- ^ Шаиб В., Махаджан Р., Эль-Райес Б. (сентябрь 2013 г.). «Маркеры устойчивости к терапии против EGFR при колоректальном раке». Журнал онкологии желудочно-кишечного тракта. 4 (3): 308–318. Дои:10.3978 / j.issn.2078-6891.2013.029. ЧВК 3712296. PMID 23997942.
- ^ Sugarbaker PH, Ван дер Спитен К. (февраль 2016 г.). «Хирургическая технология и фармакология гипертермической периоперационной химиотерапии». Журнал онкологии желудочно-кишечного тракта. 7 (1): 29–44. Дои:10.3978 / j.issn.2078-6891.2015.105. ЧВК 4754302. PMID 26941982.
- ^ Сегура-Сампедро Дж. Дж., Моралес-Сориано Р. (июль 2020 г.). «Профилактический HIPEC с оксалиплатином может быть полезным при T4 и раке перфорированной толстой кишки: еще одна возможная интерпретация результатов COLOPEC». Revista Espanola de Enfermedades Digestivas. 112 (8): 666. Дои:10.17235 / reed.2020.6755 / 2019. PMID 32686435.
- ^ Эскивель Дж., Стикка Р., Шугарбейкер П., Левин Е., Ян Т. Д., Александр Р. и др. (Январь 2007 г.). «Циторедуктивная хирургия и гипертермическая интраперитонеальная химиотерапия в лечении злокачественных новообразований на поверхности брюшины толстой кишки: согласованное заявление. Общество хирургической онкологии». Анналы хирургической онкологии. 14 (1): 128–33. Дои:10.1245 / s10434-006-9185-7. PMID 17072675. S2CID 21282326.
- ^ ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. (2008). Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии. Липпинкотт Уильямс и Уилкинс. стр. 1258–. ISBN 978-0-7817-7207-5.
- ^ Ли И, Ван Дж, Ма Х, Тан Л., Ян И, Сюэ С, Хуэй Б., Лю Р, Ма Х, Рен Дж (2016). "Обзор неоадъювантной химиолучевой терапии для местнораспространенного рака прямой кишки". Международный журнал биологических наук. 12 (8): 1022–1031. Дои:10.7150 / ijbs.15438. ЧВК 4971740. PMID 27489505.
- ^ а б Боланд PM, Ма WW (май 2017 г.). «Иммунотерапия колоректального рака». Рак. 9 (5): 50. Дои:10.3390 / раки9050050. ЧВК 5447960. PMID 28492495.
- ^ а б c Syn NL, Teng MW, Mok TS, Soo RA (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет. Онкология. 18 (12): e731 – e741. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ «FDA предоставило ускоренное одобрение пембролизумаба для первого показания, не зависящего от ткани / участка». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 9 февраля 2019.
- ^ «Паллиативная или поддерживающая терапия». Американское онкологическое общество. В архиве с оригинала 21 августа 2014 г.. Получено 20 августа, 2014.
- ^ «Предварительное клиническое заключение ASCO: интеграция паллиативной помощи в стандартную онкологическую помощь». ASCO. Архивировано из оригинал 21 августа 2014 г.. Получено 20 августа 2014.
- ^ Хиггинсон И. Дж., Эванс К. Дж. (Сентябрь – октябрь 2010 г.). «Каковы доказательства того, что команды паллиативной помощи улучшают результаты для онкологических больных и их семей?». Журнал рака. 16 (5): 423–435. Дои:10.1097 / PPO.0b013e3181f684e5. PMID 20890138. S2CID 39881122.
- ^ Вассерберг Н., Кауфман Х.С. (декабрь 2007 г.). «Паллиативное лечение колоректального рака». Surg. Онкол. 16 (4): 299–310. Дои:10.1016 / j.suronc.2007.08.008. PMID 17913495.
- ^ Амерси Ф., Стамос М.Дж., Ко CY (июль 2004 г.). «Паллиативная помощь при колоректальном раке». Surg. Онкол. Clin. N. Am. 13 (3): 467–477. Дои:10.1016 / j.soc.2004.03.002. PMID 15236729.
- ^ а б «Национальная комплексная онкологическая сеть» (PDF). nccn.org. В архиве (PDF) с оригинала от 25 марта 2009 г.
- ^ а б Desch CE, Benson AB, Somerfield MR, Flynn PJ, Krause C, Loprinzi CL, Minsky BD, Pfister DG, Virgo KS, Petrelli NJ (ноябрь 2005 г.). «Эпиднадзор за колоректальным раком: обновление 2005 г. практических рекомендаций Американского общества клинической онкологии». Журнал клинической онкологии. 23 (33): 8512–8519. Дои:10.1200 / JCO.2005.04.0063. PMID 16260687.
- ^ Джеффри М., Хикки Б.Э., Хидер PN (сентябрь 2019 г.). «Стратегии наблюдения за пациентами, лечившимися от неметастатического колоректального рака». Кокрановская база данных систематических обзоров. 9: CD002200. Дои:10.1002 / 14651858.CD002200.pub4. ЧВК 6726414. PMID 31483854.
- ^ Betof AS, Dewhirst MW, Jones LW (март 2013 г.). «Эффекты и потенциальные механизмы физических упражнений на прогрессирование рака: трансляционная перспектива». Brain Behav. Иммунная. 30: S75–87. Дои:10.1016 / j.bbi.2012.05.001. ЧВК 3638811. PMID 22610066.
- ^ а б Баллард-Барбаш Р., Фриденрайх К.М., Курнея К.С., Сиддики С.М., Мактирнан А., Альфано К.М. (май 2012 г.). «Физическая активность, биомаркеры и исходы болезней у выживших после рака: систематический обзор». J. Natl. Институт рака. 104 (11): 815–840. Дои:10.1093 / jnci / djs207. ЧВК 3465697. PMID 22570317.
- ^ Захаракис М., Xynos ID, Лазарис А., Смаро Т., Космас С., Докоу А. и др. (2010). «Предикторы выживаемости при метастатическом колоректальном раке IV стадии». Противораковый Res. 30 (2): 653–660. PMID 20332485.
- ^ Вставка 3-1, стр. 107 в: Агабеги ЭД, Агабеги СС (2008). Шаг вперед к медицине (серия Step-Up). Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5.
- ^ Остерман Э., Глимелиус Б (сентябрь 2018 г.). «Риск рецидива после современной стадии рака толстой кишки, хирургии и патологии: анализ всего населения Швеции». Заболевания толстой и прямой кишки. 61 (9): 1016–1025. Дои:10.1097 / dcr.0000000000001158. PMID 30086050. S2CID 51934598.
- ^ Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абояс В. и др. (Декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти для 20 возрастных групп в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года». Ланцет. 380 (9859): 2095–128. Дои:10.1016 / S0140-6736 (12) 61728-0. HDL:10536 / DRO / DU: 30050819. PMID 23245604. S2CID 1541253.
- ^ ВОЗ (Февраль 2010 г.). "Рак". Всемирная организация здоровья. В архиве с оригинала 29 декабря 2010 г.. Получено 5 января, 2011.
- ^ Мерика Э., Саиф М.В., Кац А., Сиригос К., Сиригос К., Морс М. (2010). «Обзор. Вакцины против рака толстой кишки: обновленная информация». In Vivo (Афины, Греция). 24 (5): 607–628. PMID 20952724.
- ^ Заболеваемость, смертность и распространенность колоректального рака во всем мире в 2008 г. - Резюме В архиве 17 октября 2012 г. Wayback Machine. Доступно у: Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. (2010)GLOBOCAN 2008 v2.0, Заболеваемость и смертность от рака во всем мире: База данных МАИР № 10 [Интернет] В архиве 8 мая 2011 г. Wayback Machine.Лион, Франция: Международное агентство по изучению рака. Доступ 11 октября 2012 г.
- ^ «Эффективное доведение информации о скрининге колоректального рака до поставщиков первичной медико-санитарной помощи». Американский журнал санитарного просвещения. 43 (4): 194–201. 2012. Дои:10.1080/19325037.2012.10599235. ЧВК 4770578. PMID 26937262.
- ^ Howlader N, Noone AM, Krapcho M, Neyman N, Aminou R, Altekruse SF, Kosary CL, Ruhl J, Tatalovich Z, Cho H, Mariotto A, Eisner MP, Lewis DR, Chen HS, Feuer EJ, Cronin KA. Обзор статистики рака SEER, 1975–2009 гг. (Население 2009 г.). Bethesda, MD: Национальный институт рака. В архиве из оригинала от 3 сентября 2012 г. На основании данных, представленных в ноябре 2011 г., размещенных на веб-сайте SEER, 2012 г.
- ^ «Рак кишечника | О раке кишечника | Исследования рака в Великобритании». www.cancerresearchuk.org. В архиве с оригинала 9 марта 2017 г.. Получено 12 мая, 2017.
- ^ Рак в Австралии: обзор, 2014. Серия «Рак» № 90. Кат. № CAN 88. Канберра: Австралийский институт здравоохранения и социального обеспечения. 2014 г. ISBN 978-1-74249-677-1.
- ^ Рехемтулла А (декабрь 2010 г.). «Динозавры и древние цивилизации: размышления о лечении рака». Неоплазия. 12 (12): 957–68. Дои:10.1593 / neo.101588. ЧВК 3003131. PMID 21170260.
- ^ Чжун Л., Чжан Х, Коваса М. (июнь 2014 г.). «Новые роли молочнокислых бактерий в защите от колоректального рака». Мир J. Гастроэнтерол. 20 (24): 7878–7886. Дои:10.3748 / wjg.v20.i24.7878. ЧВК 4069315. PMID 24976724.
- ^ Головко Д., Кедрин Д., Йилмаз ÖH, Ропер Дж. (2015). «Модели колоректального рака для открытия новых лекарств». Мнение эксперта об открытии лекарств. 10 (11): 1217–1229. Дои:10.1517/17460441.2015.1079618. ЧВК 4872297. PMID 26295972.
- ^ Oh BY, Hong HK, Lee WY, Cho YB (февраль 2017 г.). «Животные модели колоректального рака с метастазами в печень». Письма о раке. 387: 114–120. Дои:10.1016 / j.canlet.2016.01.048. PMID 26850374.
- ^ Evans JP, Sutton PA, Winiarski BK, Fenwick SW, Malik HZ, Vimalachandran D, Tweedle EM, Costello E, Palmer DH, Park BK, Kitteringham NR (февраль 2016 г.). «От мышей к человеку: мышиные модели колоректального рака для использования в трансляционных исследованиях». Критические обзоры в онкологии / гематологии. 98: 94–105. Дои:10.1016 / j.critrevonc.2015.10.009. PMID 26558688.
- ^ «Атлас колоректального рака». В архиве с оригинала от 13 января 2016 г.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
| Викискладе есть медиафайлы по теме Колоректальный рак. |
- Колоректальный рак в Керли
- Показатели выживаемости при раке толстой кишки при CancerSurvivalRates.com