WikiDer > Стромальная опухоль желудочно-кишечного тракта
| Стромальная опухоль желудочно-кишечного тракта | |
|---|---|
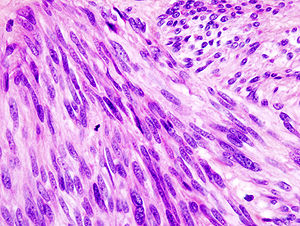 | |
| Гистопатологическое изображение желудочно-кишечной стромальной опухоли желудка. Окраска гематоксилин-эозином. | |
| Специальность | Онкология |
Стромальные опухоли желудочно-кишечного тракта (ГИСО) являются наиболее распространенными мезенхимальный новообразования из желудочно-кишечный тракт. GIST возникают в гладкая мышца кардиостимулятор интерстициальная клетка Кахаляили аналогичные ячейки.[1] Они определяются как опухоли, поведение которых определяется мутациями в КОМПЛЕКТ ген (85%),[1] PDGFRA ген (10%),[1] или киназа BRAF (редко).[1] 95% ГИСО пятно положительно для KIT (CD117).[1][2] Большинство (66%) встречаются в желудке, а ГИСО желудка имеют более низкий потенциал злокачественности, чем опухоли, обнаруженные в других местах желудочно-кишечного тракта.[2]
Классификация
GIST был введен как диагностический термин в 1983 году.[1]:1060 До конца 1990-х многие неэпителиальный опухоли из желудочно-кишечный тракт получили название «желудочно-кишечные стромальные опухоли». Гистопатологи не смогли четко различать типы, которые, как мы теперь знаем, различаются на молекулярном уровне. Впоследствии CD34, а позже CD117 были идентифицированы как маркеры, позволяющие различать различные типы.[нужна цитата] Кроме того, в отсутствие специфической терапии диагностическая категоризация имела лишь ограниченное влияние на прогноз и терапию.
Понимание биологии GIST значительно изменилось с выявлением молекулярная основа GIST,[1]:1065 особенно c-KIT. Исторически сложилось так, что обзоры литературы до молекулярного определения GIST и в течение короткого времени после этого утверждали, что 70-80% GIST были доброкачественными.[3][4][5] Идентификация молекулярной основы GIST привела к исключению многих опухолей, которые ранее считались GIST, а также включению гораздо большего числа опухолей, которые были помечены как другие типы сарком и недифференцированных карцином.[1]:1065 Например, некоторые предыдущие диагнозы желудка и тонкой кишки лейомиосаркомы (злокачественная опухоль гладкая мышца) будут реклассифицированы как GIST на основании иммуногистохимического окрашивания. Все опухоли GIST в настоящее время считаются потенциально злокачественными, и ни одна опухоль GIST не может быть окончательно классифицирована как «доброкачественная».[6] Следовательно, все GIST соответствуют критериям определения стадии рака в AJCC (7-е издание) / UICC.[7] Тем не менее, разные GIST по-разному оценивают риск своей тенденции к повторению или метастазированию, в зависимости от места их происхождения, размера и количества митотических фигур.
Из-за изменения определения клинические методы оказания помощи до 2000 года в значительной степени неинформативны в нынешнюю эпоху.[1]
Признаки и симптомы
GIST могут присутствовать с проблемы с глотанием, желудочно-кишечное кровотечение, или метастазы (в основном в печени). Кишечная непроходимость возникает редко из-за внешнего характера роста опухоли. Часто бывает неясная история боль в животе или дискомфорт, и опухоль стала довольно большой к моменту постановки диагноза.
Патофизиология
ГИСО - это опухоли соединительная ткань, т.е. саркомы; В отличие от большинство опухолей желудочно-кишечного тракта, они неэпителиальный. Около 70% приходится на желудок, 20% в тонкий кишечник и менее 10% в пищевод. Маленькие опухоли обычно доброкачественные, особенно если: деление клеток скорость медленная, но большие опухоли распространяются на печень, сальник и брюшная полость. Они редко возникают в других органах брюшной полости.
Считается, что ГИСО возникают из интерстициальные клетки Кахаля (ICC), которые обычно являются частью автономная нервная система кишечника.[2] Они выполняют функцию кардиостимулятора, контролируя подвижность.
Генетика
Большинство GIST носят спорадический характер. Менее 5% приходится на наследственный семейные или идиопатические мультиопухолевые синдромы. К ним относятся, в порядке убывания частоты, нейрофиброматоз Реклингхаузен (NF-1), Триада Карни (желудочный GIST, легочный хондрома и экстра-надпочечник параганглиома), зародышевый усиление функции мутации в c-Kit/PDGFRA, а Синдром Карни-Стратакиса.[8] Синдром Карни-Стратакиса - это диада наследственной GIST и параганглиомы, вызванной мутациями зародышевой линии в митохондриальный ген-супрессор опухоли путь с участием сукцинатдегидрогеназа (SDH) субъединицы SDHD, SDHC и SDHB.[9]
c-KIT мутации
Примерно 85% GIST связаны с аномальным c-KIT путь. c-KIT это ген, который кодирует трансмембранный рецептор для фактора роста, называемого фактор стволовых клеток (scf). Ненормальный c-KIT путь чаще всего (85%) возникает из мутация самого гена; меньшее подмножество GIST, связанных с c-KIT, связано с учредительная деятельность из КОМПЛЕКТ ферментативный путь, найдено иммуноблоттинг.[1]:1062 Продукт c-KIT / CD117 экспрессируется на ICC и большом количестве других клеток, в основном Костный мозг клетки тучные клетки, меланоциты и несколько других. Однако в кишечнике массовое окрашивание положительно на CD117 скорее всего, это GIST, возникающий из клеток ICC.
C-KIT молекула состоит из длинного внеклеточный домен, а трансмембранный сегмент, и внутриклеточная часть. Мутации обычно происходят в ДНК кодирует внутриклеточную часть (экзон 11), которая действует как тирозинкиназа активировать другие ферменты. Мутации делают функцию c-KIT независимой от активации scf, что приводит к высокой скорости деления клеток и, возможно, нестабильности генома. Дополнительные мутации, вероятно, «требуются» для клетки с c-KIT мутации, чтобы развиться в GIST, но c-KIT мутация, вероятно, первый шаг этого процесса.
Мутации в экзоны 11, 9 и реже 13 и 17 из c-KIT ген, как известно, встречается в GIST. В тирозинкиназа функция c-KIT важен в медикаментозной терапии GIST, как описано ниже.
- KIT-D816V точечные мутации в c-KIT экзон 17 ответственен за устойчивость к лекарствам таргетной терапии, таким как мезилат иматиниба, ингибитор тирозинкиназы.
- KIT-p.D419del (экзон 8) - подмножество опухолей стромы желудочно-кишечного тракта, ранее считавшихся опухолями дикого типа, несет соматические активирующие мутации в экзоне 8 KIT (p.D419del).[10]
Мутации PDGFRA
Большинство клеток GIST с диким типом (т. Е. Не мутировавшие) c-kit вместо этого есть мутация в другом гене, PDGFR-α (рецептор фактора роста тромбоцитов альфа), которая является родственной тирозинкиназой. Мутации в c-kit и PDGFrA взаимоисключающие [4][5][мертвая ссылка].
Опухоли дикого типа
Меньшее количество GIST, по-видимому, не связано ни с аномалиями c-kit, ни с PDGFR-α.[1]:1062 Около 10-15% желудочно-кишечных стромальных опухолей (GIST) несут последовательности дикого типа во всех горячих точках KIT и рецептора альфа-тромбоцитарного фактора роста (PDGFRA) (wt-GIST). Эти опухоли в настоящее время определяются отсутствием мутаций в экзонах 9, 11, 13 и 17 гена KIT и экзонах 12, 14 и 18 гена PDGFRA.[10]
Диагностика
КТ сканирование часто предпринимаются (см. радиология раздел).
Окончательный диагноз ставится биопсия, который можно получить эндоскопически, подкожно под контролем КТ или УЗИ или во время операции. А биопсия образец будет исследован под микроскоп по патолог врач. Патологоанатом исследует гистопатология определить характеристики GIST (веретенообразные клетки в 70-80%, эпителиальный аспект в 20-30%). Более мелкие опухоли обычно могут быть ограничены слоем мышечной оболочки кишечной стенки. Большие растут, в основном наружу, от стенки кишечника до точки, где они превышают кровоснабжение и некроз (умирают) внутри, образуя полость, которая в конечном итоге может соединиться с просветом кишечника.
При подозрении на ГИСО - в отличие от других причин подобных опухолей - патолог может использовать иммуногистохимия (специфический антитела которые окрашивают молекулу CD117 [также известный как c-kit] -Смотри ниже). 95% всех GIST являются CD117-положительными (другие возможные маркеры включают CD34, СОБАКА-1, десмин, и виментин). Другие клетки, которые показывают положительную реакцию на CD117: тучные клетки.
Если окраска CD117 отрицательна и остается подозрение, что опухоль является GIST, можно использовать более новое антитело DOG-1 (обнаруженное на GIST-1). Также последовательность действий набора и PDGFRA можно использовать для подтверждения диагноза.
Изображения
Цель рентгенологического исследования - определить местонахождение поражения, оценить признаки инвазии и обнаружить метастаз. Характеристики GIST зависят от размера опухоли и органа происхождения. Диаметр может составлять от нескольких миллиметров до более 30 см. Более крупные опухоли обычно вызывают симптомы, в отличие от случайно обнаруженных, которые, как правило, меньше и имеют лучший прогноз.[3][11] Большие опухоли, как правило, проявляются злокачественный поведение, но небольшие GIST могут также демонстрировать клинически агрессивное поведение.[12]

Обычные рентгенограммы не очень полезны при оценке GIST. Если замечено отклонение от нормы, это будет косвенным признаком воздействия опухолевой массы на соседние органы. На рентген брюшной полостиГИСО желудка могут выглядеть как рентгеноконтрастный масса изменяет форму воздушной тени желудка. Кишечные GIST могут смещать петли кишечника, а более крупные опухоли могут блокировать кишечник, и снимки покажут препятствующий узор. Если кавитации присутствуют, обычные рентгенограммы покажут скопление воздуха внутри опухоли.[13] Кальцификация - необычная особенность GIST, но при ее наличии может быть видна на простых пленках.
Бариевый рентгеноскопический экзамены и CT обычно используются для оценки пациента с жалобами на брюшную полость. Изображения проглатывания бария показывают отклонения в 80% случаев GIST.[12] Однако некоторые GIST могут располагаться полностью за пределами просвета кишечника, и их нельзя будет оценить при проглатывании бария. Даже в тех случаях, когда проглатывание бария является ненормальным, необходимо провести МРТ или КТ, поскольку невозможно оценить брюшную полость и другие органы брюшной полости с помощью только глотка бария. При компьютерной томографии отклонения можно увидеть у 87% пациентов, и его следует делать как с пероральным, так и с внутривенным контрастированием.[12] Среди визуализационных исследований МРТ имеет лучший контраст тканей, который помогает идентифицировать опухоли в желудочно-кишечном тракте (интрамуральные образования). Для оценки сосудистости поражения необходимо внутривенное введение контрастного вещества.
Предпочтительными методами визуализации при оценке GIST являются КТ и МРТ,[14]:20–21 и, в отдельных случаях, эндоскопическое ультразвуковое исследование. Преимущества компьютерной томографии включают ее способность демонстрировать доказательства инвазии соседних органов, асцита и метастазов. Способность МРТ создавать изображения в нескольких плоскостях помогает определить кишечник как исходный орган (что сложно при очень больших размерах опухоли), облегчая диагностику.
Маленькие GIST
Поскольку ГИСО возникают из слоя кишечника, называемого мышечная мышца (что глубже слизистая оболочка и подслизистая основа из просвет перспектива), визуализация малого GIST обычно указывает на подслизистый отросток или образование в стенке кишечника. В бариевая ласточка Согласно исследованиям, эти GIST чаще всего имеют гладкие границы, образующие прямые или тупые углы с близлежащей стенкой кишечника, как это видно с любыми другими интрамуральными образованиями. Поверхность слизистой оболочки обычно не повреждена, за исключением участков изъязвлений, которые обычно присутствуют в 50% GIST. Изъязвления заполняются барием, вызывая появление очага или целевого поражения. В контрастном усилении CT, маленькие GIST выглядят как гладкие, четко определенные интрамуральные образования с однородным затуханием.
Крупные GIST
По мере роста опухоль может выступать за пределы кишечника (экзофитный рост) и / или внутрь кишечника (внутрипросветный рост), но чаще всего они растут экзофитически, так что большая часть опухоли выступает в брюшную полость. Если опухоль превышает кровоснабжение, она может некроз внутренне, создавая центральную полость, заполненную жидкостью, с кровотечением и кавитации которые в конечном итоге могут изъязвляться и передаваться в просвет кишечника. В этом случае проглатывание бария может показать уровни воздуха, воздуха и жидкости или скопление перорального контрастного вещества в этих областях.[12][15] Также могут присутствовать язвы слизистой оболочки. В отличие от КТ-изображений с контрастным усилением, большие ГИСО выглядят как неоднородные массы из-за областей живых опухолевых клеток, окружающих кровотечение, некроз или кисты, что рентгенологически рассматривается как периферический паттерн усиления с низким центром ослабления.[11] В МРТ исследования, степень некроза и кровотечения влияет на характер интенсивности сигнала. Области кровотечения в опухоли будут различать интенсивность сигнала в зависимости от того, как давно произошло кровотечение. Солидные части опухоли обычно имеют низкую интенсивность сигнала на Т1-взвешенные изображения, - высокая интенсивность сигнала на Т2-взвешенные изображения и усиливаются после приема гадолиний. Если есть газ в областях некротической опухоли, то присутствуют пустоты интенсивности сигнала.[13][16][17]
Особенности злокачественности
Злокачественность характеризуется местной инвазией и метастазами, обычно в печень, сальник и брюшина. Однако случаи метастазов в кости, плевра, легкие и забрюшинное пространство были замечены. В отличие от желудочного аденокарцинома или желудочный / тонкий кишечник лимфома, злокачественный лимфаденопатия (увеличение лимфатических узлов) встречается редко (<10%), поэтому визуализация обычно показывает отсутствие увеличения лимфатических узлов.[11] Если метастазов нет, другие рентгенологические признаки, указывающие на злокачественность, включают: размер (> 5 см), неоднородное усиление после введения контрастного вещества и изъязвления.[3][11][18] Кроме того, явно злокачественное поведение (в отличие от злокачественного потенциала меньшей степени) менее часто наблюдается при опухолях желудка, с соотношением поведенчески доброкачественных и явно злокачественных опухолей 3-5: 1.[3] Даже если присутствуют злокачественные рентгенологические признаки, эти результаты могут также представлять другие опухоли, и необходимо поставить окончательный диагноз. иммунохимически.
Управление
Локализованные, операбельные ГИСО взрослых, если анатомически и физиологически возможно, хирургическое вмешательство является основным методом выбора.[14]:69 Хирургия может быть потенциально излечивающей, но при небольших опухолях в тщательно отобранных ситуациях можно рассмотреть возможность осторожного ожидания.[19] Может быть рекомендовано послеоперационное адъювантное лечение.[20] Метастазы в лимфатические узлы встречаются редко, и обычное удаление лимфатических узлов обычно не требуется. Лапароскопическая хирургия, минимально инвазивная абдоминальная хирургия с использованием телескопов и специализированных инструментов, оказалась эффективной для удаления этих опухолей без необходимости делать большие разрезы.[21] Клинические вопросы точных хирургических показаний к размеру опухоли спорны. Решение о подходящей лапароскопической операции зависит от размера, расположения и характера роста опухоли.[22]
Лучевая терапия исторически не была эффективной при ГИСО[23]:1122 и GIST не отвечают на большинство химиотерапия лекарства,[23]:1122 с ответами менее 5%.[1]:1065 Тем не менее, в GIST были идентифицированы три препарата с клинической пользой: иматиниб, сунитиниб, и регорафениб.
Иматиниб (Гливек / Гливек), перорально препарат первоначально продавался для хронический миелолейкоз на основе bcr-abl ингибирование, также подавляет оба c-kit тирозинкиназа мутации и мутации PDGFRA, отличные от D842V, полезны при лечении GIST в нескольких ситуациях. Иматиниб использовался в отдельных неоадъювантный настройки.[24][14]:23 в адъювант В условиях лечения большинство опухолей GIST излечиваются хирургическим путем и не нуждаются в адъювантной терапии.[25] [26] Исключение составляют случаи, когда анатомическое положение опухоли означает, что операция технически трудна или сложна. Например, ректальный GIST часто требует радикального хирургического вмешательства для достижения полной резекции, включающей: абдоминоперинеальная резекция и постоянный стома. В этих ситуациях использование неоадъювантного иматиниба может значительно уменьшить как размер опухоли, так и митотическую активность, а также сделать менее радикальные операции по сохранению сфинктера.[24]
Значительная часть опухолей GIST имеет высокий риск рецидива, по оценке ряда проверенных схем стратификации риска, и может быть рассмотрена для адъювантной терапии.[26][27] Критерии выбора, лежащие в основе решения о возможном использовании иматиниба в этих условиях, включают оценку риска, основанную на патологических факторах, таких как размер опухоли, скорость митоза и местоположение, которые могут использоваться для прогнозирования риска рецидива у пациентов с GIST. Было показано, что опухоли <2 см с митотической скоростью <5/50 HPF имеют более низкий риск рецидива, чем более крупные или более агрессивные опухоли. После хирургической резекции GISTs, адъювант лечение иматинибом снижает риск рецидива заболевания в группах повышенного риска.[нужна цитата] В отдельных случаях адъювантного лечения повышенного риска иматиниб рекомендуется в течение 3 лет.[28]
Иматиниб был одобрен FDA США для лечения метастатического и нерезектабельного ГИСО 1 февраля 2002 г. После лечения иматинибом двухлетняя выживаемость пациентов с запущенным заболеванием возросла до 75–80%.[29]
Если встречается резистентность к иматинибу, ингибитор множественной тирозинкиназы сунитиниб (продается как Сутент).[14]:26 и 31[30]
Эффективность иматиниб и сунитиниб зависят от генотипа.[31] Опухоли GIST с отрицательными мутациями cKIT и PDGFRA обычно устойчивы к лечению иматинибом.[9] как есть нейрофиброматоз-1-ассоциированный GIST дикого типа.[26] Специфический подтип мутации PDGFRA, D842V, также нечувствителен к иматинибу.[26][32]
Регорафениб (Stivarga) был одобрен FDA в 2013 году для расширенных GIST, которые нельзя удалить хирургическим путем и которые больше не реагируют на иматиниб (Gleevec) и сунитиниб (Sutent).[33]
Эпидемиология
ГИСО встречаются у 10-20 на миллион человек. Реальная частота может быть выше, поскольку новые лабораторные методы гораздо более чувствительны при диагностике ГИСО.[нужна цитата] Предполагаемая заболеваемость GIST в Соединенных Штатах составляет около 5000 случаев ежегодно.[1]:1063 Это делает GIST наиболее распространенной формой саркома, который составляет более 70 видов рака.
Большинство GIST присутствуют в возрасте 50–70 лет. В большинстве возрастных групп частота ГИСО одинакова у мужчин и женщин.[23]:1122
ГИСО взрослых редко встречаются в возрасте до 40 лет. ГИСО для детей считаются биологически разными.[34] В отличие от ГИСО других возрастов, ГИСО в педиатрии чаще встречается у девочек и молодых женщин. По-видимому, в них отсутствуют онкогенные активирующие мутации тирозинкиназы как в KIT, так и в PDGFRA.[35] Лечение GIST у детей отличается от лечения GIST у взрослых. Хотя общепринятое определение детской GIST - это опухоль, которая диагностируется в возрасте 18 лет и младше,[34] ГИСО «педиатрического типа» можно увидеть у взрослых, что влияет на оценку риска, роль резекции лимфатических узлов и выбор терапии.[36]
Цитаты
- ^ а б c d е ж грамм час я j k л м Деметри, Г., автор главы; ДеВита, L; Лоуренс, Т.С.; Розенберг, С.А., редакторы (2011). «Глава 87». Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии (9-е изд.). ISBN 978-1-4511-0545-2.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c Миеттинен М, Ласота Дж. (2006). «Опухоли стромы желудочно-кишечного тракта: обзор морфологии, молекулярной патологии, прогноза и дифференциальной диагностики». Arch Pathol Lab Med. 130 (10): 1466–78. Дои:10.1043 / 1543-2165 (2006) 130 [1466: GSTROM] 2.0.CO; 2 (неактивно 10.11.2020). PMID 17090188.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (ссылка на сайт)
- ^ а б c d Burkill GJ, Badran M, Al-Muderis O, Meirion Thomas J, Judson IR, Fisher C, Moskovic EC (2003). «Злокачественная стромальная опухоль желудочно-кишечного тракта: распределение, особенности визуализации и характер метастатического распространения». Радиология. 226 (2): 527–32. Дои:10.1148 / радиол.2262011880. PMID 12563150.
- ^ Нисида Т., Хирота С. (2000). «Биологический и клинический обзор стромальных опухолей желудочно-кишечного тракта». Гистол Гистопатол. 15 (4): 1293–301. PMID 11005253.
- ^ Миеттинен М, Ласота Дж. (2001). «Опухоли стромы желудочно-кишечного тракта - определение, клинические, гистологические, иммуногистохимические и молекулярно-генетические особенности и дифференциальная диагностика». Арка Вирхова. 438 (1): 1–12. Дои:10.1007 / s004280000338. PMID 11213830. S2CID 7598241.
- ^ Раут, Чандраджит; Дематтео, Рональд (март 2008 г.). «Доказательно-ориентированное хирургическое лечение GIST: за пределами простого случая доброкачественных и злокачественных заболеваний». Аня. Surg. Онкол. 15 (5): 1542–1543. Дои:10.1245 / s10434-008-9817-1. S2CID 12586147.
- ^ Руководство AJCC
- ^ Агайми А., Хартманн А. (2010). «Наследственные и ненаследственные синдромные желудочно-кишечные стромальные опухоли». Патолог (на немецком). 31 (6): 430–7. Дои:10.1007 / s00292-010-1354-6. PMID 20848108. S2CID 9295361.
- ^ а б Stratakis CA, Carney JA (июль 2009 г.). «Триада параганглиом, опухолей стромы желудка и хондром легких (триада Карни), а также диада параганглиом и стромальных сарком желудка (синдром Карни-Стратакиса): молекулярная генетика и клинические последствия». J Intern Med. 266 (1): 43–52. Дои:10.1111 / j.1365-2796.2009.02110.x. ЧВК 3129547. PMID 19522824.
- ^ а б Гус, S; Künstlinger, H; Wardelmann, E; Kleine, M. A .; Бино, Э; Меркельбах-Брюз, S; Рюдигер, Т; Mittler, J; Хартманн, Вт; Büttner, R; Шильдхаус, Х. У. (2013). «Подмножество стромальных опухолей желудочно-кишечного тракта, ранее считавшихся опухолями дикого типа, несет соматические активирующие мутации в экзоне 8 KIT (p.D419del)». Современная патология. 26 (7): 1004–12. Дои:10.1038 / modpathol.2013.47. ЧВК 3701292. PMID 23599150.
- ^ а б c d Херш М.Р., Чой Дж., Гаррет С., Кларк Р. (2005). «Визуализация желудочно-кишечных стромальных опухолей». Борьба с раком. 12 (2): 111–115. Дои:10.1177/107327480501200206. PMID 15855894. S2CID 26071847.
- ^ а б c d Пидгорицкий И., Чейни Р. Т., Крайбилл В. Г., Гиббс Дж. Ф. (2000). «Опухоли стромы желудочно-кишечного тракта: текущий диагноз, биологическое поведение и лечение». Энн Сург Онкол. 7 (9): 705–12. Дои:10.1007 / s10434-000-0705-6. PMID 11034250. S2CID 663887.
- ^ а б Сёдзяку Х., Футацуя Р., Сето Х. и др. (1997). «Злокачественная стромальная опухоль тонкой кишки желудочно-кишечного тракта: радиолого-патологическая корреляция». Radiat Med. 15 (3): 189–92. PMID 9278378.
- ^ а б c d Руководство NCCN по клинической практике при онкологических саркомах мягких тканей, версия 3, 2012. Национальная комплексная онкологическая сеть.[1]
- ^ Ленерт Т (1998). «Саркома желудочно-кишечного тракта (ГИСО) - обзор хирургического лечения». Энн Чир Гинекол. 87 (4): 297–305. PMID 9891770.
- ^ Левин М.С., Бак Дж. Л., Пантонграг-Браун Л. и др. (1996). «Лейомиосаркома пищевода: рентгенологические данные у 10 пациентов». AJR Am J Roentgenol. 167 (1): 27–32. Дои:10.2214 / ajr.167.1.8659399. PMID 8659399.
- ^ Tervahartiala P, Halavaara J (1998). «Радиология GIST. Опухоли стромы желудочно-кишечного тракта». Энн Чир Гинекол. 87 (4): 291–2. PMID 9891768.
- ^ Ulusan S, Koc Z, Kayaselcuk F (2008). «Опухоли стромы желудочно-кишечного тракта: результаты КТ». Br J Radiol. 81 (968): 618–623. Дои:10.1259 / bjr / 90134736. PMID 18628330.
- ^ Casali PG, Blay J-Y, от имени ESMO / CONTICANET / EUROBONET (2010). «Стромальные опухоли желудочно-кишечного тракта: клинические рекомендации ESMO по диагностике, лечению и последующему наблюдению». Анналы онкологии. 21 (приложение 5): v98 – v102. Дои:10.1093 / annonc / mdq208. PMID 20555113.CS1 maint: несколько имен: список авторов (ссылка на сайт)[2]
- ^ Бамбоат ЗМ (2012). «Обновленная информация о лечении стромальных опухолей желудочно-кишечного тракта». Хирургия Онкол Клин N Am. 21 (2): 301–16. Дои:10.1016 / j.soc.2011.12.004. ЧВК 3386646. PMID 22365521.
- ^ Нгуен С.К., Дивино С.М., Ван Дж.Л., Дикман С.Х. (май 2006 г.). «Лапароскопическое лечение опухолей стромы желудочно-кишечного тракта». Хирургическая эндоскопия. 20 (5): 713–6. Дои:10.1007 / s00464-005-0435-8. PMID 16502196. S2CID 12838290.
- ^ Ли, Чунг-Хо; Хён, Мён-Хан; Квон, Йе-Джи; Чо, Сун-Иль; Пак, Сунг-Су (2012). «Решение лапароскопических подходов к клиновидной резекции при подслизистых опухолях желудка: схема предполагаемого потока с использованием трех основных детерминант». Журнал Американского колледжа хирургов. 215 (6): 831–840. Дои:10.1016 / j.jamcollsurg.2012.07.009. PMID 22951033.
- ^ а б c Кантарджян, HM; Вольф, РА; Коллер, Калифорния. (2011). Руководство по медицинской онкологии доктора медицины Андерсона (2-е изд.). Макгроу-Хилл. ISBN 978-0-07-170106-8.
- ^ а б Уилкинсон М.Дж., Фицджеральд Д.Е., Штраус Д.К., Хейс А.Дж., Томас Дж.М., Мессиу С., Фишер С., Бенсон С., Теккис П.П., Джадсон И. (август 2015 г.). «Хирургическое лечение желудочно-кишечной стромальной опухоли прямой кишки в эпоху иматиниба». Br J Surg. 102 (8): 965–71. Дои:10.1002 / bjs.9818. PMID 25970743. S2CID 2810885.
- ^ Йоэнсуу, Хейкки (01.06.2012). «Адъювантное лечение GIST: отбор пациентов и стратегии лечения». Обзоры природы. Клиническая онкология. 9 (6): 351–358. Дои:10.1038 / nrclinonc.2012.74. ISSN 1759-4782. PMID 22525709. S2CID 12733166.
- ^ а б c d Йоэнсуу, Хейкки (22.10.2012). «Адъювантная терапия стромальной опухоли желудочно-кишечного тракта высокого риска: рекомендации по оптимальному ведению». Наркотики. 72 (15): 1953–1963. Дои:10.2165/11635590-000000000-00000. ISSN 0012-6667. PMID 22994537. S2CID 43794982.
- ^ Райхард П., Блей, Джей-Й, Буковинас, И.; и другие. (2012). «Адъювантная терапия в первичном GIST: современное состояние». Анналы онкологии. 23 (11): 2776–2781. Дои:10.1093 / annonc / mds198. PMID 22831984.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Коэн М.Х., Джонсон-младший, Джастис Р., Паздур Р. (2012). «Резюме одобрения: мезилат иматиниба в течение одного или трех лет в адъювантном лечении стромальных опухолей желудочно-кишечного тракта. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Silver Spring, MD 20993-0002, США». Онколог. 17 (7): 992–997. Дои:10.1634 / теонколог.2012-0109. ЧВК 3399657. PMID 22643537.
- ^ Патель Шреяскумар Р; Вонг Патрик (2009). «Эффективность иматиниба при неоперабельных / метастатических стромальных опухолях желудочно-кишечного тракта». Онкология США. 5 (1): 61–4. Дои:10.17925 / ohr.2009.05.1.61. S2CID 78453531.
- ^ Окуно, S (14 сентября 2011 г.). «Использование ингибиторов тирозинкиназы для лечения стромальных опухолей желудочно-кишечного тракта (GIST)». Современная онкология.
- ^ "Новости: генетические вариации в опухолях желудочно-кишечного тракта определяют, какие лекарства эффективны". Новости генной инженерии и биотехнологии. 13 ноября 2008 г.
- ^ ASCO-SEP 3-е изд.
- ^ Паздур, Ричард. Одобрение FDA для Регорафениба. Национальный институт рака.[3]
- ^ а б Паппо А.С., Джейнвей К.А. (февраль 2009 г.). «Детские желудочно-кишечные стромальные опухоли». Гематол Онкол Клин Норт Ам. 23 (1): 15–34. Дои:10.1016 / j.hoc.2008.11.005. PMID 19248968.
- ^ Келли Л., Брайан К., Ким С.И., Джейнвей К.А., Киллиан Дж.К., Шилдхаус Х.Ю., Миеттинен М., Хельман Л., Мельцер П.С., Ван де Рейн М., Дебик-Рихтер М., О'Салливан М. (2013). «Посттранскрипционная дисрегуляция миРНК участвует в патогенезе желудочно-кишечной стромальной опухоли [GIST]». PLOS ONE. 8 (5): e64102. Bibcode:2013PLoSO ... 864102K. Дои:10.1371 / journal.pone.0064102. ЧВК 3663836. PMID 23717541.
- ^ Реге Т.А., Вагнер А.Дж., Корлесс С.Л., Генрих М.С., Хорник Дж.Л. (апрель 2011 г.). ""Педиатрический тип «Стромальные опухоли желудочно-кишечного тракта у взрослых: особая гистология позволяет прогнозировать генотип и клиническое поведение». Am J Surg Pathol. 35 (4): 495–504. Дои:10.1097 / PAS.0b013e31820e5f7d. PMID 21358303. S2CID 40111082.
Общие источники
- де Сильва CM, Рид Р. (2003). «Опухоли стромы желудочно-кишечного тракта (GIST): мутации C-kit, экспрессия CD117, дифференциальная диагностика и таргетная терапия рака с иматинибом» (PDF). Патол Онкол Рес. 9 (1): 13–9. Дои:10.1007 / BF03033708. PMID 12704441. S2CID 3814815.
- Китамура Ю., Хирота С., Нисида Т. (апрель 2003 г.). «Желудочно-кишечные стромальные опухоли (GIST): модель для молекулярной диагностики и лечения солидных опухолей». Рак Науки. 94 (4): 315–20. Дои:10.1111 / j.1349-7006.2003.tb01439.x. PMID 12824897. S2CID 31070671.
внешняя ссылка
- Поддержка GIST Великобритания
- Вопросы по хирургии в GIST ESUN (15 августа 2006 г.)
- SPAEN (EuroNet для пациентов с саркомой) - Европейская сеть групп по защите интересов пациентов с саркомой, GIST и Desmoid
- GIST Support International
- Группа Спасательных Плотов Международная организация по защите интересов GIST
- Американское онкологическое общество Руководство для пациентов по опухолям GIST.
- Cancer.Net: Стромальная опухоль желудочно-кишечного тракта
| Классификация | |
|---|---|
| Внешние ресурсы |



