WikiDer > Лютеинизирующий гормон
| Хорионический гонадотропин альфа | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | CGA | ||||||
| Альт. символы | ХГЧ, GPHa, GPHA1 | ||||||
| Ген NCBI | 1081 | ||||||
| HGNC | 1885 | ||||||
| OMIM | 118850 | ||||||
| RefSeq | NM_000735 | ||||||
| UniProt | P01215 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 6 q14-q21 | ||||||
| |||||||
| Бета-полипептид лютеинизирующего гормона | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | LHB | ||||||
| Ген NCBI | 3972 | ||||||
| HGNC | 6584 | ||||||
| OMIM | 152780 | ||||||
| RefSeq | NM_000894 | ||||||
| UniProt | P01229 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 19 q13.3 | ||||||
| |||||||
Лютеинизирующий гормон (LH, также известный как лутропин и иногда лутрофин[1]) это гормон произведено гонадотропные клетки в передняя доля гипофиза. Производство ЛГ регулируется гонадотропин-высвобождающим гормоном (ГнРГ) из гипоталамуса.[2]. У женщин резкое повышение уровня ЛГ ("Выброс ЛГ") триггеры овуляция[3] и развитие желтое тело. У мужчин, у которых ЛГ также называли гормон, стимулирующий интерстициальные клетки (ICSH),[4] это стимулирует Ячейка Лейдига изготовление тестостерон.[3] Он действует синергетически с фолликулостимулирующим гормоном (ФСГ).
Структура
LH - гетеродимерный гликопротеин. Каждый мономерный единица гликопротеин молекула; одна альфа и одна бета субъединица составляют полноценный функциональный белок.
Его структура похожа на структуру других гликопротеиновых гормонов, фолликулостимулирующего гормона (ФСГ), тиреотропный гормон (ТТГ) и хорионический гонадотропин человека (ХГЧ). Димер белка содержит 2 гликопептидные субъединицы (помеченные альфа- и бета-субъединицами), которые нековалентно связаны:[5]
- В альфа-субъединицы ЛГ, ФСГ, ТТГ и ХГЧ идентичны и содержат 92 аминокислоты в человеческом, но 96 аминокислоты почти у всех других видов позвоночных (у беспозвоночных нет гликопротеиновых гормонов).
- В бета-субъединицы отличаться. LH имеет бета-субъединицу из 120 аминокислот (LHB), которая обеспечивает его специфическое биологическое действие и отвечает за специфичность взаимодействия с Рецептор ЛГ. Эта бета-субъединица содержит аминокислотную последовательность, которая проявляет большую гомологию с таковой бета-субъединицы ХГЧ и оба стимулируют один и тот же рецептор. Однако бета-субъединица ХГЧ содержит дополнительно 24 аминокислоты, и эти два гормона различаются по составу их сахарных частей.
Различный состав этих олигосахариды влияет на биоактивность и скорость разложения. Биологический период полураспада ЛГ составляет 20 минут, что короче, чем у ФСГ (3-4 часа) и ХГЧ (24 часа).[нужна цитата] Биологический период полураспада ЛГ - 23 часа подкожно[6] или конечный период полувыведения 10-12 часов.[7]
Гены
В ген для альфа-субъединица расположен на хромосома 6q12.21.
Лютеинизирующий гормон бета-субъединица ген локализован в кластере генов LHB / CGB на хромосома 19q13.32. В отличие от активности альфа-гена, активность гена субъединицы бета-LH ограничена гонадотропными клетками гипофиза. Это регулируется гонадотропин-рилизинг гормон от гипоталамус. Ингибин, активин, и половые гормоны не влияют на генетическую активность производства бета-субъединиц ЛГ.
Функция
И у мужчин, и у женщин ЛГ воздействует на эндокринные клетки половых желез, вырабатывая андрогены.
Эффекты у женщин
LH поддерживает клетки тека в яичниках, обеспечивающих андрогены и гормональные предшественники для эстрадиол производство. На момент менструация, ФСГ инициирует фолликулярный рост, особенно влияющий на клетки гранулезы.[8] С ростом эстрогены, Рецепторы ЛГ также экспрессируются в созревающем фолликуле, что заставляет его производить больше эстрадиол. В конце концов, когда фолликул полностью созрел, в 17α-гидроксипрогестерон производство фолликулом подавляет производство эстрогены, что приводит к снижению эстроген-опосредованного негативный отзыв из ГнРГ в гипоталамус, который затем стимулирует высвобождение ЛГ из передний гипофиз.[9] Однако другая теория пика LH - это механизм положительной обратной связи от эстрадиол. Уровни продолжают расти на протяжении фолликулярной фазы, и когда они достигают неизвестного порога, это приводит к пику ЛГ.[10] Этот эффект противоположен обычному механизму отрицательной обратной связи, представленному на более низких уровнях. Другими словами, механизм (ы) еще не ясен. Увеличение производства ЛГ длится от 24 до 48 часов. Этот "выброс ЛГ" вызывает овуляция, тем самым не только высвобождая яйцеклетку из фолликула, но и инициируя преобразование остаточного фолликула в желтое тело что, в свою очередь, производит прогестерон подготовить эндометрий для возможного имплантация. ЛГ необходим для поддержания лютеиновой функции в течение вторых двух недель менструального цикла. Если беременность происходит снижение уровня ЛГ, и вместо этого лютеиновая функция будет поддерживаться действием ХГЧ (хорионический гонадотропин человека), гормона, очень похожего на ЛГ, но секретируемого новой плацентой.
Гонадные стероиды (эстрогены и андрогены) обычно оказывают негативное влияние на высвобождение GnRH-1 на уровне гипоталамуса и гонадотропов, снижая их чувствительность к GnRH. Положительная обратная связь эстрогенов также возникает в гонадальной оси у самок млекопитающих и отвечает за выброс ЛГ в середине цикла, который стимулирует овуляцию. Хотя эстрогены подавляют киспептин (Kp) высвобождение нейронов kiss1 в ARC, эстрогены стимулируют высвобождение Kp из нейронов Kp в AVPV. По мере постепенного повышения уровня эстрогенов преобладает положительный эффект, приводящий к выбросу ЛГ. ГАМК-секретирующие нейроны, которые иннервируют нейроны GnRH-1, также могут стимулировать высвобождение GnRH-1. Эти нейроны ГАМК также обладают ER и могут быть ответственны за выброс GnRH-1. Частично ингибирующее действие эндорфинов на высвобождение GnRH-1 происходит через ингибирование этих нейронов ГАМК. Разрыв фолликула яичника во время овуляции вызывает резкое снижение синтеза эстрогена и заметное увеличение секреции прогестерона желтым телом в яичнике, восстанавливая преимущественно отрицательную обратную связь по гипоталамической секреции GnRH-1.[11]
Эффекты у мужчин
LH действует на Клетки Лейдига из яички и регулируется гонадотропин-рилизинг гормон (ГнРГ).[12] Клетки Лейдига производят тестостерон под контролем LH. ЛГ связывается с рецепторами ЛГ на поверхности мембраны клеток Лейдига. Связывание с этим рецептором вызывает увеличение циклического аденозинмонофосфата (цАМФ), вторичного мессенджера, который позволяет холестерину перемещаться в митохондрии. В митохондриях холестерин превращается в прегненолон с помощью CYP11A1.[13] Затем прегненолон превращается в дегидроэпиандростерон (ДГЭА).[14] Затем DHEA превращается в андростендион с помощью 3β-гидроксистероиддегидрогеназы (3β-HSD).[15] а затем, наконец, преобразован в тестостерон путем 17β-гидроксистероид дегидрогеназа (HSD17B). Начало полового созревания контролируется двумя основными гормонами: ФСГ инициирует сперматогенез, а ЛГ сигнализирует о высвобождении тестостерона.[16] ан андроген который оказывает как эндокринную, так и интратестикулярную активность на сперматогенез.
ЛГ высвобождается из гипофиза и контролируется импульсами гонадотропин-рилизинг гормон. Когда уровень тестостерона в крови низкий, гипофиз стимулируется высвобождением ЛГ.[12] По мере увеличения уровня тестостерона он будет воздействовать на гипофиз через петлю отрицательной обратной связи и, следовательно, ингибировать высвобождение GnRH и LH.[нужна цитата] Андрогены (включая тестостерон и дигидротестостерон) ингибируют моноаминоксидазу (МАО) в шишковидной железе, что приводит к повышению уровня мелатонина и снижению уровня ЛГ и ФСГ за счет вызванного мелатонином повышения уровня гонадотропин-ингибирующего гормона (GnIH)[17] синтез и секреция. Тестостерон также можно ароматизировать в эстрадиол (E2) для ингибирования ЛГ. E2 снижает амплитуду импульса и чувствительность к GnRH от гипоталамуса к гипофизу.[18]
Изменения уровней ЛГ и тестостерона в крови и пульсовой секреции вызваны изменениями в сексуальное возбуждение у мужчин-мужчин.[19]
Нормальные уровни

- Обозначенные диапазоны По биологической стадии может использоваться в тщательно контролируемых менструальных циклах в отношении других маркеров его биологической прогрессии, при этом временная шкала сжимается или растягивается до того, насколько быстрее или медленнее, соответственно, цикл прогрессирует по сравнению со средним циклом.
- Обозначенные диапазоны Межцикловая изменчивость являются более подходящими для использования в неконтролируемых циклах, когда известно только начало менструации, но где женщина точно знает среднюю продолжительность своего цикла и время овуляции, и что они в некоторой степени регулярны, причем временная шкала сжимается или растягивается до насколько средняя продолжительность цикла женщины короче или длиннее, чем в среднем по населению.
- Обозначенные диапазоны Межженщина изменчивость более подходят для использования, когда средняя продолжительность цикла и время овуляции неизвестны, но указано только начало менструации.
Уровень ЛГ обычно низкий во время детство а у женщин - кайф после менопауза. Поскольку ЛГ секретируется в виде импульсов, необходимо следить за его концентрацией в течение достаточного периода времени, чтобы получить правильную информацию об уровне его в крови.
В репродуктивном возрасте типичные уровни составляют от 1 до 20 МЕ / л. Физиологические высокие уровни ЛГ наблюдаются во время всплеска ЛГ (против); обычно они длятся 48 часов.
У мужчин старше 18 лет референсный диапазон оценивается в 1,8–8,6 МЕ / л.[21]
LH измеряется в международные единицы (МЕ). При количественном определении количества ЛГ в образце в МЕ важно знать, по какому международному стандарту была откалибрована ваша партия ЛГ, поскольку они могут значительно варьироваться от года к году. Для ЛГ человека в моче одна МЕ в последнее время определяется как 1/189 часть ампулы, обозначенная 96/602 и распределяемая NIBSC, что соответствует примерно 0,04656 мкг белка ЛГ на одну МЕ, но старые стандартные версии все еще широко используются.[22][23]
Прогнозирование овуляции
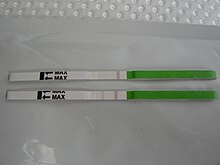
Обнаружение всплеска выброса лютеинизирующего гормона указывает на надвигающееся овуляция. ЛГ может быть обнаружен мочевой наборы для прогнозирования овуляции (OPK, также LH-kit), которые выполняются, как правило, ежедневно, примерно в то время, когда можно ожидать овуляции.[25] Преобразование отрицательного значения в положительное означает, что овуляция должна произойти в течение 24–48 часов, что дает женщинам два дня на то, чтобы заняться этим. половой акт или же искусственное оплодотворение с намерением зачатие.[26]
Рекомендуемая частота тестирования различается у разных производителей. Например, тест Clearblue проводится ежедневно, и его повышенная частота не снижает риск пропустить выброс ЛГ.[27] С другой стороны, китайская компания Наньтун Эгенс Биотехнология рекомендует использовать их тест два раза в день.[28] При тестировании один раз в день не было обнаружено значительной разницы между тестированием ЛГ утром и вечером в отношении показателей зачатия,[29] а рекомендации о том, в какое время дня проходить тест, различаются между производителями и медицинскими работниками.[30] Тесты можно считывать вручную с помощью бумажной полоски, меняющей цвет, или в цифровом виде с помощью считывающей электроники.
Тесты на лютеинизирующий гормон можно сочетать с тестами на эстрадиол в таких тестах, как Clearblue монитор фертильности.[требуется медицинская цитата]
Чувствительность тестов на ЛГ измеряется в милли международная единица, с широко доступными тестами в диапазоне 10–40 м.и.е. (чем меньше число, тем выше чувствительность).[нужна цитата]
Поскольку сперма может оставаться жизнеспособной у женщины в течение нескольких дней, тесты на ЛГ не рекомендуются для контрацептив Практика, поскольку всплеск ЛГ обычно происходит после начала фертильного окна.
Состояния болезни
Избыток
У детей с преждевременное половое созревание гипофизарного или центрального происхождения, уровни ЛГ и ФСГ могут находиться в репродуктивном диапазоне вместо низких уровней, характерных для их возраста.
В репродуктивном возрасте относительно повышенный уровень ЛГ часто наблюдается у пациентов с синдром поликистоза яичников; однако для них было бы необычно иметь уровни ЛГ за пределами нормального репродуктивного диапазона.
Стабильно высокие уровни ЛГ указывают на ситуации, когда нормальная ограничивающая обратная связь от гонад отсутствует, что приводит к выработке гипофизом как ЛГ, так и ФСГ. Это типично для менопаузы, но ненормально в репродуктивном возрасте. Там могут быть признаки:
- Преждевременная менопауза
- Гонадная дисгенезия, Синдром Тернера, Синдром Клайнфельтера
- Кастрация
- Синдром Свайера
- Синдром поликистоза яичников
- Определенные формы врожденная гиперплазия надпочечников
- Тестикулярная недостаточность
- Беременность - BetaHCG может имитировать ЛГ, поэтому тесты могут показать повышенный уровень ЛГ.
Примечание: медицинский препарат для подавления секреции лютеинизирующего гормона является Бутиназоцин.[31]
Дефицит
Снижение секреции ЛГ может привести к нарушению функции гонад (гипогонадизм). Это состояние обычно проявляется у мужчин как нарушение производства нормального количества сперматозоидов. У женщин аменорея обычно наблюдается. Состояния с очень низкой секрецией ЛГ включают:
- Синдром Паскуалини[32][33][34]
- Синдром Каллмана
- Гипоталамическое подавление
- Гипопитуитаризм
- Расстройство пищевого поведения
- Триада спортсменок
- Гиперпролактинемия
- Гипогонадизм
- Гонадосупрессивная терапия
- Антагонист ГнРГ
- Агонист ГнРГ (вызывает начальную стимуляцию (обострение) с последующей постоянной блокадой рецептора гипофиза ГнРГ)
Как лекарство
ЛГ доступен в смеси с ФСГ в виде менотропин, и другие формы мочевыводящих гонадотропины. Более очищенные формы гонадотропинов мочи могут снижать долю ЛГ по отношению к ФСГ. Рекомбинантный ЛГ доступен как лутропин альфа (Luveris).[35] Все эти лекарства нужно вводить парентерально. Они обычно используются в терапии бесплодия для стимуляции развития фолликулов, наиболее заметным из которых является ЭКО терапия.
Часто препараты ХГЧ используются как заменители ЛГ, потому что они активируют тот же рецептор. Используемый в медицине ХГЧ получают из мочи беременных женщин, он менее дорог и имеет более длительный период полураспада, чем ЛГ.
Роль в фосфорилировании
Фосфорилирование это биохимический процесс, который включает добавление фосфата к органическому соединению. Стероидогенез влечет за собой процессы, посредством которых холестерин превращается в биологически активные стероидные гормоны. Недавнее исследование показывает, что ЛГ через сигнальный путь PKA регулирует фосфорилирование и локализацию DRP1 в митохондриях стероидогенный клетки яичника.[36]
Рекомендации
- ^ Ujihara M, Yamamoto K, Nomura K, Toyoshima S, Demura H, Nakamura Y и др. (Июнь 1992 г.). «Субъединично-специфическая сульфатация олигосахаридов, относящаяся к зарядовой гетерогенности в изоформах свиного лутрофина». Гликобиология. 2 (3): 225–31. Дои:10.1093 / гликоб / 2.3.225. PMID 1498420.
- ^ Stamatiades, Джордж А .; Кайзер, Урсула Б. (2018-03-05). «Регулирование гонадотропинов с помощью пульсирующего гонадолиберина: передача сигналов и экспрессия генов». Молекулярная и клеточная эндокринология. Сигнальные пути, регулирующие функции гипофиза. 463: 131–141. Дои:10.1016 / j.mce.2017.10.015. ISSN 0303-7207.
- ^ а б Носек, Томас М. "Раздел 5 / 5ч9 / с5ч9_5". Основы физиологии человека. Архивировано из оригинал на 24.03.2016.
- ^ Louvet JP, Harman SM, Ross GT (май 1975 г.). «Влияние человеческого хорионического гонадотропина, человеческого гормона, стимулирующего интерстициальные клетки, и человеческого фолликулостимулирующего гормона на вес яичников у гипофизэктомированных эстрогеном незрелых самок крыс». Эндокринология. 96 (5): 1179–86. Дои:10.1210 / эндо-96-5-1179. PMID 1122882.
- ^ Цзян X, Диас Дж.А., Хэ X (январь 2014 г.). «Структурная биология гликопротеиновых гормонов и их рецепторов: понимание передачи сигналов». Молекулярная и клеточная эндокринология. 382 (1): 424–451. Дои:10.1016 / j.mce.2013.08.021. PMID 24001578.
- ^ Эскурра Д., Хумайдан П. (октябрь 2014 г.). «Обзор лютеинизирующего гормона и хорионического гонадотропина человека при использовании в вспомогательных репродуктивных технологиях». Репродуктивная биология и эндокринология. 12 (1): 95. Дои:10.1186/1477-7827-12-95. ЧВК 4287577. PMID 25280580.
- ^ le Cotonnec JY, Porchet HC, Beltrami V, Munafo A (февраль 1998 г.). «Клиническая фармакология рекомбинантного лютеинизирующего гормона человека: Часть I. Фармакокинетика после внутривенного введения здоровым женщинам-добровольцам и сравнение с лютеинизирующим гормоном человека в моче». Фертильность и бесплодие. 69 (2): 189–94. Дои:10.1016 / S0015-0282 (97) 00501-3. PMID 9496327.
- ^ Боуэн Р. (13 мая 2004 г.). «Гонадотропины: лютеинизирующие и фолликулостимулирующие гормоны». Государственный университет Колорадо. Получено 12 марта 2012.
- ^ Махеш В.Б. (январь 2012 г.). "Гирсутизм, вирилизм, поликистоз яичников и система обратной связи стероид-гонадотропин: ретроспектива карьеры". Американский журнал физиологии. Эндокринология и метаболизм. 302 (1): E4 – E18. Дои:10.1152 / ajpendo.00488.2011. ЧВК 3328092. PMID 22028409.
- ^ Учебник медицинской физиологии Гайтона и Холла, 2006, стр. 1021
- ^ Норрис Д.О., Карр Дж. А. (2013). Эндокринология позвоночных. Академическая пресса. п. 126. ISBN 978-0-12-396465-6.
- ^ а б «Медицинское лечение бесплодия у мужчин: ХГЧ + ЛГ + рекомбинантный ФСГ для увеличения количества сперматозоидов посредством сперматогенеза». Архивировано из оригинал 19 февраля 2015 г.. Получено 6 апреля 2015.[ненадежный медицинский источник?]
- ^ Зиркин Б.Р., Пападопулос В. (июль 2018 г.). «Клетки Лейдига: формирование, функции и регуляция». Биология размножения. 99 (1): 101–111. Дои:10.1093 / biolre / ioy059. ЧВК 6044347. PMID 29566165.
- ^ Ахтар М.К., Келли С.Л., Кадербхай М.А. (ноябрь 2005 г.). «Модуляция цитохрома b (5) активности 17 {альфа} гидроксилазы и 17-20 лиазы (CYP17) в стероидогенезе». Журнал эндокринологии. 187 (2): 267–74. Дои:10.1677 / joe.1.06375. PMID 16293774.
- ^ Лю Л., Кан Дж., Дин Х, Чен Д., Чжоу Ю., Ма Х (2015). «Регулируемый дегидроэпиандростероном биосинтез тестостерона посредством активации пути передачи сигналов ERK1 / 2 в первичных клетках Лейдига крыс». Клеточная физиология и биохимия. 36 (5): 1778–92. Дои:10.1159/000430150. PMID 26184424.
- ^ Одуволе О.О., Пелтокето Х., Хухтаниеми ИТ (2018). «Роль фолликулостимулирующего гормона в сперматогенезе». Границы эндокринологии. Питательные вещества. 9: 763. Дои:10.3389 / fendo.2018.00763. ЧВК 6302021. PMID 30619093.
- ^ Убука Т., Сон Ю.Л., Тобари Ю., Нарихиро М., Bentley GE, Кригсфельд Л.Дж., Цуцуи К. (2014). «Центральная и прямая регуляция активности яичек с помощью гонадотропин-ингибирующего гормона и его рецептора». Границы эндокринологии. 5: 8. Дои:10.3389 / fendo.2014.00008. ЧВК 3902780. PMID 24478760.
- ^ Питтелуд Н., Дуайер А.А., ДеКруз С., Ли Х., Боппл П.А., Кроули В.Ф., Хейс Ф.Дж. (март 2008 г.). «Подавление секреции лютеинизирующего гормона тестостероном у мужчин требует ароматизации его гипофиза, но не его гипоталамических эффектов: данные тандемного исследования нормальных мужчин и мужчин с дефицитом гонадотропин-рилизинг-гормона». Журнал клинической эндокринологии и метаболизма. 93 (3): 784–91. Дои:10.1210 / jc.2007-2156. ЧВК 2266963. PMID 18073301.
- ^ Столеру С.Г., Эннаджи А., Курно А., Спира А. (1993). «На пульсирующую секрецию ЛГ и уровень тестостерона в крови влияет сексуальное возбуждение у мужчин». Психонейроэндокринология. 18 (3): 205–18. Дои:10.1016/0306-4530(93)90005-6. PMID 8516424. S2CID 23595343.
- ^ Хэггстрём М (2014). «Референсные диапазоны для эстрадиола, прогестерона, лютеинизирующего гормона и фолликулостимулирующего гормона во время менструального цикла». WikiJournal of Медицина. 1 (1). Дои:10.15347 / wjm / 2014.001. ISSN 2002-4436.
- ^ Медицинские лаборатории Mayo - Идентификатор теста: ЛГ, лютеинизирующий гормон (ЛГ), сыворотка В архиве 2016-09-25 в Wayback Machine, получено в декабре 2012 г.
- ^ Всемирная организация здравоохранения предложила международный стандарт лютеинизирующего гормона. Комитет экспертов ВОЗ по биологической стандартизации. Всемирная организация здоровья. Женева. 2003 г.
- ^ Международный стандарт ВОЗ, лютеинизирующий гормон, человеческий рекомбинантный. Национальный институт биологических стандартов и контроля.
- ^ Дансон ДБ, Бэрд Д.Д., Уилкокс А.Дж., Вайнберг С.Р. (июль 1999 г.). «Вероятность клинической беременности в конкретный день на основе двух исследований с несовершенными показателями овуляции». Репродукция человека. 14 (7): 1835–9. Дои:10.1093 / humrep / 14.7.1835. PMID 10402400.
- ^ Nielsen MS, Barton SD, Hatasaka HH, Stanford JB (август 2001 г.). «Сравнение нескольких одноступенчатых домашних наборов для определения лютеинизирующего гормона в моче с OvuQuick». Фертильность и бесплодие. 76 (2): 384–7. Дои:10.1016 / S0015-0282 (01) 01881-7. PMID 11476792.
- ^ «Часто задаваемые вопросы о наборе для прогнозирования овуляции». Фертильность Плюс. Архивировано из оригинал 12 марта 2012 г.. Получено 12 марта 2012.[ненадежный медицинский источник?]
- ^ «Четкие инструкции по тесту на синюю овуляцию». Руководство по овуляции. Получено 2018-01-19.
- ^ «Расширенный тест на овуляцию» (PDF). Homehealth-UK. Получено 2018-01-19. Версия 1.1 11.02.15
- ^ Мартинес А.Р., Бернардус Р.Э., Вермейден Дж. П., Шумейкер Дж. (Март 1994 г.). «График внутриматочного осеменения после выявления выброса лютеинизирующего гормона в моче и результатов беременности». Гинекологическая эндокринология. 8 (1): 1–5. Дои:10.3109/09513599409028450. PMID 8059611.
- ^ Стр.67 в: Годвин И. Мениру (2001). Кембриджское руководство по лечению бесплодия и вспомогательной репродукции. Издательство Кембриджского университета.
- ^ Патент США 4,406,904
- ^ Вайс Дж., Аксельрод Л., Уиткомб Р. В., Харрис П. Е., Кроули В. Ф., Джеймсон Дж. Л. (январь 1992 г.). «Гипогонадизм, вызванный заменой одной аминокислоты в бета-субъединице лютеинизирующего гормона». Медицинский журнал Новой Англии. 326 (3): 179–83. Дои:10.1056 / NEJM199201163260306. PMID 1727547.
- ^ Valdes-Socin H, Salvi R, Daly AF, Gaillard RC, Quatresooz P, Tebeu PM, et al. (Декабрь 2004 г.). «Гипогонадизм у пациента с мутацией в гене бета-субъединицы лютеинизирующего гормона». Медицинский журнал Новой Англии. 351 (25): 2619–25. Дои:10.1056 / NEJMoa040326. PMID 15602022.
- ^ Вальдес-Социн Х, Дейли А.Ф., Бекерс А (2017). «Дефицит лютеинизирующего гормона: исторические взгляды и перспективы на будущее» (PDF). Остин Андрология. 2 (1): 1015.
- ^ Информация о Luveris[ненадежный медицинский источник?] В архиве 18 июня 2006 г. в г. Wayback Machine
- ^ Plewes MR, Hou X, Talbott HA, Zhang P, Wood JR, Cupp AS, Davis JS (февраль 2020 г.). «Лютеинизирующий гормон регулирует фосфорилирование и локализацию митохондриального эффекторного динамин-родственного протеина-1 (DRP1) и стероидогенез в желтом теле крупного рогатого скота». Журнал FASEB. Федерация американских обществ экспериментальной биологии. 34 (4): 5299–5316. Дои:10.1096 / fj.201902958R. ЧВК 7136153. PMID 32077149.
внешняя ссылка
- Лютеинизирующий + гормон в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)