WikiDer > Миристоилирование

Миристоилирование модификация липидирования, где миристоильная группа, полученный из миристиновая кислота, является ковалентно прикрепленный амидная связь к альфа-аминогруппе N-концевой глицин остаток.[1] Миристиновая кислота - это 14-углеродная насыщенная жирная кислота (14: 0) с систематическим названием п-Тетрадекановая кислота. Эта модификация может быть добавлена либо совместно, либо посттрансляционный. N-миристоилтрансфераза (NMT) катализирует миристиновая кислота реакция присоединения в цитоплазма ячеек.[2] Это событие липидирования является наиболее часто встречающимся типом ацилирования жирных кислот. [3] и распространен среди многих организмов, включая животные, растения, грибы, простейшие [4] и вирусы. Миристоилирование допускает слабые белок-белковые и белок-липидные взаимодействия.[5] и играет важную роль в нацеливании на мембраны, белок-белковые взаимодействия и широко функционирует в различных преобразование сигнала пути.
Открытие
В 1982 году лаборатория Коити Титани идентифицировала "N-концевую блокирующую группу" на каталитической субъединице циклическая АМФ-зависимая протеинкиназа у коров как п-Тетрадеканоил.[6] Почти одновременно в лаборатории Клода Б. Клее эта же группа, блокирующая N-конец, была далее охарактеризована как миристиновая кислота.[7] Обе лаборатории сделали это открытие, используя схожие методы: бомбардировка быстрыми атомами, масс-спектрометрии, и газовая хроматография.[6][7]
N-миристоилтрансфераза
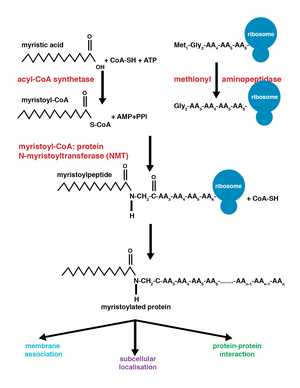
Фермент N-миристоилтрансфераза (NMT) или глицилпептид N-тетрадеканоилтрансфераза отвечает за необратимое добавление миристоильной группы к N-концевым или внутренним остаткам глицина белков. Эта модификация может происходить совместно или посттрансляционный. У позвоночных эта модификация осуществляется двумя NMT, NMT1 и NMT2, оба являются членами GCN5 ацетилтрансфераза надсемейство.[8]
Структура
В Кристальная структура NMT обнаруживает две идентичные субъединицы, каждая со своим собственным сайтом связывания миристоил-КоА. Каждая субъединица состоит из большого седловидного β-лист окружен α-спирали. Симметрия складки псевдодвойственна.[требуется разъяснение] Миристоил-КоА связывается на N-концевой часть, в то время как C-терминал конец связывает белок.[9]
Механизм
Присоединение миристоильной группы происходит через реакция нуклеофильного присоединения-элиминирования. Во-первых, миристоил коэнзим А (КоА) расположен в кармане для привязки NMT так, чтобы карбонил стоит перед двумя аминокислотными остатками, фенилаланин 170 и лейцин 171.[9] Это поляризует карбонил, так что на углероде возникает чистый положительный заряд, что делает его уязвимым для нуклеофильной атаки со стороны глицин остаток изменяемого белка. Когда миристоил-КоА связывается, NMT переориентируется, чтобы позволить связывание пептида. С-конец NMT затем действует как общая основа для депротонировать NH3+, активируя аминогруппа атаковать карбонильная группа миристоил-КоА. Результирующий тетраэдрический промежуточный стабилизируется за счет взаимодействия положительно заряженных оксианионная дыра и отрицательно заряженный алкоксид анион. Затем высвобождается бесплатный CoA, вызывая конформационное изменение в ферменте, который позволяет высвобождать миристоилированный пептид.[2]
Совместное и пост-трансляционное добавление
Ко-трансляционные и посттрансляционные ковалентные модификации позволяют белкам развить более высокий уровень сложности клеточной функции, дополнительно добавляя разнообразие к протеом.[10] Добавление миристоил-КоА к белку может происходить во время трансляции белка или после нее. Во время ко-трансляционного добавления миристоильной группы N-концевой глицин модифицируется после расщепления N-конца метионин остаток во вновь формирующемся, растущем полипептид.[1] Посттрансляционное миристоилирование обычно происходит после каспаза событие расщепления, приводящее к обнажению внутреннего остатка глицина, который затем становится доступным для добавления миристиновой кислоты.[8]
Функции
Миристоилированные белки
| Протеин | Физиологическая роль | Функция миристоилирования |
|---|---|---|
| Актин | Цитоскелет структурный белок | Посттрансляционное миристоилирование при апоптозе [8] |
| Ставка | Белок, способствующий апоптозу | Посттрансляционное миристоилирование после расщепления каспазой направляет белок на митохондриальная мембрана [8] |
| ОТМЕТКИ | сшивание актина при фосфорилировании протеинкиназой C | Совместное трансляционное миристоилирование способствует ассоциации с плазматической мембраной |
| G-белок | Сигнализация GTPase | Совместное трансляционное миристоилирование способствует ассоциации с плазматической мембраной[11] |
| Гельсолин | Актин, расщепляющий нити | Посттрансляционное миристоилирование усиливает антиапоптотические свойства [8] |
| PAK2 | Серин / треонинкиназа рост клеток, подвижность, стимулятор выживания | Посттрансляционное миристоилирование усиливает апоптотические свойства и индуцирует плазматическая мембрана локализация[8] |
| Арф | везикулярный регулирование торговли людьми и ремоделирования актина | N-конец миристоилирования способствует мембранной ассоциации |
| Гиппокальцин | Нейрональный датчик кальция | Содержит Ca2+/ миристоил переключатель |
Молекулярный переключатель миристоилирования
Миристоилирование не только разнообразит функцию белка, но и добавляет к нему уровни регуляции. Одна из наиболее распространенных функций миристоильной группы заключается в мембранная ассоциация и клеточная локализация модифицированного протеина. Хотя миристоильная группа добавляется на конец белка, в некоторых случаях она изолируется внутри гидрофобный экспонируются области белка, а не растворителя.[5] Регулируя ориентацию миристоильной группы, эти процессы могут быть сильно скоординированы и строго контролироваться. Таким образом, миристоилирование представляет собой форму "молекулярный переключатель."[12]
И гидрофобные миристоильные группы, и «основные участки» (высоко положительные области на белке) характеризуют миристоил-электростатические переключатели. Базовый патч позволяет благоприятно электростатические взаимодействия происходить между отрицательно заряженными фосфолипидные головки мембраны и положительной поверхности ассоциированного белка. Это обеспечивает более тесную ассоциацию и направленную локализацию белков.[5]
Миристоил-конформационные переключатели могут иметь несколько форм. Связывание лиганда к миристоилированному белку с секвестрированной миристоильной группой может вызвать конформационное изменение в белке, что приводит к обнажению миристоильной группы. Точно так же некоторые миристоилированные белки активируются не указанным лигандом, а путем обмена ВВП для GTP от факторы обмена гуаниновых нуклеотидов в камере. Как только GTP связывается с миристоилированным белком, он активируется, обнажая миристоильную группу. Эти конформационные переключатели могут использоваться в качестве сигнала для клеточной локализации, мембранных белков и белок-белковые взаимодействия.[5][12][13]
Двойные модификации миристоилированных белков
Дальнейшие модификации N-миристоилированных белков могут добавить еще один уровень регуляции миристоилированных белков. Двойной ацилирование может способствовать более строго регулируемой локализации белка, в частности, направляя белки на липидные рафты на мембранах[14] или обеспечение диссоциации миристоилированных белков от мембран.
Миристоилирование и пальмитоилирование обычно являются сопряженными модификациями. Само по себе миристоилирование может способствовать переходным мембранным взаимодействиям.[5] которые позволяют белкам закрепляться на мембранах, но легко диссоциируют. Дальнейшее пальмитоилирование обеспечивает более плотное закрепление и более медленную диссоциацию от мембран, когда этого требует клетка. Эта специфическая двойная модификация важна для Рецептор, связанный с G-белком путей и называется переключателем двойного ацилирования жирных кислот.[5][8]
За миристоилированием часто следует фосфорилирование ближайших остатков. Дополнительное фосфорилирование того же белка может снизить электростатическое сродство миристоилированного белка к мембране, вызывая перемещение этого белка в цитоплазму после диссоциации от мембраны.[5]
Передача сигнала
Миристоилирование играет жизненно важную роль в нацеливании на мембраны и преобразование сигнала[15] в реакции растений на стресс окружающей среды. Кроме того, при передаче сигнала через G-белок пальмитоилирование субъединицы α, пренилирование субъединицы γ, и миристоилирование участвует в прикреплении G-белка к внутренней поверхности плазматической мембраны, так что G-белок может взаимодействовать со своим рецептором.[16]
Апоптоз
Миристоилирование является неотъемлемой частью апоптоз, или запрограммированная гибель клеток. Апоптоз необходим для гомеостаза клеток и возникает, когда клетки находятся в состоянии стресса, например: гипоксия или Повреждение ДНК. Апоптоз может протекать путем активации митохондрий или рецепторов. При апоптозе, опосредованном рецепторами, пути апоптоза запускаются, когда клетка связывает рецептор смерти. В одном из таких случаев связывание рецептора смерти инициирует образование сигнальный комплекс, вызывающий смерть, комплекс, состоящий из множества белков, включая несколько каспаз, в том числе каспаза 3. Каспаза 3 расщепляет ряд белков, которые впоследствии миристоилируются с помощью NMT. В агонист смерти проапоптотического BH3-взаимодействующего домена (Bid) является одним из таких белков, который после миристоилирования перемещается в митохондрии где это побуждает выпуск цитохром с приводит к гибели клеток.[8] Актин, гельсолин и p21-активированная киназа 2 PAK2 три других белка, которые миристоилируются после расщепления каспаза 3, что приводит либо к усилению, либо к понижению регуляции апоптоза.[8]
Влияние на здоровье человека
Рак
c-Src представляет собой ген, который кодирует протоонкоген тирозин-протеинкиназу Src, белок, важный для нормального митотический цикл. Он фосфорилируется и дефосфорилируется, чтобы включать и выключать передачу сигналов. Тирозин-протеинкиназа Src протоонкогена должна быть локализована в плазматическая мембрана для фосфорилирования других нижестоящих мишеней; миристоилирование отвечает за это мембранное нацеливание мероприятие. Повышенное миристоилирование c-Src может привести к усилению распространение клеток и нести ответственность за превращение нормальных клеток в раковые.[5][13][17] Активация c-Src может привести к так называемому признаки рака: усиление ангиогенез, распространение и вторжение.[18]
Вирусная инфекционность
ВИЧ-1 это ретровирус который основан на миристоилировании одного из своих структурных белков, чтобы успешно упаковать его геном, собрать и созреть в новую инфекционную частицу. Белок вирусной матрицы, самый N-концевой домен рвотный полипротеин миристоилирован.[19] Эта модификация миристоилирования направлена на gag к мембране клетки-хозяина. Используя миристоил-электростатический переключатель,[12] включая базовый патч на матричном белке, кляп может собраться в липидные рафты на плазматическая мембрана для вирусный сборка, бутонизация и дальнейшее созревание.[17] Чтобы предотвратить вирусную инфекционность, миристоилирование матричного белка может стать хорошей лекарственной мишенью.
Прокариотические и эукариотические инфекции
Некоторые NMT являются терапевтическими мишенями для разработки лекарств против бактериального инфекции. Было показано, что миристоилирование необходимо для выживания ряда болезнетворных грибы, из их C. albicans и С. neoformans. В дополнение к прокариотический бактерии, НМЦ многих болезнетворных эукариотический организмы были идентифицированы как мишени для наркотиков также. Правильная работа NMT в простейшие Leishmania major и Leishmania donovani (лейшманиоз), Trypanosoma brucei (Африканская сонная болезнь), и P. falciparum (малярия) необходим для выживания паразитов. Ингибиторы этих организмов в настоящее время исследуются. А пиразол сульфонамид ингибитор было выявлено, что избирательно связывает Т. brucei, соревнуясь за связывание пептида сайта, тем самым подавляя ферментативную активность и устраняя паразита из кровотока мышей с Африканская сонная болезнь.[8]
Смотрите также
использованная литература
- ^ а б Кокс, Дэвид Л. Нельсон, Майкл М. (2005). Принципы биохимии Ленингера (4-е изд.). Нью-Йорк: W.H. Фримен. ISBN 978-0716743392.
- ^ а б Таманой, отредактированный Фуюхико; Сигман, Дэвид С. (2001). Липидирование белков (3-е изд.). Сан-Диего, Калифорния: Academic Press. ISBN 978-0-12-122722-7.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Мохаммадзаде, Фатемех; Хоссейни, Вахид; Мехдизаде, Амир; Дэни, Кристиан; Дараби, Масуд (30.11.2018). «Метод общего анализа глобального ацилирования белков методом газожидкостной хроматографии». IUBMB Life. 71 (3): 340–346. Дои:10.1002 / iub.1975. ISSN 1521-6543. PMID 30501005.
- ^ Кара, UA; Стензель, диджей; Инграм, LT; Бушелл, GR; Lopez, JA; Кидсон, К. (апрель 1988 г.). «Ингибирующее моноклональное антитело против (миристилированного) низкомолекулярного антигена из Plasmodium falciparum, связанного с мембраной паразитофорной вакуоли». Инфекция и иммунитет. 56 (4): 903–9. Дои:10.1128 / IAI.56.4.903-909.1988. ЧВК 259388. PMID 3278984.
- ^ а б c d е ж г час Фарази, Т.А. (29 августа 2001 г.). "Биология и энзимология N-миристоилирования белков". Журнал биологической химии. 276 (43): 39501–39504. Дои:10.1074 / jbc.R100042200. PMID 11527981.
- ^ а б Carr, SA; Биманн, К; Сёдзи, S; Пармели, округ Колумбия; Титани, К. (октябрь 1982 г.). «n-Тетрадеканоил представляет собой NH2-концевую блокирующую группу каталитической субъединицы циклической АМФ-зависимой протеинкиназы из сердечной мышцы крупного рогатого скота». Труды Национальной академии наук Соединенных Штатов Америки. 79 (20): 6128–31. Дои:10.1073 / pnas.79.20.6128. ЧВК 347072. PMID 6959104.
- ^ а б Эйткен, А; Коэн, П; Сантикарн, S; Уильямс, DH; Calder, AG; Смит, А; Klee, CB (27 декабря 1982 г.). «Идентификация NH2-концевой блокирующей группы кальциневрина B как миристиновая кислота». Письма FEBS. 150 (2): 314–8. Дои:10.1016 / 0014-5793 (82) 80759-х. PMID 7160476.
- ^ а б c d е ж г час я j Мартин, Дейл Д.О .; Бошам, Эрван; Бертьяме, Люк Г. (январь 2011 г.). «Посттрансляционное миристоилирование: жир имеет значение в жизни и смерти клеток». Биохимия. 93 (1): 18–31. Дои:10.1016 / j.biochi.2010.10.018. PMID 21056615.
- ^ а б Bhatnagar, RS; Fütterer, K; Waksman, G; Гордон, JI (23 ноября 1999 г.). «Структура миристоил-КоА: протеин-N-миристоилтрансфераза». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1441 (2–3): 162–72. Дои:10.1016 / с 1388-1981 (99) 00155-9. PMID 10570244.
- ^ Снайдер, Джаред. «Обзор посттрансляционных модификаций (PTM)». Thermo Scientific.
- ^ Чен, Кэтрин А .; Мэннинг, Дэвид Р. (2001). «Регулирование белков G путем ковалентной модификации». Онкоген. 20 (13): 1643–1652. Дои:10.1038 / sj.onc.1204185. PMID 11313912.
- ^ а б c Маклафлин, Стюарт; Адерем, Алан (июль 1995 г.). «Миристоил-электростатический переключатель: модулятор обратимых межмембранных взаимодействий». Тенденции в биохимических науках. 20 (7): 272–276. Дои:10.1016 / S0968-0004 (00) 89042-8. PMID 7667880.
- ^ а б Райт, Меган Х .; Heal, William P .; Манн, Дэвид Дж .; Тейт, Эдвард В. (7 ноября 2009 г.). «Миристоилирование белков в здоровье и болезни». Журнал химической биологии. 3 (1): 19–35. Дои:10.1007 / s12154-009-0032-8. ЧВК 2816741. PMID 19898886.
- ^ Левенталь, Илья; Гжибек, Михал; Саймонс, Кай (3 августа 2010 г.). «Смазывая их путь: модификации липидов определяют ассоциацию белков с мембранными рафтами». Биохимия. 49 (30): 6305–6316. Дои:10.1021 / bi100882y. PMID 20583817.
- ^ ХАЯСИ, Нобухиро; ТИТАНИ, Коити (2010). «N-миристоилированные белки, ключевые компоненты в системах передачи внутриклеточного сигнала, обеспечивающие быстрые и гибкие клеточные ответы». Труды Японской академии, серия B. 86 (5): 494–508. Дои:10.2183 / pjab.86.494. ЧВК 3108300. PMID 20467215.
- ^ Wall, Mark A .; Коулман, Дэвид Э .; Ли, Итан; Иньигес-Ллухи, Хорхе А .; Познер, Брюс А .; Гилман, Альфред Дж .; Спранг, Стивен Р. (декабрь 1995 г.). «Структура гетеротримера G-белка Giα1β1γ2». Ячейка. 83 (6): 1047–1058. Дои:10.1016/0092-8674(95)90220-1. PMID 8521505.
- ^ а б Сёдзи, S; Кубота, Y (февраль 1989 г.). «[Функция миристоилирования белков в клеточной регуляции и вирусной пролиферации]». Якугаку Засши. 109 (2): 71–85. Дои:10.1248 / yakushi1947.109.2_71. PMID 2545855.
- ^ Ханахан, Дуглас; Вайнберг, Роберт А. (март 2011 г.). «Признаки рака: следующее поколение». Ячейка. 144 (5): 646–674. Дои:10.1016 / j.cell.2011.02.013. PMID 21376230.
- ^ Hearps, AC; Янс, Д.А. (март 2007 г.). «Регулирование функций матричного белка ВИЧ-1». Исследования СПИДа и ретровирусы человека. 23 (3): 341–6. Дои:10.1089 / помощь.2006.0108. PMID 17411366.