WikiDer > Спиротрипростатин В
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| C21ЧАС21N3О3 | |
| Молярная масса | 363,41 г / моль |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Спиротрипростатин В является индол алкалоид найдено в Aspergillus fumigatus грибок, который принадлежит к классу встречающихся в природе 2,5-дикетопиперазины.[1] Спиротрипростатин B и несколько других индольных алкалоидов (включая Спиротрипростатин А, а также другие трипростатины и циклотрипростатины) обладают анти-митотический свойств, и как таковые они стали вызывать большой интерес как анти-рак наркотики.[2] Из-за этого общий синтез Определение этих соединений является основным направлением деятельности химиков-органиков, и в химической литературе опубликован ряд различных синтезов.
Полный синтез
Первый полный синтез был осуществлен в 2000 г. группой Данишефского на заводе Колумбийский университет,[3] с рядом других синтезов, последовавших вскоре после этого Уильямсом,[4] Ганесан,[5] Фудзи,[6] Каррейра,[7] Хорн,[8] Сверхчеловек,[9] и совсем недавно Трост.[10]
С синтетической точки зрения, наиболее сложными структурными особенностями молекулы являются C3 спироциклический соединение кольца и соседний пренилзамещенный углерод. Подходы к подготовке скелета спиротрипростатина B значительно различались.
Данишефский синтез спиротрипростатина В
В синтезе Данишефского амин, полученный из триптофан был сжат с альдегид, вызывая Типа Манниха реакция, в которой кулон оксиндол действовал как нуклеофил к промежуточному иминий разновидность.
Синтез спиротрипростатина В Вильямса
В синтезе группой Вильямса использовалась 3-компонентная реакция сочетания. Вторичный амин был объединен с альдегид с образованием промежуточного азометина илида, который прошел 1,3-диполярное циклоприсоединение с ненасыщенным оксиндол также присутствует в реакционной смеси.
Ганезан синтез спиротрипростатина B
Ганешан использовал биомиметик стратегия в его синтезе спиротрипростатина B. индол лечился с N-бромосукцинимид вызвать окислительную перегруппировку, образуя четвертичный стереоцентр в диастереоселективный манера.
Синтез спиротрипростатина B Fuji
В синтезе, разработанном группой Fuji, стереохимия на спироциклический углерод был установлен реакцией нитроолефинирования. An оксиндол с боковой пренильной группой реагировал с нитроолефином, несущим хиральный уходящая группа.
Каррейра синтез спиротрипростатина B
Группа Carreira использовала йодид магния, способствующий реакции аннуляции, в своем подходе к спиротрипростатину B. оксиндол несущий циклопропан был отреагирован я добываю в присутствии иодида магния, вызывая реакцию расширения кольца.
Синтез спиротрипростатина В Хорна
В синтезе спиротрипростатина B Хорна также использовались Типа Манниха процесс, в котором хлор-индол служил про-нуклеофил. Циклизация была вызвана обработкой кулона я добываю с ацилхлорид происходит от пролин. Результирующий иминий вид подвергся нападению хлор-индол, формируя спироциклический связь.
Синтез спиротрипростатина В сверхчеловека
Группа Overman использовала Чертовски реакция подготовить молекулу. Йодо-анилин с привязанным алкен подвергся палладий катализ. Промежуточная форма палладий-аллил была перехвачена кулоном амид азот для образования пренила стереоцентр в той же реакции.
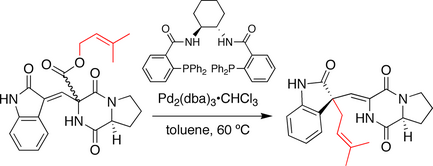
Синтез трост-спиротрипростатина В
В синтезе, разработанном группой Trost, стереохимия в спироциклический соединение кольца устанавливается последовательностью декарбоксилирования-пренилирования, напоминающей последовательность Реакция Кэрролла. Здесь прениловый эфир служит как нуклеофил и электрофил предшественник. После лечения хиральный палладиевый катализатор пренильная группа ионизирует и декарбоксилат. Результирующий ион пара впоследствии рекомбинирует с образованием пренилированного продукта. Примечательно, что происходит миграция двойной связи, и пренильная группа атакуется на оксиндол углерод.
Рекомендации
- ^ Borthwick AD; и другие. (2012). «2,5-Дикетопиперазины: синтез, реакции, медицинская химия и биоактивные натуральные продукты». Химические обзоры. 112 (7): 3641–3716. Дои:10.1021 / cr200398y. PMID 22575049.
- ^ Цуй, CB (1996). «Спиротрипростатин B, новый ингибитор клеточного цикла млекопитающих, продуцируемый Aspergillus fumigatus». J. Antibiot. 49 (8): 832–835. Дои:10.7164 / антибиотики.49.832. PMID 8823522.
- ^ фон Нуссбаум, F; Данишефский, SJ (2000). «Быстрый полный синтез спиротрипростатина B: доказательство его относительной и абсолютной стереохимии». Энгью. Chem. Int. Эд. 39 (12): 2175–2178. Дои:10.1002 / 1521-3773 (20000616) 39:12 <2175 :: AID-ANIE2175> 3.0.CO; 2-J. PMID 10941053.
- ^ Себахар, PR; Уильямс, RM (2000). «Асимметричный полный синтез (+) - и (-) - спиротрипростатина B». Варенье. Chem. Soc. 122 (23): 5666–5667. Дои:10.1021 / ja001133n.
- ^ Wang, H; Ганесан, А (2000). «Биомиметический общий синтез (-) - спиротрипростатина B и связанные исследования». J. Org. Chem. 65 (15): 4685–4693. Дои:10.1021 / jo000306o. PMID 10959875.
- ^ Багул, ТД; и другие. (2002). «Полный синтез спиротрипростатина B посредством асимметричного нитроолефинирования». Орг. Латыш. 4 (2): 249–251. Дои:10.1021 / ol016999s. PMID 11796062.
- ^ Мейерс, C; Каррейра, EM (2003). «Полный синтез (-) - спиротрипростатина B». Энгью. Chem. Int. Эд. 42 (6): 694–696. Дои:10.1002 / anie.200390192. PMID 12575009.
- ^ Мияке, ФГ; и другие. (2004). «Получение и синтетические применения метиловых эфиров 2-галотриптофана: синтез спиротрипростатина B». Энгью. Chem. Int. Эд. 43 (40): 5357–5360. Дои:10.1002 / anie.200460419. PMID 15468070.
- ^ Оверман, Л. Е.; Розен, Мэриленд (2000). «Полный синтез (-) - спиротрипростатина B и трех стереоизомеров». Энгью. Chem. Int. Эд. 39 (24): 4596–4599. Дои:10.1002 / 1521-3773 (20001215) 39:24 <4596 :: AID-ANIE4596> 3.0.CO; 2-F.
- ^ Трост, БМ; Стайлз, Д.Т. (2007). «Полный синтез спиротрипростатина B посредством диастереоселективного пренилирования». Орг. Латыш. 9 (15): 2763–2766. Дои:10.1021 / ol070971k. PMID 17592853.