WikiDer > Кораннулен
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Дибензо [Гхи,mno] флуорантен[1] | |
| Другие имена [5] циркулен | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| C20ЧАС10 | |
| Молярная масса | 250,29 г / моль |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
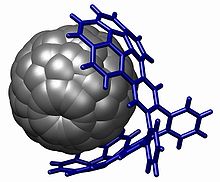
Кораннулен это полициклический ароматический углеводород с участием химическая формула C20ЧАС10.[2] В молекула состоит из циклопентан кольцо сплавлен с 5 бензол кольца, поэтому другое название для него [5]циркулен. Это представляет научный интерес, потому что это геодезический полиарен и может считаться фрагментом бакминстерфуллерен. Благодаря этому соединению, а также форме чаши, кораннулен также известен как Bukybowl. Кораннулен демонстрирует инверсию чаши в чашу с инверсионный барьер из 10,2 ккал/моль (42.7 кДж/ моль) при −64 ° C.[3]
Синтез
Кораннулен получает несколько синтетических путей. Мгновенный вакуумный пиролиз методы обычно имеют более низкий химические выходы чем химический синтез в растворе, но предлагает пути к большему количеству производных. Кораннулан был впервые выделен в 1966 году путем многоступенчатого органического синтеза.[4] В 1971 году было сообщено о синтезе и свойствах кораннулана.[5] В 1991 году последовал метод мгновенного вакуумного пиролиза.[6] Один синтез на основе химии раствора[7] состоит из нуклеофильное смещение–реакция элиминации октабромида с гидроксид калия:
Заместители брома удаляются с избытком п-бутиллитий.
Был достигнут синтез кораннулена в масштабе килограмма.[8]
Большие усилия направлены на функционализацию кораннуленового кольца новыми функциональными группами, такими как этинильные группы,[3][9][10] эфирные группы,[11] тиоэфирные группы,[12] функциональные группы платины,[13] арильные группы,[14] феналенил конденсированный [15] и расширения индено.[16] и ферроцен группы.[17]
Ароматичность
Наблюдаемые ароматичность для этого соединения объясняется так называемым модель аннулена в аннулене. Согласно этой модели, кораннулен состоит из ароматической 6-электронной циклопентадиенил анион окруженный ароматическим 14 электроном аннуленил катион. Эта модель была предложена Барт и Лоутон при первом синтезе кораннулена в 1966 году.[4] Они также предложили тривиальное название «кораннулен», которое происходит от модели «аннулен в аннулене»: ядро + аннулен.
Однако более поздние теоретические расчеты поставили под сомнение справедливость этого приближения.[18][19]
Реакции
Сокращение
Кораннулен может быть восстановлен до тетрааниона в ряду одноэлектронное восстановление. Это было выполнено с щелочных металлов, электрохимически и с основаниями. Кораннуленовый дианион антиароматический и тетраанион снова ароматный. С участием литий так как Восстановитель два тетрааниона образуют супрамолекулярный димер с двумя чашами, сложенными друг в друга, с 4 ионами лития между ними и 2 парами выше и ниже стопки.[20] Этот мотив самосборки был применен при организации фуллеренов. Пентазамещенные фуллерены (с метильными или фенильными группами), заряженные пятью электронами, образуют супрамолекулярные димеры с комплементарной чашей тетрааниона кораннулена, «сшитой» межузельными катионами лития.[21] В родственной системе 5 ионов лития зажаты между двумя чашами из кораннулена. [22]
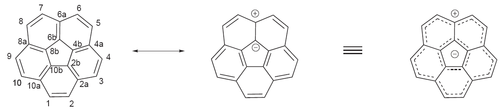
В одном циклопента [bc] кораннулене вогнуто-вогнутый агрегат наблюдается по ЯМР-спектроскопия с 2 связями C – Li – C, соединяющими тетраанионы.[23]
Металлы имеют тенденцию связываться с выпуклой поверхностью аннулена. Сообщалось о вогнутом связывании для системы цезий / краун-эфир. [24]
Окисление
Фотоионизация УФ 193 нм эффективно удаляет π-электрон из двукратно вырожденного E1-HOMO, расположенный в ароматической сети электронов, дающей катион-радикал кораннулен.[25] Катион-радикал кораннулена из-за вырождения на орбитали ВЗМО нестабилен в своем исходном C5в молекулярное расположение и, следовательно, подвержены вибронным искажениям Яна-Теллера (JT).
Используя ионизацию электрораспылением, был получен протонированный катион кораннулена, в котором сайт протонирования находился на периферийном участке.2-атом углерода.[25]
Реакция с электрофилами
Кораннулен может реагировать с электрофилы образовывать кораннулен карбокатион. Реакция с хлорметан и хлорид алюминия приводит к образованию AlCl4− соль с метильной группой, расположенной в центре с катионным центром по краю. дифракция рентгеновских лучей Анализ показывает, что новая углерод-углеродная связь удлиненная (157 мкм) [26]
Бикораннуленил
Бикораннуленил является продуктом дегидрирования кораннулена. По формуле C20ЧАС9-C20ЧАС9, он состоит из двух кораннуленовых звеньев, соединенных простой связью C-C. Стереохимия молекулы состоит из двух хиральных элементов: асимметрии однократно замещенного кораннуленила и спирального закручивания вокруг центральной связи. В нейтральном состоянии бикораннуленил существует в виде 12 конформеров, которые перекрываются посредством множественных инверсий чаши и вращений связей.[27] Когда бикораннуленил восстанавливается до дианиона с помощью металлического калия, центральная связь приобретает значительный характер двойной связи. Это изменение связано с орбитальной структурой, которая имеет орбиталь НСМО, локализованную на центральной связи.[28] Когда бикораннуленил восстанавливается до октааниона с помощью металлического лития, он самоорганизуется в супрамолекулярные олигомеры.[29] Этот мотив иллюстрирует «укладку заряженных полиаренов».
Исследование
Группа кораннулена используется в химия между хозяином и гостем с взаимодействиями на основе пи укладка, особенно с фуллерены (ловец оленей) [30][31] но также с нитробензол [32]
Алкилзамещенные кораннулены образуют термотропный гексагональный столбчатый жидкокристаллическая мезофаза.[33] Кораннулен также использовался в качестве основной группы в дендример.[14] Как и другие ПАУ, кораннулен перевязывает металлы.[34][35][36][37][38][39][40] Кораннулены с этинильными группами исследуются на предмет их потенциального использования в качестве источников синего излучения.[10]
Смотрите также
| Викискладе есть медиафайлы по теме Кораннулен. |
| Искать кораннулен в Викисловаре, бесплатном словаре. |
использованная литература
- ^ Флуорантен назван так из-за его флуоресцентных свойств. Это не соединение фтора.
- ^ Scott, L.T .; Бронштейн, H.E .; Preda, D. V .; Ansems, R. B. M .; Bratcher, M. S .; Хаген, С. (1999). «Геодезические полиарены с открытыми вогнутыми поверхностями». Чистая и прикладная химия. 71 (2): 209. Дои:10.1351 / pac199971020209.
- ^ а б Scott, L.T .; Hashemi, M. M .; Братчер, М. С. (1992). «Переворачивание кораннулена из чаши в чашу происходит быстро при комнатной температуре». Журнал Американского химического общества. 114 (5): 1920–1921. Дои:10.1021 / ja00031a079.
- ^ а б Barth, W. E .; Лоутон, Р. Г. (1966). «Дибензо [ги, мно] флуорантен». Журнал Американского химического общества. 88 (2): 380–381. Дои:10.1021 / ja00954a049.
- ^ Лотон, Ричард Дж .; Барт, Уэйн Э. (апрель 1971 г.). «Синтез кораннулена». Журнал Американского химического общества. 93 (7): 1730–1745. Дои:10.1021 / ja00736a028.
- ^ Scott, L.T .; Hashemi, M. M .; Мейер, Д. Т .; Уоррен, Х. Б. (1991). «Кораннулен. Удобный новый синтез». Журнал Американского химического общества. 113 (18): 7082–7084. Дои:10.1021 / ja00018a082.
- ^ Sygula, A .; Рабидо, П. В. (2000). «Практический крупномасштабный синтез кораннуленовой системы». Журнал Американского химического общества. 122 (26): 6323–6324. Дои:10.1021 / ja0011461.
- ^ Баттерфилд, А .; Gilomen, B .; Сигел, Дж. (2012). "Производство кораннулена в килограммах". Исследования и разработки в области органических процессов. 16 (4): 664–676. Дои:10.1021 / op200387s.
- ^ Wu, Y .; Бандера, Д .; Maag, R .; Linden, A .; Baldridge, K .; Сигел, Дж. (2008). «Мультиэтинилкораннулены: синтез, строение, свойства». Журнал Американского химического общества. 130 (32): 10729–10739. Дои:10.1021 / ja802334n. PMID 18642812.
- ^ а б Mack, J .; Vogel, P .; Jones, D .; Кавал, Н .; Саттон, А. (2007). «Разработка синих эмиттеров на основе кораннулена». Органическая и биомолекулярная химия. 5 (15): 2448–2452. Дои:10.1039 / b705621d. PMID 17637965.
- ^ Gershoni-Poranne, R .; Pappo, D .; Solel, E .; Кейнан, Э. (2009). «Эфиры кораннулена конденсацией Ульмана». Органические буквы. 11 (22): 5146–5149. Дои:10.1021 / ol902352k. PMID 19905024.
- ^ Baldridge, K .; Hardcastle, K .; Seiders, T .; Сигел, Дж. (2010). «Синтез, строение и свойства декакис (фенилтио) кораннулена». Органическая и биомолекулярная химия. 8 (1): 53–55. Дои:10.1039 / b919616a. PMID 20024131.
- ^ Choi, H .; Kim, C .; Парк, К. М .; Kim, J .; Kang, Y .; Ко, Дж. (2009). «Синтез и строение пента-платиновых σ-связанных производных кораннулена». Журнал металлоорганической химии. 694 (22): 3529–3532. Дои:10.1016 / j.jorganchem.2009.07.015.
- ^ а б Pappo, D .; Межуч, Т .; Reany, O .; Solel, E .; Gurram, M .; Кейнан, Э. (2009). «Разнообразная функционализация кораннулена: легкий доступ к пятиугольной надстройке». Органические буквы. 11 (5): 1063–1066. Дои:10.1021 / ol8028127. PMID 19193048.
- ^ Nishida, S .; Morita, Y .; Ueda, A .; Кобаяши, Т .; Фукуи, К .; Ogasawara, K .; Sato, K .; Такуи, Т .; Накасудзи, К. (2008). «Кривая структурированной химии феналенила: синтез, электронная структура и барьер инверсии чаши феналенил-конденсированного кораннуленового аниона». Журнал Американского химического общества. 130 (45): 14954–14955. Дои:10.1021 / ja806708j. PMID 18937470.
- ^ Steinberg, B .; Jackson, E .; Филатов, А .; Вакамия, А .; Петрухина, М .; Скотт, Л. (2009). «Ароматические пи-системы более изогнуты, чем C (60). Полное семейство всех инденокораннуленов, синтезированных с помощью итеративного внутримолекулярного арилирования с помощью микроволнового излучения». Журнал Американского химического общества. 131 (30): 10537–10545. Дои:10.1021 / ja9031852. PMID 19722628.
- ^ Тополинский, Берит; Schmidt, Bernd M .; Катан, Майкл; Троянов, Сергей И .; Ленц, Дитер (2012). «Кораннуленилферроцены: к одномерной нековалентной металлорганической нанопроволоке». Chem. Сообщество. 48 (50): 6298–6300. Дои:10.1039 / C2CC32275G. PMID 22595996.
- ^ Sygula, A .; Рабидо, П. В. (1995). «Структура и инверсионные барьеры кораннулена, его дианиона и тетрааниона. Исследование ab initio». Журнал молекулярной структуры: ТЕОХИМА. 333 (3): 215–226. Дои:10.1016 / 0166-1280 (94) 03961-J.
- ^ Монако, G .; Scott, L .; Занаси, Р. (2008). «Магнитный эурипи в кораннулене». Журнал физической химии A. 112 (35): 8136–8147. Bibcode:2008JPCA..112.8136M. Дои:10.1021 / jp8038779. PMID 18693706.
- ^ Аялон, А .; Sygula, A .; Cheng, P .; Rabinovitz, M .; Rabideau, P .; Скотт, Л. (1994). «Стабильные молекулярные сэндвичи высокого порядка: пары углеводородных полианионов с множеством ионов лития внутри и снаружи». Наука. 265 (5175): 1065–1067. Bibcode:1994Научный ... 265.1065A. Дои:10.1126 / science.265.5175.1065. PMID 17832895.
- ^ Апраамян, I .; Eisenberg, D .; Hoffman, R .; Sternfeld, T .; Matsuo, Y .; Jackson, E .; Накамура, Э .; Scott, L .; Шерадский, Т .; Рабиновиц, М. (2005). «Шаровидная укладка геодезических полиаренов с наддувом: связывание межузельными ионами лития». Журнал Американского химического общества. 127 (26): 9581–9587. Дои:10.1021 / ja0515102. PMID 15984885.
- ^ Забула, А. В. (2011). «Металлический сэндвич основной группы: пять катионов лития, застрявшие между двумя колодами кораннулен-тетрааниона». Наука. 333: 1008–1011. Дои:10.1126 / science.1208686.
- ^ Апраамян, I .; Preda, D .; Bancu, M .; Belanger, A .; Шерадский, Т .; Scott, L .; Рабиновиц, М. (2006). «Восстановление чашеобразных углеводородов: дианионов и тетраанионов аннелированных кораннуленов». Журнал органической химии. 71 (1): 290–298. Дои:10.1021 / jo051949c. PMID 16388648.
- ^ Списак, С. Н .; Забула, А. В .; Филатов, А. С .; Рогачев, А.Ю .; Петрухина М.А. (2011). «Селективное эндо и экзо связывание щелочных металлов с кораннуленом». Angewandte Chemie International Edition. 50 (35): 8090–8094. Дои:10.1002 / anie.201103028. PMID 21748832.
- ^ а б Галуэ, Эктор Альваро; Райс, Кори А .; Steill, Джеффри Д .; Ооменс, Джос (1 января 2011 г.). «Инфракрасная спектроскопия ионизированного кораннулена в газовой фазе» (PDF). Журнал химической физики. 134 (5): 054310. Bibcode:2011ЖЧФ.134э4310Г. Дои:10.1063/1.3540661. PMID 21303123.
- ^ Забула, А. В .; Списак, С. Н .; Филатов, А. С .; Рогачев, А.Ю .; Петрухина М.А. (2011). "Ловушка, высвобождающая деформацию для высокореактивных электрофилов: структурные характеристики шарообразных карбокатионов арения". Angewandte Chemie International Edition. 50: 2971–2974. Дои:10.1002 / anie.201007762.
- ^ Eisenberg, D .; Филатов, А .; Jackson, E .; Rabinovitz, M .; Петрухина, М .; Scott, L .; Шенхар, Р. (2008). «Бикораннуленил: стереохимия биарила C40H18, состоящего из двух хиральных чаш». Журнал органической химии. 73 (16): 6073–6078. Дои:10.1021 / jo800359z. PMID 18505292.
- ^ Eisenberg, D .; Quimby, J.M .; Джексон, Э. А .; Scott, L.T .; Шенхар Р. (2010). «Бикораннуленилдианион: заряженный переполненный этилен». Angewandte Chemie International Edition. 49 (41): 7538–7542. Дои:10.1002 / anie.201002515. PMID 20814993.
- ^ Eisenberg, D .; Quimby, J.M .; Джексон, Э. А .; Scott, L.T .; Шенхар Р. (2010). «Высоко заряженные супрамолекулярные олигомеры на основе димеризации тетрааниона кораннулена». Химические коммуникации. 46 (47): 9010–9012. Дои:10.1039 / c0cc03965a. PMID 21057679.
- ^ Sygula, A .; Fronczek, F .; Sygula, R .; Rabideau, P .; Олмстед, М. (2007). «Двойная вогнутая ловушка для углеводородов». Журнал Американского химического общества. 129 (13): 3842–3843. Дои:10.1021 / ja070616p. PMID 17348661.
- ^ Вонг, Б. М. (2009). «Нековалентные взаимодействия в супрамолекулярных комплексах: исследование кораннулена и двойной вогнутой ловушки бакика». Журнал вычислительной химии. 30 (1): 51–56. arXiv:1004.4243. Дои:10.1002 / jcc.21022. PMID 18504779.
- ^ Кобрин, Л .; Генри, W. P .; Fronczek, F. R .; Sygula, R .; Сыгула, А. (2009). «Молекулярные зажимы и пинцеты с кораннуленовыми клешнями». Буквы Тетраэдра. 50 (51): 7124–7127. Дои:10.1016 / j.tetlet.2009.09.177.
- ^ Miyajima, D .; Таширо, К .; Araoka, F .; Takezoe, H .; Kim, J .; Като, К .; Takata, M .; Аида, Т. (2009). «Жидкокристаллический кораннулен, реагирующий на электрическое поле». Журнал Американского химического общества. 131 (1): 44–45. Дои:10.1021 / ja808396b. PMID 19128171.
- ^ Сейдерс, Т. Джон; Болдридж, Ким К .; О'Коннор, Джозеф М .; Сигел, Джей С. (1997). «Координация гексагапто-металла с изогнутыми поверхностями полиароматических углеводородов: первый кораннуленовый комплекс переходного металла». Варенье. Chem. Soc. 119 (20): 4781–4782. Дои:10.1021 / ja964380t.
- ^ Сигел, Джей С .; Болдридж, Ким К .; Линден, Энтони; Дорта, Рето (2006). «d8 Родиевые и иридиевые комплексы кораннулена». Варенье. Chem. Soc. 128 (33): 10644–10645. Дои:10.1021 / ja062110x. PMID 16910635.
- ^ Петрухина М.А. (2008). «Координация бакибадий: первый металлический комплекс с вогнутым переплетом». Angewandte Chemie International Edition на английском языке. 47 (9): 1550–1552. Дои:10.1002 / anie.200704783. PMID 18214869.
- ^ Zhu, B .; Ellern, A .; Sygula, A .; Sygula, R .; Анжеличи, Р. Дж. (2007). «η6-Координация изогнутой углеродной поверхности кораннулена (C20H10) с (η6-ареном) M2 + (M = Ru, Os)». Металлоорганические соединения. 26 (7): 1721–1728. Дои:10.1021 / om0610795.
- ^ Петрухина, М. А .; Севрюгина, Ю .; Рогачев, А.Ю .; Джексон, Э. А .; Скотт, Л. Т. (2006). «Кораннулен: предпочтительное связывание с металлом. Рентгеноструктурные характеристики [Ru2 (O2CCF3) 2 (CO) 4 · (η2-C20H10) 2]». Металлоорганические соединения. 25 (22): 5492–5495. Дои:10.1021 / om060350f.
- ^ Siegel, J .; Baldridge, K .; Linden, A .; Дорта, Р. (2006). «D8 родиевые и иридиевые комплексы кораннулена». Журнал Американского химического общества. 128 (33): 10644–10645. Дои:10.1021 / ja062110x. PMID 16910635.
- ^ Бандера, Д .; Болдридж, К. К .; Linden, A .; Dorta, R .; Сигел, Дж. С. (2011). «Стереоселективная координация C5-симметричных производных кораннулена с энантиомерно чистым металлическим комплексом [RhI (nbd *)]». Angewandte Chemie International Edition. 50: 865–867. Дои:10.1002 / anie.201006877.

![Циклопента [bc] кораннулен](http://upload.wikimedia.org/wikipedia/commons/thumb/2/21/Cyclopenta-bc-corannulene.png/100px-Cyclopenta-bc-corannulene.png)