WikiDer > Пентацен
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Пентацен | |
| Другие имена 2,3: 6,7-дибензантрацен Бензо [b] нафтацен Дибенз [b, i] антрацен NSC 90784 лин-дибензантрацен лин-нафтоантрацен | |
| Идентификаторы | |
3D модель (JSmol) | |
| 1912418 | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.004.722 |
| Номер ЕС |
|
| 733903 | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C22ЧАС14 | |
| Молярная масса | 278.354 г · моль−1 |
| Внешность | Темно-синий порошок |
| Плотность | 1,3 г · см−3 |
| Температура плавления | > 300 ° C (572 ° F, 573 K) сублимируется при 372 ° C |
| Точка кипения | 40–43 ° C (104–109 ° F, 313–316 K) при 0,15 торр |
| -205.4 × 10−6 см3 моль−1 | |
| Структура | |
| Триклиник | |
| П-1 | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пентацен это полициклический ароматический углеводород состоящий из пяти линейно-плавленых бензол кольца. Это очень сопряженный соединение является органический полупроводник. Соединение генерирует экситоны при поглощении ультрафиолета (УФ) или видимый свет; это делает его очень чувствительным к окислению. По этой причине это соединение, представляющее собой фиолетовый порошок, медленно разлагается под воздействием воздуха и света.
Структурно пентацен является одним из линейных acenes, предыдущий тетрацен (четыре конденсированных бензольных кольца), а следующее - гексацен (шесть конденсированных бензольных колец). В августе 2009 года группа исследователей из IBM опубликовала экспериментальные результаты визуализации одного молекула пентацена с использованием атомно-силовой микроскоп.[1][2] В июле 2011 года использовалась модификация сканирующая туннельная микроскопия для экспериментального определения формы самые высокие занятые и самые низкие незанятые молекулярные орбитали.[3][4]
В 2012 г. легированные пентаценом п-терфенил было показано, что он эффективен в качестве среды усилителя при комнатной температуре. мазер.[5]
Синтез
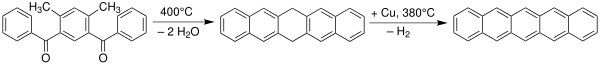
Пентацен был впервые синтезирован в 1912 году британскими химиками. Уильям Хобсон Миллс и Милдред Мэй Гостлинг.[7][8] Классический метод синтеза пентацена - это Реакция Эльбса.[9][10]
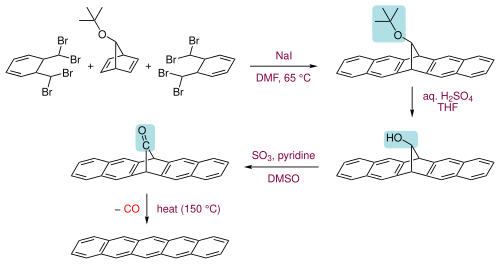
Пентацены также могут быть получены экструзия небольшого летучего компонента (монооксид углерода) из подходящего прекурсора при 150 ° C.[11]
Сам прекурсор готовится в три этапа из двух молекул α, α, α ', α'-тетрабром-о-ксилол с 7-терт-бутоксибицикло [2.2.1] гепта-2,5-диен при первом нагревании с йодид натрия в диметилформамид пройти серию устранение и Дильс – Альдер реакции с образованием кольцевой системы, затем гидролиз терт-бутоксигруппу к алкоголь с последующим его окислением до кетон.[11]
Сообщается, что продукт имеет некоторую растворимость в хлороформ и поэтому поддается центрифугирование. Пентацен растворим в горячих хлорированных бензолах, таких как 1,2,4-трихлорбензол, из которого он может быть перекристаллизован с образованием пластинок.
Производные пентацена
Мономерные производные пентацена
6,13-Замещенные пентацены доступны через пентаценехинон путем реакции с арильным или алкинилнуклеофилом (например, реактивами Гриньяра или литийорганическими реагентами) с последующей восстановительной ароматизацией.[12][13][14] Другой метод основан на гомологизации diynes переходными металлами (через цирконациклопентадиены) [15][16][17][18][19] Функционализация пентацена позволила контролировать твердотельную упаковку этого хромофора.[20][21] Выбор заместителей (как размер, так и расположение замещения в пентацене) влияет на твердотельную упаковку и может использоваться для контроля того, принимает ли соединение 1-мерное или 2-мерное покрытие. пи-стек в твердом состоянии, в отличие от набивки «елочкой», наблюдаемой для пентацена.
Хотя структура пентацена напоминает структуру других ароматических соединений, таких как антрацен, это ароматный свойства плохо определены; как таковой пентацен и его производные являются предметом многочисленных исследований.
А таутомерный химическое равновесие существует между 6-метилен-6,13-дигидропентацен и 6-метилпентацен.
Это равновесие полностью в пользу метиленового соединения. Только при нагревании раствора соединения до 200 ° C образуется небольшое количество пентацена, о чем свидетельствует появление красно-фиолетовой окраски. Согласно одному исследованию[22] в механизм реакции поскольку это равновесие не основано на внутримолекулярный 1,5-гидридный сдвиг, но на бимолекулярный свободный радикал миграция водорода. В отличие, изотолуолы с тем же центральным химическим мотивом легко ароматизируется.
Пентацен реагирует с элементалем сера в 1,2,4-трихлорбензол в соединение гексатиапентацен.[23] Рентгеновская кристаллография показывает, что весь углерод-сера длина облигаций примерно равны (170 вечера); отсюда следует, что резонансные структуры B и C с полным разделением зарядов более значимы, чем структура A.
В кристаллической фазе молекулы показывают ароматические взаимодействия, в результате чего расстояние между некоторыми атомами серы на соседних молекулах может стать меньше (337 пм), чем сумма двух Радиусы Ван-дер-Ваальса (180 вечера)
Как и связанный тетратиафульвален, это соединение изучается в области органические полупроводники.
Ацены могут выглядеть как плоские и жесткие молекулы, но на самом деле они могут быть очень искажены. Пентацен, изображенный ниже:[24]
имеет сквозное закручивание 144 ° и стерильно стабилизируется шестью фенил группы. Соединение можно разделить на два энантиомеры с необычно высоким сообщенным оптическое вращение 7400 ° хотя рацемизация происходит с химический период полураспада 9 часов.
Олигомеры и полимеры пентацена
Олигомеры и полимеры на основе пентацена были исследованы как синтетически, так и в настройках приложений устройства.[25][26] Полимерные светодиоды (PLEDs) были построены с использованием сопряженных сополимеров (1a – b), содержащие флуорен и пентацен.[27] Несколько других сопряженных полимеров пентацена (2a – b и 3) реализованы на основе Соногашира и Сузуки реакции сочетания мономера дибромпентацена.[28][29] Несопряженные полимеры на основе пентацена были синтезированы путем этерификации мономера пентацендиола бис-хлорангидридами с образованием полимеров. 4a – b.[30][31]

Для образования конъюгированных олигомеров пентацена применялись различные синтетические стратегии. 5a – c включая процедуру образования «один горшок-четыре связи», которая обеспечила обрабатываемый в растворе сопряженный димер пентацена (5c) с коэффициентом усиления фотопроводимости> 10,[32] помещая его характеристики в пределах того же порядка величины, что и термически напыленные пленки нефункционализированного пентацена, которые показали коэффициент фотопроводимости> 16 при использовании аналогичных методов измерения.[33] Модульный метод синтеза конъюгированных ди-, три- и тетрамеров пентацена (6–8), который основан на реакциях гомо- и кросс-сочетания устойчивых промежуточных продуктов дегидропентацена.[34] Неконъюгированные олигомеры 9–10 на основе пентацена синтезированы,[30][31] включая дендримеры 9–10 до 9 пентаценовых фрагментов на молекулу с молярной поглощающей способностью для наиболее интенсивного поглощения> 2000000 M−1•см−1. Дендримеры 11–12 было показано, что они обладают улучшенными характеристиками в устройствах по сравнению с аналогичными полимерами на основе пентацена. 4a – b в контексте фотоприемников.[35]
Исследование материалов
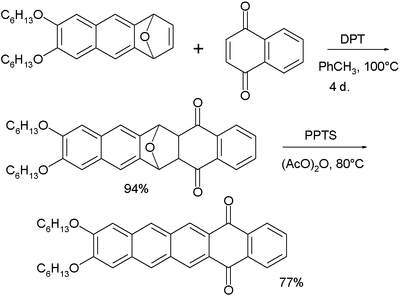
Пентацены были изучены как потенциальные дихроичные красители. Показанный ниже пентаценохинон является флуоресцентный и при смешивании с жидкокристаллическая смесь E7 а дихроичное соотношение из 8 достигнуто.[36][37] Более длинные асы лучше совпадают в нематический жидкокристаллический фаза.
В сочетании с бакминстерфуллерен, пентацен используется при разработке прототипов органических фотоэлектрических элементов.[38][39] Органические фотоэлектрические элементы дешевле и гибче традиционных неорганических элементов, которые потенциально могут открыть двери для солнечных элементов на новых рынках.[40]
Пентацен - популярный выбор для исследований органических тонкопленочные транзисторы и ОФЕТ, являясь одной из наиболее тщательно изученных сопряженных органических молекул с высоким потенциалом применения благодаря подвижности дырок в OFET до 5,5 см2/ (В · с), что больше, чем у аморфного кремния.[41][42][43]
Пентацен, как и другие органические проводники, подвержен быстрому окислению на воздухе, что исключает коммерческое использование. Если пентацен предварительно окислен, пентаценхинон является потенциальным изолятором затвора, то подвижность может приближаться к подвижности рубрен - наиболее подвижный органический полупроводник - 40 см2/(Против). Этот метод окисления пентацена сродни окислению кремния, используемому в кремниевой электронике.[42]
Смотрите также
Рекомендации
- ^ «Потрясающий образ одиночной молекулы». Новости BBC. 2009-08-28. Получено 2009-08-28.
- ^ Gross, L .; Mohn, F; Молл, N; Liljeroth, P; Мейер, G (2009). «Химическая структура молекулы, разрешенная с помощью атомно-силовой микроскопии». Наука. 325 (5944): 1110–1114. Bibcode:2009Научный ... 325.1110G. Дои:10.1126 / science.1176210. PMID 19713523. S2CID 9346745.
- ^ Кригер, К. (23 августа 2011 г.). "Наиболее детально изображенные молекулы". Наука сейчас. Получено 29 июн 2017.
- ^ Gross, L .; Moll, N .; Mohn, F .; Куриони, А .; Мейер, G .; Hanke, F .; Перссон, М. (2011). "Молекулярно-орбитальная визуализация высокого разрешения с использованием п-Wave STM Tip ». Phys. Rev. Lett. 107 (8): 86101–86104. Bibcode:2011ПхРвЛ.107х6101Г. Дои:10.1103 / PhysRevLett.107.086101. PMID 21929180.
- ^ Брамфил, Г. (2012). «Микроволновый лазер выполняет 60-летнюю перспективу». Природа. Дои:10.1038 / природа.2012.11199. S2CID 124247048.
- ^ Dinca, L.E .; Де Марчи, Ф .; MacLeod, J.M .; Lipton-Duffin, J .; Gatti, R .; Сумасшедший.; Перепичка, Д.Ф.; Rosei, F. (2015). «Пентацен на Ni (111): упаковка молекул при комнатной температуре и преобразование в графен, активируемое температурой». Наномасштаб. 7 (7): 3263–3269. Bibcode:2015Nanos ... 7.3263D. Дои:10.1039 / C4NR07057G. PMID 25619890.
- ^ Миллс, Уильям Хобсон; Миллс, Милдред (1912). "CCXXX. - Синтетическое производство производных динафтантрацена". J. Chem. Soc., Trans. 101: 2194–2208. Дои:10.1039 / CT9120102194.
- ^ Чунг, Хёнджун; Диао, Инь (2016). «Полиморфизм как новая стратегия проектирования высокопроизводительной органической электроники». J. Mater. Chem. C. 4 (18): 3915–3933. Дои:10.1039 / C5TC04390E.
С момента своего синтеза в 1912 году до классификации по крайней мере четырех различных полиморфов в 2003 году пентацен превратился в эталонный органический полупроводник благодаря своим превосходным характеристикам тонкопленочного транзистора.
- ^ Эльбс, Карл (1886). "Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung". J. Prakt. Chem. (на немецком). 33 (1): 180–188. Дои:10.1002 / prac.18860330119.
- ^ Брайтмайер, Эберхард; Юнг, Гюнтер (2005). «12.5.3 Эльбс-Реакция». Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen (на немецком языке) (5-е изд.). Штутгарт: Георг Тиме Верлаг. п. 183. ISBN 9783135415055.
- ^ а б Чен, Кью-Ю; Се, Син-Хунг; Ву, Чун-Чжи; Хван, Цзюнн-Дже; Чоу, Тахсин Дж. (2007). «Новый тип растворимого прекурсора пентацена для органических тонкопленочных транзисторов» (PDF). Chem. Commun. 2007 (10): 1065–1067. Дои:10.1039 / b616511g. PMID 17325807.
- ^ Allen, C.F.H .; Белл, Алан (1942). «Действие реактивов Гриньяра на некоторые пентаценхиноны, 6,13-дифенилпентацен». Журнал Американского химического общества. 64 (6): 1253–1260. Дои:10.1021 / ja01258a005.
- ^ Maulding, D. R .; Робертс, Бернард Г. (1969). «Электронное поглощение и флуоресценция фенилэтинил-замещенных аценов». Журнал органической химии. 34 (6): 1734–1736. Дои:10.1021 / jo01258a045.
- ^ Ли, Ши; Чжоу, Лишань; Накадзима, Киёхико; Канно, Кен-Ичиро; Такахаши, Тамоцу (2010). «Синтез 1,2,3,4,8,9,10,11-октазамещенных производных пентаценхинона и их превращение в замещенные пентацены». Химия: азиатский журнал. 5 (7): 1620–6. Дои:10.1002 / asia.200900754. PMID 20455241.
- ^ Такахаши, Тамоцу; Китамура, Масанори; Шэнь, Баоцзянь; Накадзима, Киёхико (2000). «Простой метод синтеза сильно алкилзамещенных производных нафтацена и пентацена путем гомологации». Журнал Американского химического общества. 122 (51): 12876–12877. Дои:10.1021 / ja003130g.
- ^ Такахаши, Тамоцу; Ли, Ши; Хуанг, Вэньин; Конг, Фаньчжи; Накадзима, Киёхико; Шэнь, Баоцзянь; Охе, Такахиро; Канно, Кен-Ичиро (2006). «Метод гомологации для получения замещенных пентаценов и нафтаценов». Журнал органической химии. 71 (21): 7967–77. Дои:10.1021 / jo060923y. PMID 17025283.
- ^ Такахаши, Тамоцу; Ли, Янчжун; Ху, Цзинхань; Конг, Фаньчжи; Накадзима, Киёхико; Чжоу, Лишань; Канно, Кен-Ичиро (2007). «Cu (I) -опосредованная реакция циклоприсоединения цирконциклопентадиенов к фумаронитрилу и применение для синтеза моноцианозамещенных пентаценов». Буквы Тетраэдра. 48 (38): 6726–6730. Дои:10.1016 / j.tetlet.2007.07.075.
- ^ Стоун, Мэтью Т .; Андерсон, Гарри Л. (2007). «Трехстадийный синтез пентаценов с замещенными концевыми группами». Журнал органической химии. 72 (25): 9776–8. Дои:10.1021 / jo7017284. PMID 17999529.
- ^ Ли, Ши; Ли, Чжипин; Накадзима, Киёхико; Канно, Кен-Ичиро; Такахаши, Тамоцу (2009). "Метод двойной гомологации замещенных растворимых пентаценов и димеризация пентаценов". Химия: азиатский журнал. 4 (2): 294–301. Дои:10.1002 / asia.200800312. PMID 19072938.
- ^ Энтони, Дж. Э .; Brooks, J. S .; Eaton, D. L .; Паркин, С. Р. (2001). «Функционализированный пентацен: улучшенные электронные свойства благодаря контролю порядка твердого тела». Журнал Американского химического общества. 123 (38): 9482–9483. Дои:10.1021 / ja0162459. PMID 11562247.
- ^ Энтони, Дж. Э .; Eaton, D. L .; Паркин, С. Р. (2002). «Дорожная карта для стабильных, растворимых, легко кристаллизующихся производных пентацена». Органические буквы. 4 (1): 15–18. Дои:10.1021 / ol0167356. PMID 11772079.
- ^ Нортон, Джозеф Э .; Northrop, BH; Nuckolls, C; Houk, KN (2006). «Почему 6-метилпентацен деконъюгирует, но избегает термически допустимого мономолекулярного механизма». Органические буквы. 8 (21): 4915–8. Дои:10.1021 / ol062012g. PMID 17020335.
- ^ Briseno, Alejandro L .; Мяо, Q; Линг, ММ; Риз, К; Meng, H; Бао, Z; Wudl, F (2006). «Гексатиапентацен: структура, молекулярная упаковка и тонкопленочные транзисторы». Журнал Американского химического общества. 128 (49): 15576–7. Дои:10.1021 / ja066088j. PMID 17147352..
- ^ Лу, Джун; Хо, DM; Фогелаар, штат Нью-Джерси; Крамл, СМ; Бернхард, S; Бирн, N; Kim, LR; Паскаль-младший, РА (2006). «Синтез, структура и разрешение исключительно скрученных пентаценов». Журнал Американского химического общества. 128 (51): 17043–50. Дои:10.1021 / ja065935f. PMID 17177456.
- ^ Lehnherr, D .; Тыквински, Р.Р. (2010). «Олигомеры и полимеры на основе строительных блоков пентацена». Материалы. 3 (4): 2772–2800. Bibcode:2010 Mate .... 3.2772L. Дои:10.3390 / ma3042772. ЧВК 5445842.
- ^ Lehnherr, D .; Тыквински, Р. Р. (2011). «Конъюгированные олигомеры и полимеры на основе антрацена, тетрацена, пентацена, нафтодитиофена и антрадитиофеновых строительных блоков». Австралийский химический журнал. 64 (7): 919–929. Дои:10.1071 / CH11169.
- ^ Tokito, S .; Weinfurtner, K.-H .; Fujikawa, H .; Tsutsui, T .; Тага, Ю. (2001). Кафафи, Закья Х (ред.). «Ацен-содержащие полифлуорены для красного, зеленого и синего излучения в органических светодиодах». Proc. SPIE – Int. Опт. Soc. Англ.. Органические светоизлучающие материалы и устройства IV. 4105: 69–74. Bibcode:2001SPIE.4105 ... 69T. Дои:10.1117/12.416877. S2CID 96976350.
- ^ Окамото, Т .; Бао, З. (2007). «Синтез растворимых сополимеров, содержащих пентацен». Журнал Американского химического общества. 129 (34): 10308–10309. Дои:10.1021 / ja0725403. PMID 17685520.
- ^ Окамото, Т .; Окамото, Т .; Jiang, Y .; Qu, F .; Mayer, A.C .; Parmer, J.E .; McGehee, M.D .; Бао, З. (2008). «Синтез и характеристика сопряженных сополимеров пентацен- и антрадитиофен-флуорен, синтезированных реакциями Сузуки». Макромолекулы. 41 (19): 6977–6980. Bibcode:2008MaMol..41.6977O. Дои:10.1021 / ma800931a.
- ^ а б Lehnherr, D .; Тыквински, Р. Р. (2007). «Олигомеры и полимеры пентацена: функционализация пентацена для получения моно-, ди-, три- и полимерных материалов». Органические буквы. 9 (22): 4583–4586. Дои:10.1021 / ol702094d. PMID 17918951.
- ^ а б Ленхерр, Дэн; Макдональд, Роберт; Фергюсон, Майкл Дж .; Тыквински, Рик Р. (2008). «Синтез растворимых олиго- и полимерных материалов на основе пентацена». Тетраэдр. 64 (50): 11449–11461. Дои:10.1016 / j.tet.2008.09.041. ISSN 0040-4020.
- ^ Lehnherr, D .; Gao, J .; Hegmann, F.A .; Тыквински, Р. Р. (2008). «Синтез и электронные свойства сопряженных димеров пентацена». Органические буквы. 10 (21): 4779–4782. Дои:10.1021 / ol801886h. PMID 18823120.
- ^ Gao, J .; Хегманн, Ф. А (2008). «Объемное усиление фотопроводимости в тонких пленках пентацена». Письма по прикладной физике. 93 (22): 223306. Bibcode:2008АпФЛ..93в3306Г. Дои:10.1063/1.3043431.
- ^ Lehnherr, D .; Мюррей, А. Х .; McDonald, R .; Тыквински, Р.Р. (2010). «Модульный синтетический подход к конъюгированным пентаценам ди-, три- и тетрамеры». Angewandte Chemie International Edition. 49 (35): 6190–6194. Дои:10.1002 / anie.201000555. PMID 20645363.
- ^ Lehnherr, D .; Gao, J .; Hegmann, F.A .; Тыквински, Р. Р. (2009). «Дендримеры на основе пентацена: синтез и измерения фотопроводимости тонких пленок разветвленных олигомеров пентацена». Журнал органической химии. 74 (14): 5017–5024. Дои:10.1021 / jo9007089. PMID 19489566.
- ^ Чен, Чжихуа; Swager, TM (2007). «Синтез и характеристика флуоресцентных аценехинонов в качестве красителей для жидкокристаллических дисплеев гостя-хозяина». Органические буквы. 9 (6): 997–1000. Дои:10.1021 / ol062999m. PMID 17298074.
- ^ при синтезе этого соединения исходный материал обрабатывают 1,4-нафтохинон и DPT. DTP превращает оксо-норборнадиен в промежуточный фуран. Второй этап - окисление PPTS
- ^ Диссанаяке, Д. М. Нандита М. (2007). "Фотоэлектрическое устройство с наноимпринтом на гетеропереходе большой площади пентацен-C [sub 60]" (PDF). Письма по прикладной физике. 90 (25): 253502. Bibcode:2007АпФЛ..90л3502Д. Дои:10.1063/1.2749863.
- ^ Эффективно органический: исследователи используют пентацен для разработки солнечной энергии следующего поколения sciencedaily.com Связь
- ^ «Эффективно органический: исследователи используют пентацен для разработки солнечной энергии следующего поколения». ScienceDaily. Получено 2017-11-14.
- ^ Норберт Кох (2007). «Органические электронные устройства и их функциональные интерфейсы». ХимФисХим. 8 (10): 1438–55. Дои:10.1002 / cphc.200700177. PMID 17539032.
- ^ а б Тацуо Хасэгава и Джун Такея (2009). «Органические полевые транзисторы на монокристаллах». Sci. Technol. Adv. Матер. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. Дои:10.1088/1468-6996/10/2/024314. ЧВК 5090444. PMID 27877287.
- ^ Ёсиро Ямасита (2009). «Органические полупроводники для органических полевых транзисторов». Sci. Technol. Adv. Матер. 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. Дои:10.1088/1468-6996/10/2/024313. ЧВК 5090443. PMID 27877286.
внешняя ссылка
- факты о пентацене, получено 17 апреля 2006 г.
- Органический транзистор улучшается с возрастом, Новый ученый, 2 декабря 2007 г.
- Пентацен изображен, IBM изображает пентацен, первую детально изображенную молекулу 29 августа 2009 г.