WikiDer > Диоксолан - Википедия
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1,3-диоксолан[3] | |||
| Систематическое название ИЮПАК 1,3-диоксациклопентан | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.422 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C3ЧАС6О2 | |||
| Молярная масса | 74,08 г / моль | ||
| Плотность | 1,06 г / см3 | ||
| Температура плавления | -95 ° С (-139 ° F, 178 К) | ||
| Точка кипения | 75 ° С (167 ° F, 348 К) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
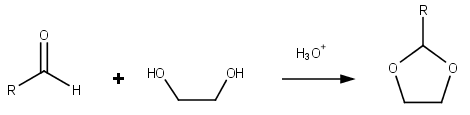
Диоксолан это гетероциклический ацеталь с химическая формула (CH2)2О2CH2. Это связано с тетрагидрофуран заменой одного кислорода на CH2 группа. Соответствующий насыщенный 6-членный C4О2 кольца называются диоксаны. В изомерный 1,2-диоксолан (в котором два кислородных центра находятся рядом) представляет собой перекись. 1,3-диоксолан используется как растворитель и как компаниямономер в полиацетали.
Как класс соединений
Диоксоланы группа органические соединения содержащий диоксолановое кольцо. Диоксоланы можно получить ацетализация из альдегиды и кетализация из кетоны с этиленгликоль.[4]
(+)-СНГ-Диоксолан - это банальное имя за L-(+)-СНГ-2-метил-4-триметиламмонийметил-1,3-диоксолан йодид, который является мускариновый рецептор ацетилхолина агонист.
Защита групп
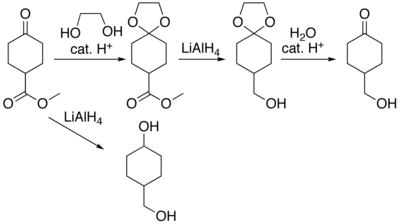
Органические соединения, содержащие карбонильные группы иногда нужно защита чтобы они не вступали в реакции при превращениях других функциональные группы что может присутствовать. Разнообразные подходы к защите и снятию защиты с карбонилов[5] в том числе как диоксоланы[6] известны. Например, рассмотрим соединение метилциклогексанон-4-карбоксилат, где литийалюминийгидрид восстановление даст 4-гидроксиметилциклогексанол. Функциональная группа сложного эфира может быть восстановлена без влияния на кетон защищая кетон как кеталь. Кеталь получают путем катализируемой кислотой реакции с этиленгликоль, проводят реакцию восстановления и удаляют защитную группу гидролизом с получением 4-гидроксиметилциклогексанона.
NaBArF4 может также использоваться для снятия защиты с карбонильных соединений, защищенных ацеталем или кеталем.[5][6] Например, снятие защиты с 2-фенил-1,3-диоксолана до бензальдегид достигается в воде за пять минут при 30 ° C.[7]
- PhCH (OCH2)2 + ЧАС2О PhCHO + HOCH2CH2ОЙ
Натуральные продукты
Неоспорол это натуральный продукт который включает 1,3-диоксолан часть, и является изомером спорол который имеет 1,3-диоксановое кольцо.[8] В полный синтез обоих соединений, и каждое включает стадию, на которой диоксолановая система образуется с использованием трифторопераксусная кислота (TFPAA), подготовленный перекись водорода - мочевина метод.[9][10] Этот метод не требует использования воды, поэтому дает полностью безводный перкислота[11] необходимо в этом случае, поскольку присутствие воды может привести к нежелательному побочные реакции.[9]
В случае неоспорола Прилежаев реакция[12] с трифторперуксусной кислотой используется для преобразования подходящего аллиловый спирт предшественник эпоксид, который затем претерпевает реакцию расширения кольца с ближайшим карбонил функциональная группа с образованием диоксоланового кольца.[9][10]
Аналогичный подход используется в полном синтезе спорола, при этом диоксолановое кольцо позже расширяется до диоксановой системы.[8]
Смотрите также
Рекомендации
- ^ 1,3-диоксолан в Сигма-Олдрич
- ^ формальный гликоль - Публичная химическая база данных PubChem
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 145. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Р. А. Дайно, Э. Л. Элиэль (1973). «2-Циклогексилоксиэтанол (включает ацетализацию циклогексанона)». Органический синтез.; Коллективный объем, 5, п. 303
- ^ а б Грин, Теодора В .; Вутс, Питер Г. М. (1999). «Диметилацетали». Защитные группы Грина в органическом синтезе (3-е изд.). Wiley-Interscience. С. 297–304, 724–727. ISBN 9780471160199. В архиве с оригинала 3 декабря 2016 г.. Получено 20 июня, 2017.
- ^ а б Грин, Теодора В .; Вутс, Питер Г. М. (1999). «1,3-Диоксаны, 1,3-Диоксоланы». Защитные группы Грина в органическом синтезе (3-е изд.). Wiley-Interscience. С. 308–322, 724–727. ISBN 9780471160199. В архиве с оригинала 7 декабря 2016 г.. Получено 20 июня, 2017.
- ^ Чанг, Чжи-Цзин; Ляо, Бэй-Си; Лю, Шиу-Цунг (2007). «Снятие защиты ацеталей и кеталей в коллоидной суспензии, генерируемой тетракис (3,5-трифторметилфенил) боратом натрия в воде». Synlett. 2007 (2): 283–287. Дои:10.1055 / с-2007-968009.
- ^ а б Пиррунг, Майкл С.; Морхед, Эндрю Т .; Янг, Брюс Г., ред. (2000). «10. Неоспорол, Спорол». Часть B: Бициклические и трициклические сесквитерпены. Полный синтез натуральных продуктов. 11. Джон Уайли и сыновья. С. 222–224. ISBN 9780470129630.
- ^ а б c Ziegler, Fredrick E .; Metcalf, Chester A .; Нангиа, Ашвини; Шульте, Гейл (1993). «Состав и общий синтез спорола и неоспорола». Варенье. Chem. Soc. 115 (7): 2581–2589. Дои:10.1021 / ja00060a006.
- ^ а б Кастер, Кеннет С.; Рао, А. Сомасекар; Мохан, Х. Рама; McGrath, Nicholas A .; Бричачек, Мэтью (2012). «Трифторопераксусная кислота». Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.rt254.pub2.
- ^ Купер, Марк С .; Хини, Гарри; Newbold, Аманда Дж .; Сандерсон, Уильям Р. (1990). «Реакции окисления с использованием мочевины и перекиси водорода; безопасная альтернатива безводному перекиси водорода». Synlett. 1990 (9): 533–535. Дои:10.1055 / с-1990-21156.
- ^ Хаген, Тимоти Дж. (2007). «Прилежаевская реакция». Ин Ли, Джи Джек; Кори, Э. Дж. (ред.). Назовите реакции преобразований функциональных групп.. Джон Уайли и сыновья. С. 274–281. ISBN 9780470176504.


![{ displaystyle { ce {-> [{ ce {NaBAr4}}] [{ text {30 ° C / 5 мин}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fb42849d6133fe653a7fe5dd019b12e0f6184b5)
