WikiDer > Электрофильное фторирование
Электрофильное фторирование представляет собой комбинацию углеродного нуклеофил с электрофильный источник фтор позволить себе фторорганические соединения. Хотя для этой цели можно использовать элементарный фтор и реагенты, содержащие связь кислород-фтор, они в значительной степени заменены реагентами, содержащими связь азот-фтор.[1]
Электрофильное фторирование предлагает альтернативу методам нуклеофильного фторирования с использованием фторидов щелочных металлов или аммония и методам с использованием фторидов серы для получения фторорганических соединений. Разработка реагентов для электрофильного фторирования всегда была направлена на удаление электронной плотности у атома, присоединенного к фтору; однако соединения, содержащие связи азот-фтор, оказались наиболее экономичными, стабильными и безопасными электрофильными фторирующими агентами. Электрофильные реагенты N-F могут быть нейтральными или катионными и могут иметь пр.2- или sp3-гибридизированный азот. Хотя точный механизм электрофильного фторирования в настоящее время неясен, он очень эффективен и эффективен. стереоселективный методы были разработаны.
Некоторые распространенные фторирующие агенты, используемые для органического синтеза: N-фтор-о-бензолдисульфонимид (NFOBS), N-фторбензолсульфонимид (NFSI) и Selectfluor.[1]
Механизм и стереохимия
Преобладающий механизм
Механизм электрофильного фторирования остается спорным. Вопрос в том, протекает ли реакция через SN2 или одноэлектронный перенос (SET) процесс. В поддержку SN2 механизм, арил Реактивы Гриньяра и ариллитий дают аналогичные урожаи фторбензол в комбинации с N-фтор-о-бензолдисульфонимид (NFOBS), хотя склонность этих реагентов к участию в процессах SET существенно различается.[2] Кроме того, эксперименты с радикальными зондами с 5-гексениловыми и циклопропиленольными эфирами не дали никаких перегруппированных продуктов.[3] Совсем недавно кинетические исследования электрофильного фторирования ряда 1,3-дикарбонильных производных с помощью ряда реагентов N-F показали, что SN2 механизм более вероятен через Айринг и Hammett исследования.[4]
С другой стороны, прогнозируется, что время жизни радикалов в процессе SET будет на четыре порядка меньше, чем предел обнаружения даже самых чувствительных зондов радикалов. Было высказано предположение, что после переноса электрона происходит немедленная рекомбинация радикала фтора с радикалом алкила.[5]
Стереоселективные варианты
Стереоселективное фторирование может быть либо диастереоселективным, либо энантиоселективным. Диастереоселективные методы сосредоточены на использовании хиральные вспомогательные вещества на нуклеофильном субстрате. Для фторирования карбонильные соединения, хиральный оксазолидиноны были успешно использованы.[6]
Тандемное добавление конъюгата, включающего хиральный нуклеофил, было использовано для синтеза β-амино-α-фторэфиров в хиральной, нерацемической форме.
В энантиоселективных методах используются стехиометрические количества хиральных фторирующих агентов. N-фтораммониевые соли алкалоидов хинного дерева представляют собой современный уровень для реакций этого типа. Кроме того, эти реагенты легко синтезируются из Selectfluor и исходные алкалоиды.[7]
Объем и ограничения
Фторирующие реагенты
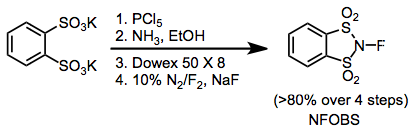
Электрофильные фторирующие реагенты N-F включают электроноакцепторные группы, присоединенные к азоту, для уменьшения электронной плотности на фторе. Несмотря на то что N-фторсульфонамиды - довольно слабые фторирующие реагенты, N-фторсульфонимиды, Такие как N-фторбензолсульфонимид (NFSI) очень эффективны и широко используются. N-фтор-о-бензолдисульфонимид (NFOBS) синтезируется из дисульфоновой кислоты.[2]
Использование солей катионного азота увеличивает скорость и выходы электрофильного фторирования, поскольку катионный азот удаляет электронную плотность из фтора. Ионы N-фторпиридиния и ионы иминия также могут быть использованы в качестве электрофильных фторирующих реагентов. Противоанионы этих солей, хотя они не принимают непосредственного участия в переносе фтора на субстрат, влияют на реакционную способность тонкими способами и могут регулироваться с помощью различных методов.[8]
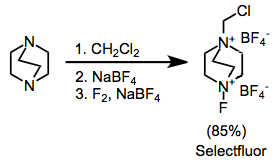
Наиболее синтетически полезными солями аммония являются замещенные ионы бис (аммония) DABCO, включая Selectfluor.[9] Их можно легко синтезировать путем алкилирования с последующим фторированием. Версия с дифтором, которая на первый взгляд может показаться более полезной, содержит только один атом фтора.
Более специализированные электрофильные фторирующие реагенты, такие как нейтральные гетероциклы, содержащие связи N – F,[10] полезны для фторирования ограниченного ряда субстратов.
Нуклеофильные субстраты
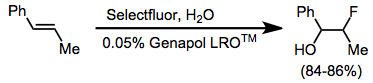
Простое фторирование алкенов часто дает сложные смеси продуктов. Однако софторирование в присутствии нуклеофила протекает чисто с образованием вицинальных алкоксифторидов.[11] Алкины не фторируются реагентами N-F. An анионное поверхностно-активное вещество использовали для облегчения контакта между водным Selectfluor и алкеном.
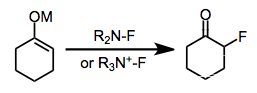
Фторирование богатых электронами ароматических соединений дает арилфториды. Две наиболее распространенные проблемы в этом классе реакций - низкие. орто/параграф селективности и деароматизация (последнее является особенно серьезной проблемой для фенолов).[12]
Эфиры енола и гликали достаточно нуклеофильны, чтобы их фторировать с помощью Selectfluor.[13] Подобно другим алкенам, совместное галогенирование может осуществляться либо путем выделения промежуточного аддукта и реакции с нуклеофилом, либо путем прямого замещения DABCO на месте. Энолы можно фторировать энантиоселективно (см. Выше) в присутствии хирального фторирующего агента.
Еноляты металлов совместимы со многими фторирующими реагентами, включая NFSI, NFOBS и сульфаниламиды. Однако специализированный реагент 2-фтор-3,3-диметил-2,3-дигидробензо [d] 1,1-диоксид изотиазола последовательно дает более высокие выходы монофторированных карбонильных соединений в реакциях с енолатами лития. Другие еноляты металлов давали большие количества дифторированных продуктов.[14]
Сравнение с другими методами
Хотя использование молекулярного фтора в качестве электрофильного источника фтора часто является самым дешевым и прямым методом, F2 часто образует радикалы и реагирует со связями C-H без селективности. Источники протонов или кислоты Льюиса необходимы для подавления образования радикалов, и даже когда эти реагенты присутствуют, только определенные субстраты реагируют с высокой селективностью.[15] Обращение с газообразным F2 требует чрезвычайно специализированного и дорогостоящего оборудования.
Реагенты, содержащие связи O-F, такие как CF3OF, как правило, более селективны к монофторированию, чем реагенты N-F.[16] Однако трудности, связанные с обращением с ними и их чрезвычайная окислительная способность, привели к их замене реагентами N-F.
Ди-, тетра- и гексафторид ксенона являются селективными монофторирующими реагентами. Однако их нестабильность и высокая стоимость сделали их менее популярными, чем азотсодержащие фторирующие агенты.[17]
Условия и порядок экспериментов
Типичные условия
Хотя при фторировании с использованием реагентов N-F молекулярный фтор не используется напрямую, их почти всегда получают из F2. Правильное обращение с F2 требует большого ухода и специального аппарата.[18] Поли (тетрафторэтилен) (PTFE, также известный как тефлон) реакционные сосуды предпочтительнее нержавеющей стали или стекла для реакций с участием молекулярного фтора. F2 смешивается с N2 или Он имеется в продаже и помогает контролировать скорость доставки фтора. Температура должна быть низкой, а введение фтора медленным, чтобы предотвратить реакции свободных радикалов.
Смотрите также
Рекомендации
- ^ а б Badoux, J .; Кахард, Д. Орг. Реагировать. 2007, 69, 347. Дои:10.1002 / 0471264180.or069.02
- ^ а б Дэвис, Ф. А .; Han, W .; Мерфи, К.К. J. Org. Chem. 1995, 60, 4730.
- ^ Differding, E .; Рюэгг, Г. М. Tetrahedron Lett. 1991, 32, 3815.
- ^ Розатян, Нешат; Эшворт, Ян У .; Сэндфорд, Грэм; Ходжсон, Дэвид Р.В. (2018). «Шкала количественной реакционной способности электрофильных фторирующих реагентов». Химическая наука. 9 (46): 8692–8702. Дои:10.1039 / C8SC03596B.
- ^ Piana, S .; Devillers, I .; Togni, A .; Ротлисбергер, У. Энгью. Chem. Int. Эд. Англ. 2002, 41, 979.
- ^ Дэвис, Ф. А .; Касу, П.В.Н. Tetrahedron Lett. 1998, 39, 6135.
- ^ Shibata, N .; Suzuki, E .; Asahi, T .; Широ, М. Варенье. Chem. Soc. 2001, 123, 7001.
- ^ Умемото, Т .; Harasawa, K .; Tomizawa, G .; Kawada, K .; Томита, К. Бык. Chem. Soc. Jpn. 1991, 64, 1081.
- ^ Ставбер, С .; Зупан, М .; Poss, A.J .; Шиит, Г.А. Tetrahedron Lett. 1995, 36, 6769.
- ^ Laali, K. K .; Tanaka, M .; Forohar, F .; Cheng, M .; Фетцер, Дж. К. J. Fluorine Chem. 1998, 91, 185.
- ^ Лал, Г.С. J. Org. Chem. 1993, 58, 2791.
- ^ Зупан, М .; Искра, Дж .; Ставбер, С. Бык. Chem. Soc. Jpn. 1995, 68, 1655.
- ^ Альберт, М .; Dax, K .; Ортнер, Дж. Тетраэдр 1998, 54, 4839.
- ^ Differding, E .; Ланг, Р. В. Helv. Чим. Acta. 1989, 72, 1248.
- ^ Chambers, R. D .; Hutchinson, J .; Сэндфорд, Г. J. Fluorine Chem. 1999, 100, 63.
- ^ Розен, С. Chem. Ред. 1996, 96, 1717.
- ^ Ramsden, C.A .; Смит, Р. Г. Варенье. Chem. Soc. 1998, 120, 6842.
- ^ Умемото, Т .; Нагайоши, М. Бык. Chem. Soc. Jpn. 1996, 69, 2287.