WikiDer > Общий синтез таксола Kuwajima
В Общий синтез таксола Kuwajima группой Исао Кувадзима из Токийский технологический институт это одна из нескольких попыток общий синтез таксола опубликовано в 1990-е гг.[1][2] В полный синтез из Таксол считается ориентиром в органический синтез.
Этот синтез является поистине синтетическим без помощи малых предшественников биомолекул, а также линейный синтез с построением кольца молекулы в порядке A, B, C, D. В какой-то момент хиральность заблокирован в молекуле через асимметричный синтез шаг, который уникален по сравнению с другими усилиями. Как и другие попытки, добавление хвоста основано на Одзима лактам.
Карбоновая рама 20 состоит из нескольких частей: пропаргиловый спирт (C1, C2, C14), пропионовый альдегид (C13, C12, C18), изомасляная кислота (C15, C16, C17, C11), триметил (фенилтиометил) силан (C10), 2-бромбензальдегид (от C3 до C9), цианид диэтилалюминия (C19) и триметилсилилметилбромид (C20)
Синтез А кольцо
Синтез кольца А (схема 1) начал с присоединения к THP защищенный пропаргиловый спирт 1.1 (фрагмент C2-C1-C14) и пропионовый альдегид 1.2 (фрагмент C13-C12-C18) в нуклеофильное присоединение с п-бутиллитий к алкоголь 1.3. В Катализатор Линдлара тогда уменьшенный то алкин к алкен в 1.4 и Окисление Сверна преобразовал алкогольную группу в Enone группа в 1.5. Фрагмент C11-C15-C16-C17 1.6 затем был добавлен в качестве литиевого энолировать из изомасляная кислота этил сложный эфир в сопряженное сложение в гамму кетоэфир 1.7. А Клейзеновская конденсация замкнул кольцо до 1,8, и промежуточный енол захватывается пивалоилхлорид (piv) как защитная группа. Группа THP была удалена с помощью ЦОХ к 1.9 и сформированный алкоголь окислен Окисление Сверна к альдегид 1.10. В ЧАЕВЫЕ силиловый эфир енола 1.11 образовался в результате реакции с тройной TIPSOtf и DBU в DMAP подготовка почвы для асимметричное дигидроксилирование в гидроксиальдегид 1.12. Затем защитная группа piv была заменена группой TIPS в 1.14 после защиты альдегида как аминальный 1.13 и поскольку эта группа автоматически теряется на колоночная хроматография, шаг был повторен до аминала 1.15. Затем фрагмент C10 был введен литиевой солью Триметил (фенилтиометил) силан 1.16 в Олефинирование Петерсона к сульфид 1.17 с последующим снятием защиты до завершенного кольца A 1.18. Кольцо A теперь укомплектовано альдегидной группой и десульфидной группой для закрепления с кольцом C, образующим кольцо B.
| Схема 1 |
|---|
Кольцо синтеза B
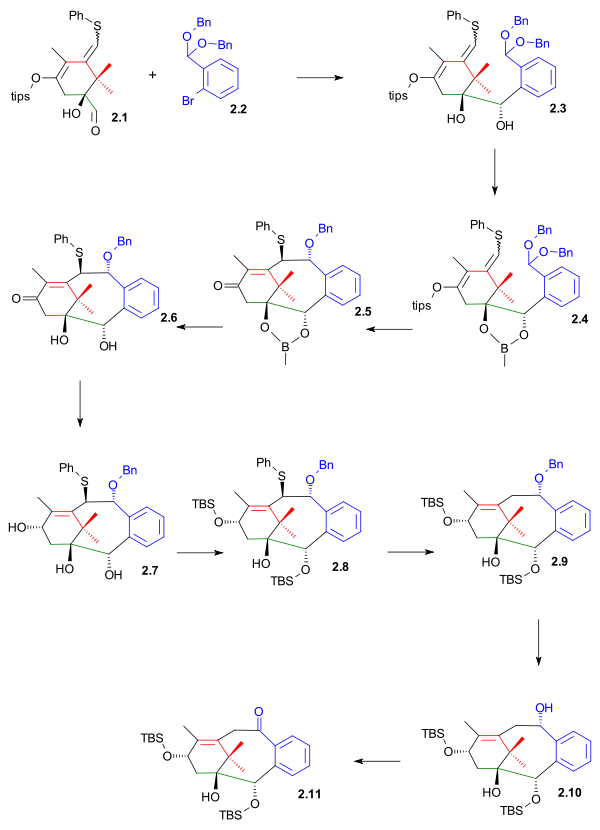
Нижняя часть кольца B была построена нуклеофильное присоединение к альдегиду 2.1 (схема 2) с дибензил ацеталь из 2-бромбензальдегид 2.2 как его ариллитий. Этот этап имеет много общего с синтезом B-кольца в Полный синтез таксола Николау за исключением того, что альдегидная группа расположена в кольце A, а не в кольце B. диол в 2.3 был защищен как бороновый эфир 2.4 подготовка молекулы для замыкания верхней части кольца с тетрахлорид олова на трехколесном велосипеде 2.5 в Фрагментация гроба-подобная реакция.
После снятия защиты (пинакол) диол 2.6, ДИБАЛ снижение триол 2.7 и репротекция TBS (TBSOtf, лутидин) к алкоголю 2.8 можно было удалить фенилсульфидную группу с помощью гидрид трибутилолова и AIBN(видеть Деоксигенация Бартона-Маккомби) к алкоголю 2.9. Палладий на угле гидрирование удалили бензильную защитную группу, что позволило Окисление Сверна из 2.10 к кетону 2.11
| Схема 2 |
|---|
Синтез С кольцо
Завершение цикла C требует полного восстановления арена, размещения атомов пара-кислорода и, что важно, введения метильной группы C19. Первый штурм ароматического кольца в 3.1 (схема 3) был запущен с Сокращение березы (калий, аммиак, тетрагидрофуран, -78 ° C, то этиловый спирт) к диен 3.2. Снятие защиты (TBAF) в диол 3.3, репротекция как бензальдегид ацеталь 3.4 и сокращение (борогидрид натрия) к алкоголю 3.5 позволил окислить диен до 1,4-бутендиола 3.6. В этом фотохимический [4+2]циклоприсоединение, синглетный кислород был произведен из кислорода и роза бенгальская и промежуточный перекись был сокращен с тиомочевина. Следующим шагом было введение фрагмента C19: новая группа диола была защищена как PMP. ацеталь 3.7 (PMP означает п-метоксифенил) позволяя окислить спирт C4 до кетона 3.8 с Десс-Мартин периодинан. Цианид диэтилалюминия отреагировал в сопряженное сложение к группе enone нитрил 3.9. Энол охранялся как TBS эфир 3.10 позволяя восстановить нитрильную группу сначала до альдегид с ДИБАЛ а затем к алкоголь 3.11 с Литий-алюминиевый гидрид. Группа спирта заменена бромом в Реакция Аппеля что вызвало реакция элиминации (потеря HBr) до циклопропан 3.12. Лечение с соляная кислота образованный кетон 3.13, реакция с Йодид самария (II) дало раскрытие кольца, наконец, поставив метильную группу C19 на место в 3.14 и снятие защиты (TBAF) и преобразование енол-кетона дали гидроксикетон 3.15
| Схема 3 |
|---|
Синтез D кольцо
Защищая диольную группу в триоле 4.1 (схема 4) как фенилбороновый эфир 4.2оставшаяся спиртовая группа может быть защищена как эфир TBS 4.3. После снятия защиты с диольной группы (пероксид водорода, бикарбонат натрия) снова в 4.4 можно было окислить спирт C19 до кетона 4.5 с Десс-Мартин периодинан. В новом раунде защиты спирт C7 был преобразован в 2-метокси-2-пропил (MOP) эфир 4.6 с 2-пропенилметиловый эфир и PPTS и кетон C7 был превращен в его энолировать 4.7 по реакции с ХМДС и N, N-бис (трифторметилсульфонил) анилин. Эти преамбулы способствовали введению последнего отсутствующего фрагмента C20 в качестве Реактив Гриньяра триметилсилилметилмагний бромид который соединенный с трифлатом в тетракис (трифенилфосфин) палладий (0) катализируемая реакция на силан 4.8. В триметилсилил группа исключена при добавлении NCS к хлорорганические соединения 4.9. До закрытия кольца D в кольце C было незавершенное дело. Спирт C10 был представлен Окисление MoOPH к 4.10 но с неправильным стереохимия. После ацетилирование к 4.11 и инверсия конфигурации с добавленной базой DBN эта проблема была решена в 4.12. Следующий дигидроксилирование с Оксид осмия (VIII) сформировал диол 4.13 с первичным спиртом при добавлении основания DBU вытесняя атом хлора в нуклеофильное алифатическое замещение к оксетан 4.14.
| Схема 4 |
|---|
Сложение хвоста
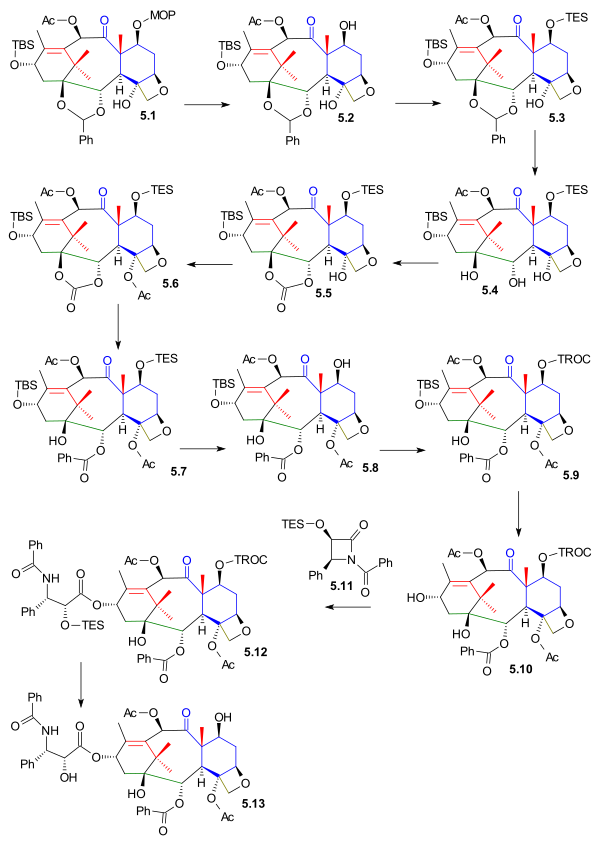
Функциональные группы C1, C2 и C4 были помещены затем на место и, начиная с оксетан 5.1 (схема 5) защитная группа MOM удаляется в 5.2 (PPTS) и заменен группой TES TESCl) в 5.3. В ацеталь группа была удалена в 5.4 (гидрирование PdOH2, H2) и заменен на карбонатный эфир группа в 5.5 (трифосген, пиридин). Группа третичного спирта была ацетилированный в 5.6 и на последней стадии карбонатная группа была открыта реакцией с фениллитий к гидроксиэфиру 5.7.
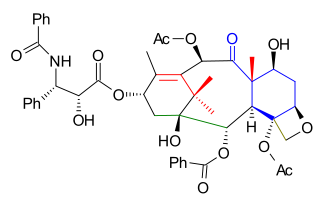
Перед добавлением хвоста защитная группа TES была удалена в 5.8 (фтороводород пиридин) и заменен группой TROC (трихлорэтилкарбонат, TROCCl) в 5.9. Защитная группа спирта C13 была удалена в 5.10 (ТАСФ) включение хвостового добавления Одзима лактам 5.11 (этот шаг является общим для всех синтетических работ на сегодняшний день) 5.12 с Литий бис (триметилсилил) амид. Синтез завершен удалением TROC (цинк, уксусная кислота) к таксолу 5.13.
| Схема 5 |
|---|
Смотрите также
- Общий синтез паклитаксела
- Полный синтез таксола Данишефского
- Общий синтез таксола Холтона
- Полный синтез таксола Мукаяма
- Полный синтез таксола Николау
- Полный синтез таксола Вендера
внешняя ссылка
Рекомендации
- ^ Коитиро Морихира, Риома Хара; Soc, Исао Куваджима; Кавахара, Сигеру; Нисимори, Тошиюки; Накамура, Нобухито; Кусама, Хироюки; Кувадзима, Исао (1998). «Энантиоселективный тотальный синтез таксола». Варенье. Chem. Soc. 120 (49): 12980–12981. Дои:10.1021 / ja9824932.
- ^ Хироюки Кусама; Риома Хара; Сигеру Кавахара; Тошиюки Нисимори; Хадзиме Кашима; Нобухито Накамура; Коитиро Морихира; Исао Куваджима (2000). «Энантиоселективный тотальный синтез (-) - таксола». Варенье. Chem. Soc. 122 (16): 3811–3820. Дои:10.1021 / ja9939439.