WikiDer > Лактоилглутатионлиаза
| лактоилглутатионлиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Ленточная диаграмма глиоксалазы I человека с ее каталитическими ионами цинка, показанными в виде двух фиолетовых сфер. Ингибитор, S-гексилглутатион, отображается как модель, заполняющая пространство; зеленые, красные, синие и желтые сферы соответствуют углерод, кислород, азот и сера атомы, соответственно. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.4.1.5 | ||||||||
| Количество CAS | 9033-12-9 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимология, а лактоилглутатионлиаза (EC 4.4.1.5) (также известный как глиоксалаза I) является фермент который катализирует то изомеризация гемитиоацетальных аддуктов, которые образуются в спонтанной реакции между глутатионильная группа и альдегиды Такие как метилглиоксаль.[1]
- глутатион + метилглиоксаль гемитиоацетальный аддукт (R) -S-лактоилглутатион
Глиоксалаза I получила свое название от катализа на первом этапе глиоксалазная система, важная двухэтапная система детоксикации для метилглиоксаль. Метилглиоксаль производится естественным путем как побочный продукт нормальной биохимии, но он очень токсичен из-за химических реакций с белки, нуклеиновые кислоты, и другие клеточные компоненты. Второй этап детоксикации, на котором (R) -S-лактоилглутатион расщепляется на глутатион и D-лактат, осуществляется посредством глиоксалаза II, а гидролаза. Необычно то, что эти реакции, проводимые глиоксалазной системой, не окисляют глутатион, который обычно действует как редокс кофермент. Несмотря на то что альдозоредуктаза может также выводить токсины из метилглиоксаля, система глиоксалазы более эффективна и, по-видимому, является наиболее важным из этих путей. Глиоксалаза I является привлекательной мишенью для разработки лекарств для лечения инфекций, вызываемых некоторыми паразитическими простейшими, и рак. Несколько ингибиторы глиоксалазы I, такой как S- (N-гидрокси-N-метилкарбамоил) глутатион.
Глиоксалаза I классифицируется как сероуглерод. лиазе хотя, строго говоря, фермент не образует и не разрывает связь углерод-сера. Скорее, фермент сдвигает два атома водорода с одного атома углерода метилглиоксаля на соседний атом углерода. По сути, реакция является внутримолекулярной. редокс реакция; один углерод окисляется, а другой восстанавливается. Механизм действует путем вычитания, а затем добавления протоны, образуя промежуточный эндиолят, а не путем переноса гидриды. Необычно для металлопротеин, этот фермент показывает Мероприятия с несколькими разными металлами. Глиоксалаза I также необычна тем, что стереоспецифический во второй половине его механизма, но не в первой половине. Структурно фермент представляет собой димер с заменой домена у многих видов, хотя две субъединицы слились в мономер в дрожжи, через дупликация гена.
Номенклатура
В систематическое название этого класса ферментов (R) -S-лактоилглутатион-метилглиоксаль-лиаза (изомеризация образования глутатиона); другие имена включают метилглиоксалаза, альдокетомутаза, кетон-альдегид мутаза, и (R) -S-лактоилглутатионметилглиоксаль-лиаза (изомеризация). В некоторых случаях глутатионильный фрагмент может поставляться трипанотион, аналог глутатиона у паразитических простейших, таких как трипаносомы. Человеческий ген этого фермента называется GLO1.
Ген
Лактоилглутатионлиаза у человека кодируется GLO1 ген.[5][6][7]
Структура
Несколько структуры глиоксалазы я решил. Были опубликованы четыре структуры человеческого облика, PDB коды доступа 1BH5, 1FRO, 1QIN, и 1QIP. Пять структур кишечная палочка форма опубликована, с кодами доступа 1FA5, 1FA6, 1FA7, 1FA8, и 1F9Z. Наконец, одна структура специфичной для трипанотиона версии из Leishmania major было решено, 2C21. Во всех этих случаях четвертичная структура биологической единицы представляет собой димер с заменой домена, в котором активный сайт и 8-цепочечный бета-лист вторичная структура образуется из обеих субъединиц. Однако в дрожжи Такие как Saccharomyces cerevisiae, две субъединицы слились в единый мономер двойного размера через дупликация гена. Каждая половина структурного димера представляет собой сэндвич из 3-4 альфа спирали на обеих сторонах 8-нитевого антипараллельного бета-листа; Интерфейс димера в значительной степени состоит из встречи лицом к лицу двух бета-листов.
Третичная и четвертичная структуры глиоксалазы I подобны структурам некоторых других типов белков. Например, глиоксалаза I похожа на несколько белков, которые позволяют бактериям сопротивляться антибиотикам, таким как фосфомицин, блеомицин и митомицин. Точно так же несвязанные ферменты метилмалонил-КоА эпимераза, 3-деметилубихинон-9 3-O-метилтрансфераза и многочисленные диоксигеназы Такие как бифенил-2,3-диол 1,2-диоксигеназа, катехол-2,3-диоксигеназа, 3,4-дигидроксифенилацетат 2,3-диоксигеназа и 4-гидроксифенилпируват диоксигеназа все они по структуре напоминают глиоксалазу I. Наконец, многие белки с неизвестной или неопределенной функцией также напоминают глиоксалазу I, например, At5g48480 из растений, Arabidopsis thaliana.
Активный сайт состоит из четырех основных регионов.
Функция
Основная физиологическая функция глиоксалазы I - детоксикация метилглиоксаль, реактивный 2-оксоальдегид, который является цитостатическим при низких концентрациях[8] и цитотоксичен при миллимолярных концентрациях.[9] Метилглиоксаль - это побочный продукт нормальной биохимии, который является канцерогеном, мутагеном.[10] и может химически повредить несколько компонентов клетки, таких как белки и нуклеиновые кислоты.[9][11] Метилглиоксаль спонтанно образуется из дигидроксиацетонфосфата, ферментативно триозофосфат-изомеразой и метилглиоксальсинтазой, а также при катаболизме треонин.[12]
Чтобы свести к минимуму количество токсичного метилглиоксаля и других реактивных 2-оксоальдегидов, глиоксалазная система развилась. Метилглиоксаль спонтанно реагирует с восстановленным глутатион (или его эквивалент, трипанотион),[13]), образующий гемитиоацеталь. Система глиоксалазы превращает такие соединения в D-лактат и восстановил глутатион.[12] При этом превращении два карбонильных углерода 2-оксоальдегида окисляются и восстанавливаются, соответственно, альдегид окисляется до карбоновой кислоты, а ацетальная группа восстанавливается до спирта. Система глиоксалазы возникла очень рано в истории жизни и почти повсеместно встречается в формах жизни.
Система глиоаксалазы состоит из двух ферментов: глиоксалазы I и глиоксалаза II. Первый фермент, описанный здесь, перестраивает гемитиоацеталь, образованный естественным путем при атаке глутатион на метилглиоксале в продукт. Глиоксалаза II гидролизует продукт с образованием глутатиона и образованием D-лактат. Таким образом, глутатион необычно действует как кофермент и требуется только в каталитических (то есть в очень малых) количествах; обычно глутатион действует как редокс пара в окислительно-восстановительных реакциях.
Также было высказано предположение, что система глиоксалазы играет роль в регулировании роста клеток.[14] и в сборке микротрубочки.[15]
Характеристики
Глиоксалазе I необходимы связанные ионы металлов для катализа.[16] Человеческий фермент[17] и его аналоги в дрожжах (Saccharomyces cerevisiae)[18] и Pseudomonas putida[19] использовать двухвалентный цинк, Zn2+. Напротив, прокариотические версии часто используют никель ион. Глиоксалаза, которую я обнаружил в эукариотических трипаносомальный паразиты, такие как Leishmania major и Trypanosoma cruzi также можно использовать никель для деятельности,[13] возможно, отражая приобретение их гена GLO1 горизонтальный перенос генов.[20]
Свойство глиоксалазы I - отсутствие специфичности в отношении каталитического иона металла. Большинство ферментов связывают один конкретный тип металла, и их каталитическая активность зависит от связывания этого металла. Например, оксидоредуктазы часто используют конкретный металл ион, такой как утюг, марганец или же медь и не смогут работать, если их предпочтительный ион металла будет заменен из-за различий в окислительно-восстановительный потенциал; таким образом, черный супероксиддисмутаза не может функционировать, если его каталитическое железо заменено марганцем, и наоборот. Напротив, хотя человеческая глиоксалаза I предпочитает использовать двухвалентный цинк, она способна функционировать со многими другими двухвалентными металлами, включая магний, марганец, кобальт, никель и даже кальций.;[21] однако фермент неактивен с катионом двухвалентного железа.[22] Точно так же, хотя прокариотическая глиоксалаза I предпочитает никель, она способна работать с кобальтом, марганцем и кадмий; однако фермент инертен по отношению к связанному цинку из-за изменения координационная геометрия из восьмигранный к тригонально-бипирамидный.[13] Структурные и компьютерные исследования показали, что металл связывает два карбонильных атома кислорода метилглиоксального фрагмента в двух из его координационных центров, стабилизируя промежуточное соединение аниона ендиолата.
Еще одно необычное свойство глиоксалазы I - ее непостоянная стереоспецифичность. Первая ступень его реакционного механизма (отрыв протона от C1 и последующее протонирование O2) не является стереоспецифическим и работает одинаково хорошо независимо от начальной хиральности в C1 в гемитиоацетальном субстрате. Образующийся промежуточный эндиолят является ахиральным, но вторая стадия механизма реакции (отрыв протона от O1 и последующее протонирование C2) определенно стереоспецифичен, производя только (S) форма D-лактоилглутатиона. Считается, что это результат двух глутаматы противоположно связан с ионом металла; любой может выполнить первый шаг, но только один может выполнить второй шаг. Причина такой асимметрии до конца не выяснена.
Механизм реакции
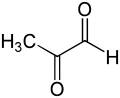
В метилглиоксаль молекула состоит из двух карбонил группы в окружении водород атом и метил группа. В нижеследующем обсуждении эти два карбонильных углерода будут обозначаться как C1 и C2 соответственно. Как в субстрате гемитиоацеталя, так и в продукте (R) -S-лактоилглутатиона глутатион фрагмент связан с карбонильной группой C1.
Основной механизм действия глиоксалазы I следующий. Гемитиоацеталь субстрата образуется, когда молекула глутатион - вероятно, в его реактивном тиолат форма - атакует карбонил C1 метилглиоксаля или родственного соединения, делая этот углерод четырехвалентным. Эта реакция происходит в клетке спонтанно, без участия фермента. Этот гемитиоацеталь затем связывается ферментом, который переводит водород с С1 на С2. Карбонил C2 восстанавливается до формы четырехвалентного спирта путем добавления двух протонов, тогда как карбонил C1 восстанавливается за счет потери водорода, сохраняя при этом свою связь с глутатионовой составляющей.
Вычислительное исследование в сочетании с доступными экспериментальными данными позволяет предположить следующий механизм атомного разрешения для глиоксалазы I.[23] В активном центре каталитический металл принимает октаэдрическую координационную геометрию и в отсутствие субстрата связывает две воды, две противоположные. глутаматы, а гистидин и еще одна боковая цепь, обычно другой гистидин или глутаматы. Когда субстрат входит в активный центр, две воды удаляются, и два карбонильных атома кислорода субстрата связываются непосредственно с ионом металла. Два противоположных глутамата добавляют и вычитают протоны из C1 и C2 и их соответствующих атомов кислорода, O1 и O2. Первая половина реакции переносит протон от С1 к О2, тогда как вторая половина переносит протон от О1 к С2. Первая реакция может быть проведена любым из противоположных глутаматов, в зависимости от начальной хиральности C1 в гемитиоацетальном субстрате; однако вторая половина является стереоспецифической и осуществляется только одним из противоположных глутаматов.
Следует отметить, что первый теоретически подтвержденный механизм р-подложка глиоксалазы опубликована недавно.[24]
Каталитический механизм глиоксалазы был изучен с помощью теории функционала плотности, моделирования молекулярной динамики и гибридных методов QM / MM. Причина особой специфичности фермента (он принимает оба энантиомера своего хирального субстрата, но превращает их в один и тот же энантиомер продукта) заключается в более высокой основности и гибкости одного из глутаматов активного центра (Glu172).[25][26][27]
Перенос протона и гидрида
Первоначально считалось, что глиоксалаза I действует путем передачи гидрид, который является протон в окружении двух электроны (ЧАС–).[28] В этом, как думали, было похоже на классическое Канниццаро реакция механизм, при котором атака гидроксилата на альдегид превращает его в анион четырехвалентного спирта; этот анион отдает свои водороды второму альдегиду, образуя карбоновую кислоту и спирт. (Фактически, два идентичных альдегида восстанавливают и окисляют друг друга, оставляя чистую степень окисления неизменной.)
В глиоксалазе I такой механизм переноса гидрида будет работать следующим образом. Атака глутатиона оставила бы заряженный O– и альдегидный водород, связанный с C1. Если карбонильный кислород C2 может защитить водород от услужливой кислой боковой цепи фермента, образуя спирт, затем водород C1 может одновременно со своими электронами скользить на C2 (гидридный перенос). В то же время лишний электрон на кислороде C1 может преобразовать двойную связь карбонила, давая таким образом конечный продукт.
Альтернативный (и в конечном итоге правильный) механизм с использованием протон (ЧАС+) передача была выдвинута в 1970-х годах.[29] В этом механизме основная боковая цепь фермента отщепляет протон альдегида от C1; в то же время протон a присоединяется к кислороду C2, образуя эндиол. В ene означает, что между C2 и C1, от электронов, оставленных отрывом протона альдегида; то диол относится к тому факту, что два спирта были образованы из двух исходных карбонильных групп. В этом механизме промежуточное соединение образует продукт, добавляя еще один протон к C2.
Ожидалось, что протоны растворителя будут вносить вклад в образование продукта из промежуточного эндиола механизма переноса протона, и когда такие вклады не наблюдались в тритированный воды, 3ЧАС1О, предпочтение отдавалось механизму переноса гидрида. Однако альтернативную гипотезу о том, что активный центр фермента был глубоко скрыт от воды, нельзя было исключить, и в конечном итоге она оказалась верной. Первые признаки появились, когда постоянно повышающиеся температуры показали постоянно увеличивающееся включение трития, что согласуется с переносом протона и неожиданным переносом гидрида. Неопровержимые доказательства могут быть получены с исследованиями водород-дейтерия. изотопный эффект на подложках фторированный по метильной группе и дейтерированный по альдегиду. Фторид - хорошая уходящая группа; механизм переноса гидрида предсказывает меньше отщепление фторид-иона дейтерированным образцом, тогда как механизм переноса протона предсказывает более. Эксперименты с тремя типами глиоксалазы I (дрожжевой, крысиной и мышиной) подтвердили механизм переноса протона в каждом случае.[30] В итоге этот механизм был обнаружен в кристаллических структурах глиоксалазы I.
Клиническое значение
Поведение
Glo1 выражение коррелирует с различиями в тревожном поведении у мышей[31][32] а также поведение в тест подвески хвоста, который чувствителен к антидепрессант наркотики;[33] однако направление этих эффектов не всегда было последовательным, что вызывало скептицизм.[34] Различия в Glo1 экспрессия у мышей, по-видимому, вызвана вариант номера копии это распространено среди инбредные породы мышей.[35] Было высказано предположение, что поведенческие эффекты Glo1 обусловлены активностью его основного субстрата метилглиоксаль в ГАМКА рецепторы.[36] Было показано, что низкомолекулярный ингибитор глиоксалазы I обладает анксиолитическими свойствами, что указывает на другое возможное показание для применения ингибиторов глиоксалазы I.[36]
Как мишень для наркотиков
Глиоксалаза I является мишенью для разработки фармацевтических препаратов против бактерий, простейших (особенно Trypanosoma cruzi и Лейшмания) и рак человека.[37] Было разработано множество ингибиторов, большинство из которых имеют глутатион часть. Среди семейства ингибиторов, наиболее тесно связывающихся с человеческим ферментом, находятся производные S-(N-арил-N-гидроксикарбамоил) глутатион, в первую очередь п-бромофенильное производное, которое имеет константа диссоциации 14 нМ.[38] Наиболее близким аналогом переходного состояния считается S-(N-гидрокси-N-п-йодофенилкарбамоил) глутатион; кристаллическая структура этого соединения, связанного с человеческим ферментом, была решена с разрешением 2 Å (код доступа PDB 1QIN).[39]
Эксперименты предполагают, что метилглиоксаль преимущественно токсичен для пролиферирующих клеток, например, раковых.[40]
Недавние исследования показывают, что экспрессия GLO1 повышается в различных злокачественных опухолях человека, включая метастатическую меланому.[41][42]
Рекомендации
- ^ Thornalley PJ (декабрь 2003 г.). «Глиоксалаза I - структура, функция и важнейшая роль в ферментативной защите от гликирования». Сделки Биохимического Общества. 31 (Pt 6): 1343–8. Дои:10.1042 / BST0311343. PMID 14641060.
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000124767 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ранганатан С., Уолш Е.С., Годвин А.К., Тью К.Д. (март 1993 г.). «Клонирование и характеристика глиоксалазы-I толстой кишки человека». Журнал биологической химии. 268 (8): 5661–7. PMID 8449929.
- ^ Ким Н.С., Умедзава Ю., Омура С., Като С. (май 1993 г.). «Клонирование кДНК глиоксалазы I человека, экспрессия и сходство последовательностей с глиоксалазой I из Pseudomonas putida». Журнал биологической химии. 268 (15): 11217–21. PMID 7684374.
- ^ «Ген Энтреза: глиоксалаза I GLO1».
- ^ Кэмерон А.Д., Олин Б., Риддерстрём М., Маннервик Б., Джонс Т.А. (июнь 1997 г.). «Кристаллическая структура глиоксалазы I человека - свидетельство дупликации генов и обмена трехмерными доменами». Журнал EMBO. 16 (12): 3386–95. Дои:10.1093 / emboj / 16.12.3386. ЧВК 1169964. PMID 9218781.
- ^ а б Иноуэ Ю., Кимура А. (1995). «Неизвестное название главы». В РК Пул (ред.). Успехи микробной физиологии (том 37 изд.). Лондон: Academic Press. С. 177–227.
- ^ Нагао М., Фудзита Ю., Вакабаяси К., Нукая Х., Косуге Т., Сугимура Т. (август 1986). «Мутагены в кофе и других напитках». Перспективы гигиены окружающей среды. 67: 89–91. Дои:10.1289 / ehp.866789. JSTOR 3430321. ЧВК 1474413. PMID 3757962.
- ^ Ferguson GP, Tötemeyer S, MacLean MJ, Booth IR (октябрь 1998 г.). «Производство метилглиоксаля в бактериях: самоубийство или выживание?». Архив микробиологии. 170 (4): 209–18. Дои:10.1007 / s002030050635. PMID 9732434. S2CID 21289561.
Оя Т., Хаттори Н., Мидзуно Ю., Мията С., Маеда С., Осава Т., Учида К. (июнь 1999 г.). «Метилглиоксаль-модификация белка. Химическая и иммунохимическая характеристика аддуктов метилглиоксаль-аргинин». Журнал биологической химии. 274 (26): 18492–502. Дои:10.1074 / jbc.274.26.18492. PMID 10373458.
Thornalley PJ (1998). «Глутатион-зависимая детоксикация α-оксоальдегидов системой глиоксалазы: участие в механизмах заболевания и антипролиферативная активность ингибиторов глиоксалазы I.». Chem. Биол. Взаимодействовать. 112–112: 137–151. Дои:10.1016 / с0009-2797 (97) 00157-9. PMID 9679550. - ^ а б Thornalley PJ (1996). «Фармакология метилглиоксаля: образование, модификация белков и нуклеиновых кислот и ферментативная детоксигфикация - роль в патогенезе и антипролиферативной химиотерапии». Gen. Pharmac. 27 (4): 565–573. Дои:10.1016/0306-3623(95)02054-3. PMID 8853285.
- ^ а б c Ариза А., Викерс Т.Дж., Грейг Н., Армор К.А., Диксон М.Дж., Эгглстон И.М. и др. (Февраль 2006 г.). «Специфичность трипанотион-зависимой глиоксалазы I Leishmania major: структура и биохимическое сравнение с человеческим ферментом». Молекулярная микробиология. 59 (4): 1239–48. Дои:10.1111 / j.1365-2958.2006.05022.x. PMID 16430697. S2CID 10113958.
- ^ Szent-Gyoergyi A (июль 1965 г.). «Клеточное деление и рак». Наука. 149 (3679): 34–7. Bibcode:1965Научный ... 149 ... 34С. Дои:10.1126 / science.149.3679.34. PMID 14300523.
- ^ Гиллеспи Э (январь 1979 г.). «Влияние S-лактоилглутатиона и ингибиторов глиоксалазы I на высвобождение гистамина из лейкоцитов человека». Природа. 277 (5692): 135–7. Bibcode:1979Натура.277..135G. Дои:10.1038 / 277135a0. PMID 83539. S2CID 2153821.
- ^ Вандер Ягт DL (1989). «Неизвестное название главы». In D Дельфин; Р. Поулсон; О Аврамович (ред.). Коэнзимы и кофакторы VIII: глутатион, часть A. Нью-Йорк: Джон Уайли и сыновья.
- ^ Aronsson AC, Marmstål E, Mannervik B (апрель 1978 г.). «Глиоксалаза I, металлофермент цинка млекопитающих и дрожжей». Сообщения о биохимических и биофизических исследованиях. 81 (4): 1235–40. Дои:10.1016 / 0006-291X (78) 91268-8. PMID 352355.
- ^ Риддерстрём М., Маннервик Б. (март 1996 г.). «Оптимизированная гетерологичная экспрессия человеческого фермента цинка глиоксалазы I». Биохимический журнал. 314 (Pt 2) (2): 463–7. Дои:10.1042 / bj3140463. ЧВК 1217073. PMID 8670058.
- ^ Сен-Жан А.П., Филлипс К.Р., Крейтон ди-джей, Стоун М.Дж. (июль 1998 г.). «Активные мономерные и димерные формы глиоксалазы I Pseudomonas putida: свидетельства обмена 3D-доменами». Биохимия. 37 (29): 10345–53. Дои:10.1021 / bi980868q. PMID 9671502.
- ^ Greig N, Wyllie S, Vickers TJ, Fairlamb AH (декабрь 2006 г.). «Трипанотион-зависимая глиоксалаза I в Trypanosoma cruzi». Биохимический журнал. 400 (2): 217–23. Дои:10.1042 / BJ20060882. ЧВК 1652828. PMID 16958620.
- ^ Sellin S, Eriksson LE, Aronsson AC, Mannervik B (февраль 1983 г.). «Октаэдрическая координация металлов в активном центре глиоксалазы I, о чем свидетельствуют свойства Co (II) -глиоксалазы I». Журнал биологической химии. 258 (4): 2091–3. PMID 6296126.
Селлин С, Маннервик Б (1984). «Константы диссоциации металлов для глиоксалазы I, восстановленной с помощью Zn.2+, Co2+, Mn2+, и Mg2+". Журнал биологической химии. 259 (18): 11426–11429. PMID 6470005. - ^ Уотила Л., Койвусало М. (апрель 1975 г.). «Очистка и свойства глиоксалазы I из печени барана». Европейский журнал биохимии. 52 (3): 493–503. Дои:10.1111 / j.1432-1033.1975.tb04019.x. PMID 19241.
- ^ Himo F, Siegbahn PE (октябрь 2001 г.). «Каталитический механизм глиоксалазы I: теоретическое исследование». Журнал Американского химического общества. 123 (42): 10280–9. Дои:10.1021 / ja010715h. PMID 11603978.
- ^ Джафари С., Райд Ю., Фуда А. Э., Алави Ф. С., Донг Дж., Ирани М. (февраль 2020 г.). «Квантовая механика / Молекулярно-механическое исследование механизма реакции глиоксалазы I». Неорганическая химия. 59 (4): 2594–2603. Дои:10.1021 / acs.inorgchem.9b03621. PMID 32011880.
- ^ Джафари С., Райд Ю., Ирани М. (сентябрь 2016 г.). «Каталитический механизм человеческой глиоксалазы I изучен с помощью квантово-механических кластерных расчетов». Журнал молекулярного катализа B: Ферментативный. 131: 18–30. Дои:10.1016 / j.molcatb.2016.05.010.
- ^ Джафари С., Каземи Н., Райд У, Ирани М. (май 2018 г.). «Повышенная гибкость Glu-172 объясняет необычную стереоспецифичность глиоксалазы I». Неорганическая химия. 57 (9): 4944–4958. Дои:10.1021 / acs.inorgchem.7b03215. PMID 29634252.
- ^ Джафари С., Райд Ю., Ирани М. (01.01.2019). «QM / MM исследование стереоспецифического протонного обмена глутатиогидроксиацетона глиоксалазой I». Результаты по химии. 1: 100011. Дои:10.1016 / j.rechem.2019.100011.
- ^ Роза И.А. (июль 1957 г.). «Механизм действия глиоксалазы I». Biochimica et Biophysica Acta. 25 (1): 214–5. Дои:10.1016/0006-3002(57)90453-5. PMID 13445752.
Франзен V (1956). "Wirkungsmechanismus der Glyoxalase I". Chemische Berichte / Recueil. 89 (4): 1020–1023. Дои:10.1002 / cber.19560890427.
Франзен V (1957). "Beziehungen zwischen Konstitution und katalytischer Aktivität der Thiolaminen bei der Katalyse der intramolekularen Cannizzaro-Reaktion". Chemische Berichte / Recueil. 90 (4): 623–633. Дои:10.1002 / cber.19570900427. - ^ Холл СС, Довейко AM, Джордан Ф (ноябрь 1976 г.). «Исследования фермента глиоксалазы I. 2. Доказательства ядерного магнитного резонанса для механизма переноса эндиол-протон». Журнал Американского химического общества. 98 (23): 7460–1. Дои:10.1021 / ja00439a077. PMID 977876.
Холл СС, Довейко AM, Джордан Ф (1978). «Исследования фермента глиоксалазы I. 4. Катализируемая основанием перегруппировка переноса протона ендиола метил-глиоксальглутатионилгемитиола и фенилглиоксальглутатионилгемитиола ацеталь в S-лактоилглутатион и S-манделоилглутатион с последующим гидролизом - ферментная система - модель глиоксалазы». Журнал Американского химического общества. 100 (18): 5934–5939. Дои:10.1021 / ja00486a054. - ^ Чари Р.В., Козарич Ю.В. (октябрь 1981 г.). «Влияние изотопа дейтерия на разделение продукта фторметилглиоксаля глиоксалазой I. Доказательство механизма переноса протона». Журнал биологической химии. 256 (19): 9785–8. PMID 7024272.
Козарич Дж. В., Чари Р. В., Ву Дж. К., Лоуренс Т. Л. (1981). «Фторметилглиоксаль - синтез и разделение продукта, катализируемое глиоксалазой I, через предполагаемый промежуточный эндиол». Журнал Американского химического общества. 103 (15): 4593–4595. Дои:10.1021 / ja00405a057. - ^ Hovatta I, Tennant RS, Helton R, Marr RA, Singer O, Redwine JM и др. (Декабрь 2005 г.). «Глиоксалаза 1 и глутатионредуктаза 1 регулируют тревожность у мышей». Природа. 438 (7068): 662–6. Bibcode:2005Натура.438..662H. Дои:10.1038 / природа04250. PMID 16244648. S2CID 4425579.
- ^ Krömer SA, Kessler MS, Milfay D, Birg IN, Bunck M, Czibere L, et al. (Апрель 2005 г.). «Идентификация глиоксалазы-I в качестве белкового маркера на мышиной модели крайних проявлений тревожности». Журнал неврологии. 25 (17): 4375–84. Дои:10.1523 / JNEUROSCI.0115-05.2005. ЧВК 6725100. PMID 15858064.
- ^ Бентон С.С., Миллер Б.Х., Скверер С., Сузуки О., Шульц Л.Е., Кэмерон М.Д. и др. (Май 2012 г.). «Оценка генетических маркеров и нейробиохимических аналитов для ответа на флуоксетин с использованием панели инбредных линий мышей». Психофармакология. 221 (2): 297–315. Дои:10.1007 / s00213-011-2574-z. ЧВК 3337404. PMID 22113448.
- ^ Thornalley PJ (май 2006 г.). «Беспокойство о роли глиоксалазы 1 в поведении, связанном с высокой тревожностью». Тенденции в молекулярной медицине. 12 (5): 195–9. Дои:10.1016 / j.molmed.2006.03.004. PMID 16616641.
- ^ Уильямс Р., Лим Дж. Э., Харр Б., Крыло С, Уолтерс Р., Дистлер М. Г. и др. (2009). «Распространенный и нестабильный вариант числа копий связан с различиями в выражении Glo1 и тревожном поведении». PLOS ONE. 4 (3): e4649. Bibcode:2009PLoSO ... 4.4649W. Дои:10.1371 / journal.pone.0004649. ЧВК 2650792. PMID 19266052.
- ^ а б Distler MG, Plant LD, Sokoloff G, Hawk AJ, Aneas I, Wuenschell GE и др. (Июнь 2012 г.). «Глиоксалаза 1 усиливает тревогу, уменьшая количество метилглиоксаля, агониста рецепторов ГАМК».. Журнал клинических исследований. 122 (6): 2306–15. Дои:10.1172 / JCI61319. ЧВК 3366407. PMID 22585572.
- ^ Thornalley PJ (1993). «Система глиоксалазы в здоровье и болезни». Молекулярные аспекты медицины. 14 (4): 287–371. Дои:10.1016 / 0098-2997 (93) 90002-У. PMID 8277832.
- ^ Murthy NS, Bakeris T, Kavarana MJ, Hamilton DS, Lan Y, Creighton DJ (июль 1994). «Производные S- (N-арил-N-гидроксикарбамоил) глутатиона являются ингибиторами прочного связывания глиоксалазы I и медленными субстратами для глиоксалазы II». Журнал медицинской химии. 37 (14): 2161–6. Дои:10.1021 / jm00040a007. PMID 8035422.
- ^ Кэмерон А.Д., Риддерстрём М., Олин Б., Каварана М.Дж., Крейтон Д.Д., Маннервик Б. (октябрь 1999 г.). «Механизм реакции глиоксалазы I исследован с помощью рентгеновского кристаллографического анализа человеческого фермента в комплексе с аналогом переходного состояния». Биохимия. 38 (41): 13480–90. Дои:10.1021 / bi990696c. PMID 10521255.
- ^ Эгюд Л.Г., Сент-Дьёрдьи А. (июнь 1968 г.). «Канцеростатическое действие метилглиоксаля». Наука. 160 (3832): 1140. Bibcode:1968Sci ... 160.1140E. Дои:10.1126 / science.160.3832.1140. PMID 5647441.
Аюб FM, Аллен Р. Э., Торнали П. Дж. (Май 1993 г.). «Ингибирование пролиферации клеток лейкемии человека 60 метилглиоксалем in vitro». Исследование лейкемии. 17 (5): 397–401. Дои:10.1016/0145-2126(93)90094-2. PMID 8501967. - ^ Баир В.Б., Кабелло С.М., Учида К., Бауза А.С., Вондрак Г.Т. (апрель 2010 г.). «Сверхэкспрессия GLO1 при злокачественной меланоме человека». Исследование меланомы. 20 (2): 85–96. Дои:10.1097 / CMR.0b013e3283364903. ЧВК 2891514. PMID 20093988.
- ^ Santarius T, Bignell GR, Greenman CD, Widaa S, Chen L, Mahoney CL и др. (Август 2010 г.). «Новый амплифицированный ген GLO1-A при раке человека». Гены, хромосомы и рак. 49 (8): 711–25. Дои:10.1002 / gcc.20784. ЧВК 3398139. PMID 20544845.
дальнейшее чтение
- Эквалл К., Маннервик Б. (февраль 1973 г.). «Стереохимическая конфигурация лактоильной группы S-лактоилглутатионина, образованная действием глиоксалазы I из эритроцитов свиней и дрожжей». Biochimica et Biophysica Acta (BBA) - Общие предметы. 297 (2): 297–9. Дои:10.1016/0304-4165(73)90076-7. PMID 4574550.
- Ракер Э (июнь 1951 г.). «Механизм действия глиоксалазы». Журнал биологической химии. 190 (2): 685–96. PMID 14841219.
- Аллен Р. Э., Лоу Т. В., Торнали П. Дж. (Апрель 1993 г.). «Упрощенный метод очистки глиоксалазы красных кровяных телец человека. I. Характеристики, иммуноблоттинг и исследования ингибиторов». Журнал химии белков. 12 (2): 111–9. Дои:10.1007 / BF01026032. PMID 8489699. S2CID 31587421.
- Ларсен К., Аронссон А.С., Мармстол Э., Маннервик Б. (1985). «Иммунологическое сравнение глиоксалазы I дрожжей и млекопитающих и количественное определение фермента в тканях человека с помощью радиоиммуноанализа». Сравнительная биохимия и физиология. B, Сравнительная биохимия. 82 (4): 625–38. Дои:10.1016/0305-0491(85)90499-7. PMID 3937656.
- Vander Jagt DL, Daub E, Krohn JA, Han LP (август 1975 г.). «Влияние pH и тиолов на кинетику дрожжевой глиоксалазы I. Оценка механизма случайного пути». Биохимия. 14 (16): 3669–75. Дои:10.1021 / bi00687a024. PMID 240387.
- Филипс С.А., Торнали П.Дж. (февраль 1993 г.). «Образование метилглиоксаля из триозофосфатов. Исследование с использованием специального анализа для метилглиоксаля». Европейский журнал биохимии. 212 (1): 101–5. Дои:10.1111 / j.1432-1033.1993.tb17638.x. PMID 8444148.