WikiDer > Респираторно-синцитиальный вирус
| Ортопневмовирус человека | |
|---|---|
 | |
| Электронная микрофотография RSV | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область: | Рибовирия |
| Королевство: | Орторнавиры |
| Тип: | Негарнавирикота |
| Класс: | Monjiviricetes |
| Заказ: | Mononegavirales |
| Семья: | Пневмовирусы |
| Род: | Ортопневмовирус |
| Разновидность: | Ортопневмовирус человека |
| Синонимы[1] | |
| |
респираторно-синцитиальный вирус (RSV), также называемый респираторно-синцитиальный вирус человека (hRSV) и человеческий ортопневмовирус, очень распространенный, заразный вирус что вызывает инфекции дыхательные пути. Это отрицательный смысл, одноцепочечный РНК вирус, и его название происходит от большого синцитий которые образуются при слиянии инфицированных клеток.[2][3]
Хотя RSV является единственной наиболее частой причиной госпитализации младенцев с респираторными заболеваниями, повторное инфицирование остается обычным явлением на протяжении всей жизни и является важным фактором. возбудитель во всех возрастных группах. Уровень инфицирования обычно выше в холодные зимние месяцы, вызывая бронхиолит у младенцев, простуда у взрослых и более серьезных респираторных заболеваний, таких как пневмония у пожилых людей и с ослабленным иммунитетом.[4]
RSV передается через загрязненные воздушные капли и может вызывать вспышки как среди населения, так и в больницах. Следующий прививка глаз или носа, вирус заразит эпителиальные клетки верхнего и нижнего дыхательные пути, вызывая воспаление, повреждение клеток и обструкцию дыхательных путей.[2] Доступны различные методы для обнаружения вирусов и диагностики RSV, включая: тестирование на антиген, молекулярное тестирование и вирусная культура.[3] Хотя основные меры профилактики включают мытье рук и недопущение тесного контакта с инфицированными людьми, профилактический лекарство называется паливизумаб доступен для предотвращения инфекции RSV у младенцев из группы высокого риска. В настоящее время вакцины против RSV нет, хотя многие из них находятся в стадии разработки.[5]
Лечение в первую очередь поддерживающее, включая: кислородная терапия и более продвинутая поддержка дыхания с CPAP или носовой кислород с высоким потоком, как требуется. В тяжелых случаях нарушение дыхания, интубация и механическая вентиляция может потребоваться. Рибавирин единственный противовирусное средство в настоящее время лицензированы лекарства для лечения РСВ у детей, хотя их использование остается спорным.[6]
Признаки и симптомы
Инфекция RSV может проявляться широким спектром признаков и симптомов, от легких до легкой степени. инфекции верхних дыхательных путей (ИВДП) до тяжелых и потенциально опасных для жизни инфекции нижних дыхательных путей (LRTI), требующие госпитализации и механическая вентиляция.[7] Хотя RSV может вызывать инфекции дыхательных путей у людей всех возрастов и является одной из наиболее распространенных детских инфекций, его проявления часто варьируются в зависимости от возрастных групп и иммунного статуса.[4] Реинфекция является обычным явлением на протяжении всей жизни, но младенцы и пожилые люди остаются в группе повышенного риска симптоматической инфекции.[7]
Дети
Большинство детей переживут хотя бы одну инфекцию RSV к 2 годам.[8] Большинство детских RSV-инфекций проходят самостоятельно с типичными признаками и симптомами со стороны верхних дыхательных путей, такими как заложенность носа, насморк, кашель и субфебрильная температура.[4][8] Воспаление слизистой оболочки носа (ринит) и горло (фарингит), а также покраснение глаз (конъюнктивальная инфекция), можно увидеть на экзамене.[9] Примерно у 15-50% детей развиваются более серьезные инфекции нижних дыхательных путей, такие как бронхиолит, вирусная пневмония, или же круп.[7][10] Младенцы подвергаются наибольшему риску прогрессирования заболевания.[9]
Бронхиолит это распространенная инфекция нижних дыхательных путей, характеризующаяся воспалением и обструкцией мелких дыхательных путей в легких.[11] Хотя некоторые вирусы могут вызывать бронхиолит, RSV является причиной примерно 70% случаев.[4] Обычно проявляется насморком и заложенностью носа от 2 до 4 дней с последующим ухудшением кашля, шумным дыханием, тахипноэ (учащенное дыхание) и хрипы.[8] Поскольку младенцы труднее дышат, у них также могут проявляться признаки респираторный дистресс, например, подреберный опровержения (когда живот втягивается под грудную клетку), межреберные сокращения (когда мышцы между ребрами тянутся внутрь), кряхтение и расширение носа.[7] Если ребенок не может нормально кормить, признаки обезвоживание также может присутствовать.[8] Может присутствовать лихорадка, но высокая температура редко.[7] Хрипы и хрипы часто слышны на аускультация, и насыщение кислородом уровни могут быть уменьшены.[11]
У очень маленьких детей в возрасте до 6 недель, особенно у недоношенных, признаки инфекции могут быть менее специфичными. У них может быть минимальное респираторное поражение. Вместо этого они могут проявлять пониженную активность, раздражительность, плохое питание или затрудненное дыхание. Это также может сопровождаться приступы апноэ, или короткие паузы в дыхании.[4][12]
Взрослые
Реинфекция RSV остается обычным явлением на протяжении всей жизни. Реинфекция в зрелом возрасте часто вызывает симптомы от легкой до умеренной, неотличимые от простуда или инфекция носовых пазух.[4] Инфекция также может быть бессимптомный. Если есть, симптомы, как правило, относятся к верхним дыхательным путям: насморк, боль в горле, лихорадка и недомогание. В подавляющем большинстве случаев заложенность носа предшествует развитию кашля.[9] В отличие от других инфекций верхних дыхательных путей, RSV также чаще вызывает новые приступы хрипов у взрослых.[9] Только около 25% инфицированных взрослых разовьются до серьезной инфекции нижних дыхательных путей, например: бронхит или трахеобронхит.[7]
Хотя RSV очень редко вызывает тяжелые заболевания у здоровых взрослых, он может вызывать значительную заболеваемость и смертность у пожилых людей, а также у людей с основным иммунным нарушением или сердечно-легочными заболеваниями. Пожилые люди имеют такое же проявление, что и молодые люди, но, как правило, имеют более выраженные симптомы с повышенным риском поражения нижних дыхательных путей. В частности, пожилые люди чаще испытывают пневмония, респираторный дистресс, и смерть.[9]
С ослабленным иммунитетом
И у взрослых, и у детей те, кто с ослабленным иммунитетом подвержены повышенному риску тяжелой инфекции RSV. Инфицированные люди в этой группе с большей вероятностью будут прогрессировать от поражения верхних дыхательных путей к поражению нижних дыхательных путей и имеют длительную вирусное выделение.[13] По-видимому, тяжесть симптомов тесно связана со степенью подавления иммунитета. Те, кто прошел трансплантация гемопоэтических стволовых клеток (ТГСК), интенсивный химиотерапия, и трансплантация легких особенно восприимчивы.[14][9] Пациенты с трансплантацией костного мозга, по-видимому, подвергаются наибольшему риску, особенно до приживления костного мозга. В этой группе инфекция RSV несет почти 80% риск пневмонии и смерти.[9][15]
Осложнения
| численность населения | Осложнения RSV-инфекции |
|---|---|
| Дети | У краткосрочных госпитализированных детей есть риск развития:[4]
В долгосрочной перспективе дети подвержены риску развития следующих хронических состояний, которые могут сохраниться во взрослой жизни: |
| Взрослые | Следующее чаще встречается у пожилых людей или людей с основным иммунодефицитом или сердечно-легочными заболеваниями: |
| С ослабленным иммунитетом | Некоторые группы с ослабленным иммунитетом подвержены более высокому риску конкретных осложнений, таких как:
|
Причина
Факторы риска
Факторы риска развития тяжелой инфекции нижних дыхательных путей, вызванной RSV, варьируются в зависимости от населения.
| численность населения | Факторы риска прогрессирования инфекции нижних дыхательных путей, вызванной RSV |
|---|---|
| Дети[18] | Недоношенность Низкий вес при рождении Мужской пол Наличие старших братьев и сестер Курение матери во время беременности История атопия (склонность к развитию аллергических заболеваний) Без грудного вскармливания Скученность домохозяйств Врожденное заболевание сердца или легких |
| Взрослые и пожилые[4] | Пожилой возраст (> 65 лет) Хроническое сердце или легкое (особенно ХОБЛ) Функциональная инвалидность Проживание в доме престарелых |
| С ослабленным иммунитетом[13][19] | Лимфопения Болезнь трансплантат против хозяина Использование кортикостероиды или миелоаблативный режимы кондиционирования |
Вирусология
Таксономия
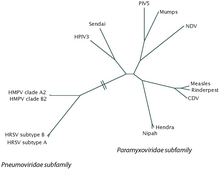
RSV - это отрицательный смысл, одноцепочечный РНК вирус.[2] Научное название этого вирусного вида: Ортопневмовирус человека. Это синоним Респираторно-синцитиальный вирус человека (hRSV) и часто сокращается до RSV.[20] Он принадлежит к роду Ортопневмовирус, семья Пневмовирусы, порядок Mononegavirales.[2] Его название происходит от того, что F белки на поверхности вируса заставляют соседние клеточные мембраны сливаться, создавая большие многоядерные синцития.[9]
Антигенные подтипы
RSV делится на два антигенных подтипа, A и B, на основании реактивности поверхностных белков F и G к моноклональным антителам.[9][2] Подтипы имеют тенденцию циркулировать одновременно в рамках местных эпидемий, хотя подтип А имеет тенденцию быть более распространенным.[15] Как правило, RSV подтипа A (RSVA) считается более вирулентным, чем RSV подтипа B (RSVB), с более высокой вирусной нагрузкой и более быстрым временем передачи.[9][2] На сегодняшний день 16 RSVA и 22 RSVB клады (или штаммы) были идентифицированы.[2] Среди RSVA преобладают клады GA1, GA2, GA5 и GA7; GA7 встречается только в США.[2] Среди RSVB во всем мире преобладает клада BA.[2]
Геном
RSV имеет отрицательный смысл, одноцепочечный РНК геном.[2] В геном линейна и приблизительно 15000 нуклеотиды в длину.[9] Он не сегментирован, что означает, что в отличие от грипп, RSV не может участвовать в типе генетических перегруппировка и антигенные сдвиги отвечает за большие пандемии.[4] Имеет 10 гены кодирует 11 белков.[4][2] Порядок генов - NS1-NS2-N-P-M-SH-G-F-M2-L, при этом ген NS1 и NS2 служат в качестве генов неструктурных промоторов.[21]
Структура и белки
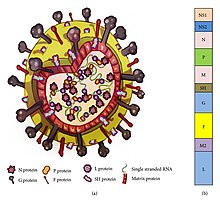
RSV - средний (~ 150 нм) оболочечный вирус. Хотя большинство частиц имеют сферическую форму, также были идентифицированы нитевидные частицы.[2][9] Геном расположен внутри спирального нуклеокапсида и окружен матриксным белком и оболочкой, содержащей вирусные гликопротеины.[22] Существует 11 белков, которые описаны ниже в таблице.
| Расположение в Вирионе | Протеин | Альтернативное имя | Функция | Дополнительная информация |
|---|---|---|---|---|
| Липидная оболочка (трансмембранные поверхностные белки) | грамм | Гликопротеин | Присоединение вируса к реснитчатым клеткам дыхательных путей хозяина | Гликопротеины F и G - это два основных поверхностных белка, которые контролируют прикрепление вируса и начальные стадии инфекции. Белки F и G также являются основными мишенями для нейтрализующие антитела при естественном заражении. |
| F | Слитый белок | Слияние мембран вирусных и хозяйских клеток; образование синцития | ||
| SH | Небольшой гидрофобный белок | Виропорин; ионный канал | Участвует в слиянии клеток, но нейтрализующий эпитоп неизвестен. | |
| Внутренняя сторона конверта | M | Матричный белок | сборка | |
| Рибонуклеокапсид | N | Нуцелопротеин | Связывание РНК | Участвует в геноме транскрипция, Репликация РНК и почкование частиц |
| п | Фосфопротеин | Фосфорилирование | ||
| L | «Большой» белок | РНК-зависимая РНК-полимераза | ||
| M2-1 | - | Фактор процессивности транскрипции | ||
| Нормативный | М2-2 | - | Регулирование транскрипция / Репликация РНК | |
| Неструктурный | НС-1 | - | Участвует в уклонении от врожденная иммунная система | Действуйте, запрещая апоптоз и подавление IFN типа I сигнализация |
| НС-2 | - |
G протеин
Поверхностный белок G (гликопротеин) в первую очередь отвечает за прикрепление вируса к клеткам-хозяевам.[23] Этот белок сильно варьируется между штаммами.[15] G-белок существует как в мембраносвязанной, так и в секретируемой формах.[9][23] Обнаруженная в мембране форма отвечает за прикрепление путем связывания с гликозаминогликаны (GAG), такие как гепарансульфат, на поверхности клеток-хозяев.[9][4][2] Секретируемая форма действует как приманка, взаимодействуя с антигенпрезентирующими клетками, чтобы ингибировать опосредованное антителами нейтрализация.[9][23] G-белок также содержит CX3C фракталкин-подобный мотив, который связывается с хемокиновым рецептором CX3C 1 (CX3CR1) на поверхности ресничных клеток-хозяев бронхов.[4][2] Это связывание может изменять хемотаксис клеток и уменьшать миграцию иммунных клеток в легкие инфицированных людей.[23] G-белок также изменяет иммунный ответ хозяина, подавляя передачу сигналов от нескольких толл-подобные рецепторы, в том числе TLR4.[4][23]
F белок
Поверхностный белок F (гибридный белок) отвечает за слияние мембран вируса и клетки-хозяина, а также за образование синцития между вирусными частицами.[23] Его последовательность высоко консервативна между штаммами.[15] Интересно, что в то время как вирусное прикрепление, по-видимому, связано с белками F и G, слияние F происходит независимо от G.[23] Белок F существует во множестве конформационных форм.[4][2] В состоянии до слияния (PreF) белок существует в тримерной форме и содержит основные антигенный сайт Ø.[2] Ø служит основной целью нейтрализующие антитела в организме.[4] После связывания со своей мишенью на поверхности клетки-хозяина (точный лиганд остается неясным) PreF подвергается конформационное изменение во время которого Ø теряется.[4][2] Это изменение позволяет белку внедряться в хозяина. клеточная мембрана и приводит к слиянию мембран вируса и клетки-хозяина.[2] Окончательный конформационный сдвиг приводит к более стабильной и удлиненной форме белка (постфузионный, PostF).[4] В отличие от белка G RSV, белок F RSV также связывается и активирует toll-подобный рецептор 4 (TLR4), инициируя врожденный иммунный ответ и передачу сигнала.[23][2]
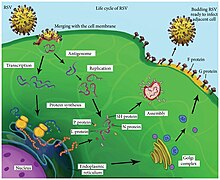
Цикл репликации
После слияния мембран вируса и клетки-хозяина вирусный нуклеокапсид (содержащий вирусный геном) и связанная вирусная полимераза доставляются в клетку-хозяин цитоплазма. Транскрипция и перевод оба происходят в цитоплазме. РНК-зависимая РНК-полимераза транскрибирует геном в 10 сегментов информационной РНК (мРНК), который транслируется в структурные белки аппаратом клетки-хозяина. В течение репликация из отрицательный смысл вирусный геном, РНК-зависимая РНК-полимераза синтезирует позитивно-смысловой комплемент, называемый антигеномом. Эта комплементарная цепь используется в качестве матрицы для конструирования геномной РНК с отрицательным смыслом, которая упаковывается в нуклеокапсиды и транспортируется к плазматической мембране для сборки и отпочкования частиц.[22]
Механизм
Передача инфекции
RSV очень заразен и может вызывать вспышки как от сообщества, так и от больниц.[9] По оценкам, на каждого человека, инфицированного RSV, в среднем заразятся от 5 до 25 неинфицированных.[24] RSV может распространяться, когда инфицированный человек кашляет или чихает, выпуская зараженные капли в воздух. Передача обычно происходит при контакте этих капель с (или прививать) глаза, нос или рот другого человека.[25] RSV также может жить до 25 минут на загрязненной коже (например, руках) и несколько часов на других поверхностях, таких как столешницы и дверные ручки.[9][24] Имеет период инкубации от 2 до 8 дней.[9] После заражения люди обычно заразны от 3 до 8 дней. Однако у младенцев и людей с ослабленной иммунной системой вирус может продолжать распространяться до 4 недель (даже после того, как симптомы исчезнут).[25]
Патогенез
Следующий прививка носа или глаз, RSV заражает реснитчатый столбчатые эпителиальные клетки верхних и нижних дыхательных путей.[9] RSV продолжает копировать в этих бронхиальных клетках около 8 дней.[2] По прошествии первых нескольких дней инфицированные RSV клетки станут более округлыми и в конечном итоге распадутся на более мелкие. бронхиолы нижних дыхательных путей.[2] Считается, что этот механизм слущивания отвечает за распространение вируса из верхних дыхательных путей в нижние.[2] Инфекция вызывает генерализованное воспаление в легких, включая миграцию и инфильтрацию воспалительных клеток (таких как моноциты и Т-клетки), некроз эпителиальной клеточной стенки, отек, и увеличение слизистой.[9] Воспаление и повреждение клеток чаще носят очаговый, чем диффузный характер.[9] Вместе отшелушившиеся эпителиальные клетки, слизистые пробки и накопленные иммунные клетки вызывают обструкцию нижних дыхательных путей.[9][2]
Диагностика
Лабораторная диагностика
Для диагностики инфекции RSV доступны различные лабораторные тесты. Хотя Американская академия педиатрии (AAP) обычно не рекомендует использовать лабораторные анализы для диагностики бронхиолита, вызванного RSV (лечение которого в значительной степени является поддерживающим),[26] подтверждение инфекции RSV может быть оправдано в группах высокого риска, если результат будет определять клинические решения. Общие методы идентификации включают тестирование на антиген, молекулярное тестирование и вирусный посев.[9]
Тест на антиген
Тестирование антигена включает обнаружение RSV антиген фрагменты (или части молекулярных вирусных структур), обычно из носоглоточный мазок или аспирация. Этого можно добиться, рассматривая флуоресцентно меченые антигены под микроскопом (прямой флуоресцентный анализ, или DFA) или используя коммерчески доступный экспресс-тест на определение антигена (РАДТ).[9] В целом, тестирование на антигены высоко чувствительный у детей раннего возраста (80-90%), но значительно менее надежен у детей старшего возраста и взрослых, у которых меньше вирусного выделения.[9] Тесты на антигены также подвержены более высокому уровню ложноположительных результатов за пределами пикового сезона RSV, например, в летние месяцы. В этих сценариях использование вирусной культуры или тестирования амплификации нуклеиновых кислот (NAAT) может помочь в точной диагностике RSV.[нужна цитата]
- Экспресс-тесты на обнаружение антигенов (RADT) обычно используются как тестирование в месте оказания медицинской помощи благодаря простоте использования и быстрому выполнению работ (всего 10 минут). К ним относятся как иммуноферментные анализы (EIA) и хроматографический иммуноанализы (CIA).[9][27]
- Прямой флуоресцентный анализ (DFA) позволяет проводить прямое микроскопическое исследование инфицированных вирусом клеток. В чувствительность DFA тестирования зависит от адекватного образца.[27]
Молекулярное тестирование
Молекулярные анализы, такие как тесты амплификации нуклеиновых кислот (NAAT), обеспечивают чувствительное обнаружение очень малых количеств вируса в мазки из носоглотки и аспирирует. Анализы NAAT, такие как полимеразная цепная реакция (ПЦР), выявляют вирус-специфический генетический материал, а не вирусные антигены. У них есть чувствительность и специфичность приближается к 100%.[28] Однако они, как правило, более дороги и требуют более сложного оборудования, чем другие методы тестирования, что делает их менее практичными в областях с ограниченными ресурсами.
- Полимеразной цепной реакции (ПЦР) - это тип NAAT, который позволяет быстро преобразовать очень небольшой образец генетического материала в миллионы копий для исследования. ПЦР более чувствительна, чем тестирование на антиген или вирусный посев.[28] Следовательно, его можно использовать для обнаружения вируса у лиц с более низким уровнем вирусного выделения, например у детей старшего возраста и взрослых. Его также можно использовать для более раннего выявления заболевания у лиц из группы риска (например, госпитализированных пациентов или пациентов с ослабленным иммунитетом), когда вирусная нагрузка все еще может быть слишком низкой, чтобы ее можно было идентифицировать традиционными методами. Из-за своей чувствительности ПЦР также может часто обнаруживать бессимптомных носителей и может оставаться положительным даже через несколько дней после клинического исчезновения инфекции.[9][28]
- Панели с несколькими патогенами также доступны, которые могут обнаруживать наличие нескольких вирусных инфекций (включая RSV) у одного пациента.[9]
Вирусная культура
В традиционных вирусная культура, образец вируса вводится в разные Сотовые линии и разрешено копировать, чтобы его можно было изучить. Преимущества этого метода включают в себя возможность проводить генетическую характеристику, типирование штаммов и тестирование на чувствительность к противовирусным препаратам. Однако он ограничен длительным периодом обработки, составляющим 3–7 дней, что делает его менее распространенным при лечении пациентов и более распространенным в исследовательских учреждениях.[9]
Серологическое тестирование
Серология (измерение специфичных для вирусов антитела в сыворотка) не часто используется в диагностике RSV. Время, необходимое организму для выработки значительного серологического ответа (и демонстрации значительного повышения уровня антител, которые могут быть обнаружены в сыворотке), обычно не используется при оказании помощи пациенту.[2] До 30% пациентов с документами на РСВ-инфекцию будут иметь отрицательные результаты серологического исследования.[28] Таким образом, этот метод обычно предназначен для исследовательских и надзорных исследований.[2]
Результаты визуализации
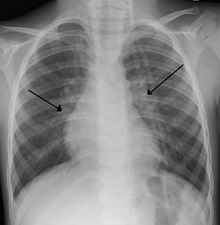
Результаты рентгенологического исследования грудной клетки у детей с бронхиолитом, вызванным RSV, как правило, неспецифичны и включают: перихилярный отметины, неоднородная гиперинфляция и ателектаз.[8] Тем не менее Американская академия педиатрии (AAP) не рекомендует рутинное обследование детей с предполагаемым РСВ. бронхиолит потому что это не меняет клинических исходов и связано с повышенным использованием антибиотиков.[8][26] Рентген грудной клетки иногда рассматривается, когда диагноз бронхиолита неясен или когда наблюдается неожиданное ухудшение.[26] У взрослых с инфекцией RSV снимки грудной клетки часто нормальны или демонстрируют неспецифические изменения, соответствующие вирусная пневмония, такие как пятнистые двусторонние инфильтраты.[29]
Дифференциальная диагностика
Дифференциальный диагноз для лиц с признаками и симптомами инфекции верхних и нижних дыхательных путей включает другие вирусные инфекции (например, риновирус, метапневмовирус, и грипп) и первичный бактериальная пневмония. У детей вдыхаемые инородные тела и врожденные состояния, такие как кистозный фиброз или астма также следует учитывать.[9]
Профилактика
Общие меры профилактики
Основная мера профилактики - избегать тесного контакта с инфицированными людьми. В общественных местах и в детских садах осторожно мытье рук может помочь уменьшить передачу. В больничных условиях строгое соблюдение мер инфекционного контроля может помочь предотвратить распространение RSV среди лиц из группы высокого риска. Для дезинфекции рук рекомендуются дезинфицирующие средства на спиртовой основе.[26]
Иммунопрофилактика
Хотя в настоящее время вакцины против RSV нет, пассивная иммунизация доступен для предотвращения инфицирования RSV и госпитализации младенцев из группы высокого риска. Исторически специфично для RSV внутривенный иммуноглобин (ВВИГ) использовался для обеспечения пассивного иммунитета. Это включало ежемесячное введение RSV-нейтрализатора. антитела (или иммуноглобины) от доноров-людей, выздоравливающих после болезни. Хотя этот перенос антител был достаточно эффективным для обеспечения краткосрочной иммунизации младенцев из группы риска, он был ограничен как его внутривенный администрирование и стоимость.[30]
RSV-IVIG был с тех пор заменен использованием моноклональное антитело (MAb), который может быть доставлен через мышечная инъекция. Хотя для профилактики RSV было разработано несколько моноклональных антител, наиболее успешными из них были Паливизумаб (торговая марка Synagis). Паливизумаб представляет собой моноклональное антитело, направленное против поверхностного слитого (F) белка вируса RSV. Он был лицензирован в 1998 году и эффективен для обеспечения временной профилактики как против RSV A, так и против RSV. Он вводится в виде ежемесячных инъекций, которые начинаются непосредственно перед сезоном RSV и обычно продолжаются в течение пяти месяцев. Было показано, что паливизумаб снижает как частоту госпитализаций, так и общую смертность в определенных группах детей высокого риска (например, с хроническими заболеваниями легких, врожденными пороками сердца и недоношенными).[24][31] Однако его стоимость ограничивает его использование во многих частях мира. С тех пор были разработаны более сильнодействующие производные этого антитела (включая мотавизумаб), но были связаны со значительными побочными эффектами.[32]
Американская академия педиатрии (AAP 2014) рекомендует профилактику RSV с помощью паливизумаба во время сезона RSV для:[26]
- Младенцы, родившиеся в сроке ≤28 недель 6 дней гестационный возраст и <12 месяцев в начале сезона RSV
- Младенцы <12 месяцев с хроническое заболевание легких недоношенных
- Младенцы младше 12 месяцев с гемодинамически значимыми врожденный порок сердца
- Младенцы <24 месяцев с хроническим заболеванием легких недоношенных, требующие медикаментозного лечения
Согласно рекомендациям AAP, профилактика паливизумабом также может быть рассмотрена у младенцев с:[26]
- Врожденный нарушение дыхательных путей
- Нервно-мышечное расстройство
- Кистозный фиброз
- Суровый иммунодефицит
- Недавние или предстоящие трансплантация сердца
Вакцина
В настоящее время нет лицензионных вакцина для предотвращения заражения RSV. Открытие вакцины против RSV вызвало огромный интерес и исследования, учитывая значительную значимость вируса. бремя болезни и относительное отсутствие методов лечения конкретных заболеваний. Однако разработка вакцины столкнулась со значительными препятствиями, которые заблокировали ее прогресс. Среди них - специфические для младенца факторы, такие как иммунная система незрелого младенца и наличие материнские антитела, которые делают инфантильные иммунизация трудно.[9]
Попытки разработать вакцину против RSV начались в 1960-х годах. формалин-инактивированная вакцина который был разработан для младенцев и детей. Хотя аналогичный метод был использован для создания безопасного и эффективного вакцина против полиовирусаэта вакцина привела к опасному явлению, которое стало известно как «усиленное респираторное заболевание, связанное с вакциной» (VAERD). В VAERD у вакцинированных младенцев развивалось значительно более тяжелое респираторное заболевание, чем у невакцинированных младенцев во время последующей естественной инфекции. Около 80% таких детей (по сравнению с 5% контрольной группы, подвергшейся воздействию вируса) были госпитализированы, причем два случая привели к смерти. Эта катастрофа привела к крайней осторожности и препятствовала разработке вакцин на многие годы вперед.[9][30]
В документе 2019 года утверждается, что исследования в области разработки вакцин значительно продвинулись за предыдущие 5–10 лет, и более 30 кандидатов находятся на той или иной стадии разработки.[5] В том же исследовании было предсказано, что вакцина будет доступна в течение 10 лет. Типы вакцин, которые в настоящее время исследуются, делятся на четыре широкие категории: живо-ослабленный, субъединица белка, векторный, и на основе частиц.Каждый из них нацелен на разные иммунные реакции и, следовательно, может лучше подходить для предотвращения заболеваний в разных группах риска. Живо-ослабленный вакцины показали некоторый успех у младенцев, не получавших РСВ. Другие кандидаты на вакцины надеются охватить уязвимые группы населения на протяжении всей жизни, включая беременных женщин и пожилых людей.[9][5]
Уход
Поддерживающая терапия
Лечение RSV-инфекции в первую очередь направлено на поддерживающую терапию. Это может включать наблюдение за дыханием пациента или использование аспирации для удаления выделений из верхних дыхательных путей. Дополнительный кислород также может быть доставлен через носовая канюля или маска для лица для улучшения воздушного потока. В тяжелых случаях нарушение дыхания, интубация и механическая вентиляция может потребоваться для поддержки дыхания. Если присутствуют признаки обезвоживания, жидкости также можно вводить перорально или через капельницу.[30]
Дополнительные поддерживающие методы лечения были исследованы специально для младенцев, госпитализированных с RSV. бронхиолит. К ним относятся следующие:
- Распыленный гипертонический раствор было показано, что он сокращает продолжительность госпитализации и снижает клиническую тяжесть у младенцев с вирусным бронхиолитом. Считается, что это лечение может помочь, уменьшив отек дыхательных путей и закупорку слизи, чтобы уменьшить обструкцию дыхательных путей.[33][34][нуждается в обновлении]
- Heliox, смесь кислорода с газообразным гелием, может уменьшить респираторный дистресс в течение первого часа после начала лечения. Он работает за счет уменьшения сопротивления дыхательных путей и уменьшения работы дыхания. Однако не было показано, что это влияет на общие исходы болезни.[35]
- Физиотерапия грудной клетки имеет нет было обнаружено, что он снижает тяжесть заболевания и обычно не рекомендуется.[36]
- Вдыхал рекомбинантный человеческий дезоксирибонуклеаза (рчДНаза), фермент, который переваривает ДНК, которая способствует закупорке слизи и обструкции дыхательных путей. нет было показано улучшение клинических результатов в этой группе.[37]
Вирусоспецифическая терапия
- Рибавирин единственный противовирусное средство лицензированный в настоящее время препарат для лечения РСВ у детей. Это гуанозин аналог, который действует путем ингибирования вирусных Синтез РНК и укупорка. Первоначально он был одобрен в 1986 году для лечения RSV-инфекции. Тем не менее, использование рибавирина остается спорным из-за неясных данных об эффективности, опасений по поводу токсичности для сотрудников, подвергшихся воздействию, а также стоимости.[38][6] Таким образом, в большинстве современных руководств не содержится конкретных рекомендаций относительно его использования у детей. У взрослых рибавирин используется не по лицензии и, как правило, предназначен для лиц с тяжелым иммунодефицитом, таких как пациенты, проходящие лечение. трансплантаты гемопоэтических стволовых клеток.[9]
- Пресатовир, экспериментальный противовирусное средство препарат, показал многообещающие результаты в клинические испытания но еще не одобрен для медицинского использования. Он действует как ингибитор слияния, подавляя белок F RSV.[39]
- Иммуноглобиныкак специфические, так и неспецифические, специфичные для RSV, исторически использовались для лечения заболеваний, связанных с RSV. Однако в настоящее время недостаточные доказательства для поддержки использования иммуноглобинов у детей с инфекцией RSV.[40]
Противовоспалительные средства
- Кортикостероиды (системный или ингаляционный) нет Было обнаружено, что при вирусном бронхиолите сокращается продолжительность госпитализации или тяжесть заболевания.[41] Их использование также может продлить вирусное выделение , поэтому обычно не рекомендуется. Однако использование пероральных кортикостероидов остается обычным явлением у взрослых с обострением основного заболевания легких, вызванным РСВ.[9]
- Ингибиторы лейкотриенов такие как Монтелукаст использовались при лечении младенцев и детей с бронхиолитами. Однако доказательства, подтверждающие их использование, остаются несовместимыми с нет окончательных выводов по их эффективности.[42]
Бронходилататоры
Бронходилататоры, лекарства, обычно используемые для лечения астма, иногда используются для лечения хрипы связано с инфекцией RSV. Эти лекарства (например, альбутерол или сальбутамол) находятся бета-агонисты расслабляют мышцы дыхательных путей, улучшая циркуляцию воздуха. Однако у бронходилататоров есть нет было обнаружено, что улучшает клиническую тяжесть инфекции или частоту госпитализаций среди людей с инфекцией RSV. Учитывая их ограниченную выгоду, плюс их неблагоприятное событие профиль, они обычно не рекомендуются для использования при бронхиолите, вызванном RSV.[41][30]
Антибиотики
Антибактериальная терапия является нет подходит для лечения бронхиолита, связанного с RSV, или вирусной пневмонии.[43] Цель антибиотиков бактериальный патогены, а не популярный возбудители, такие как RSV. Однако можно рассмотреть вопрос о приеме антибиотиков, если есть четкие доказательства развития вторичной бактериальной инфекции. Инфекции уха может также развиться у небольшого числа младенцев с бронхиолитом, вызванным RSV, и в этом случае иногда могут использоваться пероральные антибиотики.[30]
Эпидемиология
Младенцы и дети
Во всем мире RSV является ведущей причиной бронхиолит и пневмония у младенцев и детей в возрасте до 5 лет. Риск серьезного инфицирования наиболее высок в течение первых 6 месяцев жизни. У 2–3% инфицированных RSV разовьется бронхиолит, что потребует госпитализации.[44] Ежегодно во всем мире RSV вызывает около 30 миллионов острых респираторных заболеваний и более 60 000 детских смертей. По оценкам, 87% младенцев переживут инфекцию RSV к возрасту 18 месяцев, и почти все дети будут инфицированы к 3 годам. В Соединенных Штатах на RSV приходится до 20% госпитализаций детей в возрасте до 5 лет с острыми респираторными инфекциями. Однако подавляющее большинство смертей, связанных с RSV, происходит в странах с низким уровнем дохода, которые не имеют доступа к базовой поддерживающей помощи.[9]
Взрослые
У здоровых молодых людей редко развивается тяжелое заболевание, требующее госпитализации из-за RSV. Однако в настоящее время он признан серьезной причиной заболеваемости и смертности среди некоторых взрослых групп населения, таких как пожилые люди и люди с сопутствующими заболеваниями сердца или легких. У пожилых людей наблюдается аналогичная бремя болезни к грипп. Ежегодно примерно 5-10% жителей домов престарелых заражаются RSV, что приводит к значительным показателям пневмонии и смерти. RSV также отвечает за 2-5% взрослых внебольничные пневмонии.[15]
С ослабленным иммунитетом
И у взрослых, и у детей иммуносупрессия увеличивает восприимчивость к инфекции RSV. Дети, живущие с ВИЧ имеют более высокую вероятность развития острого заболевания и в 3,5 раза чаще нуждаются в госпитализации, чем дети без ВИЧ.[9] Пересадка костного мозга Пациенты до приживления костного мозга подвергаются особенно высокому риску: на RSV приходится почти половина вирусных инфекций в этой популяции. Эта группа также продемонстрировала уровень смертности до 80% среди людей с пневмонией, вызванной RSV.[15] Хотя инфекция может происходить внутри сообщества, считается, что внутрибольничная инфекция составляет 30-50% случаев среди лиц с ослабленным иммунитетом.[15]
Сезонность
Сезонность RSV варьируется по всему миру. В умеренный климат, уровень инфицирования, как правило, наиболее высок в холодные зимние месяцы. Это часто объясняется повышенной скученностью в помещении и повышенной вирусной стабильностью при более низких температурах. Однако в тропическом и арктическом климате годовые колебания менее четко определены и, по-видимому, более распространены в сезон дождей.[9][2] Ежегодные эпидемии обычно вызваны наличием нескольких различных штаммов вирусов. Вирусы подтипа A и B часто циркулируют одновременно в определенном географическом регионе, хотя вирусы группы A более распространены.[15]
История
RSV был впервые обнаружен в 1956 году, когда Моррис, Блаунт и Сэвидж выделили вирус из популяции шимпанзе при респираторных заболеваниях. Они назвали вирус CCA (Агент ринита шимпанзе),[45] хотя позже выяснилось, что шимпанзе заразились от своих опекунов. В 1957 году этот же вирус был идентифицирован Роберт М. Чанок у детей с респираторными заболеваниями.[46] Исследования человека антитела у младенцев и детей выявлено, что инфекция была распространена в раннем возрасте.[47] Позднее вирус был переименован в ортопневмовирус человека или респираторно-синцитиальный вирус человека (hRSV).[нужна цитата]
Несколько других пневмовирусы существуют, которые очень похожи на hRSV. Наиболее заметным из них является бык RSV (bRSV), на долю которого приходится примерно 80% геном с hRSV. Он также разделяет предрасположенность hRSV к молодняку, вызывая более тяжелое заболевание у телят младше 6 месяцев. Поскольку телята, инфицированные bRSV, имеют почти идентичные проявления с детьми, инфицированными hRSV, это оказалось важным модель животных в исследовании RSV.[7]
Смотрите также
- Роберт М. Чанок, первооткрыватель респираторно-синцитиального вируса человека
- Метапневмовирус, другой род близкородственных вирусов
- Ортопневмовирус, род родственных синцитиальных вирусов
- Паливизумаб, моноклональные антитела, используемые для профилактики RSV
Рекомендации
- ^ "История таксономии ICTV: Ортопневмовирус человека". Международный комитет по таксономии вирусов (ICTV). Получено 27 декабря 2018.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа Гриффитс С., Дрюс С.Дж., Марчант ди-джей (январь 2017 г.). «Респираторно-синцитиальный вирус: инфекция, обнаружение и новые возможности профилактики и лечения». Обзоры клинической микробиологии. 30 (1): 277–319. Дои:10.1128 / CMR.00010-16. ЧВК 5217795. PMID 27903593.
- ^ а б Джа А., Джарвис Х, Фрейзер С., Openshaw PJ (2016). Хуэй Д.С., Росси Г.А., Джонстон С.Л. (ред.). Респираторно-синцитиальный вирус. SARS, MERS и другие вирусные инфекции легких. Монографии и главы книг, финансируемые фондом Wellcome Trust. Шеффилд (Великобритания): Европейское респираторное общество. ISBN 978-1-84984-070-5. PMID 28742304. Получено 2020-10-29.
- ^ а б c d е ж грамм час я j k л м п о п q р Култас Дж. А., Смит Р., Openshaw PJ (октябрь 2019 г.). «Респираторно-синцитиальный вирус (RSV): бич от младенчества до старости». Грудная клетка. 74 (10): 986–993. Дои:10.1136 / thoraxjnl-2018-212212. PMID 31383776. S2CID 199449874.
- ^ а б c Battles MB, McLellan JS (апрель 2019 г.). «Попадание респираторно-синцитиального вируса и способы его блокирования». Обзоры природы. Микробиология. 17 (4): 233–245. Дои:10.1038 / с41579-019-0149-х. ЧВК 7096974. PMID 30723301.
- ^ а б Simões EA, DeVincenzo JP, Boeckh M, Bont L, Crowe JE, Griffiths P и др. (Март 2015 г.). «Проблемы и возможности в разработке терапевтических средств против респираторно-синцитиального вируса». Журнал инфекционных болезней. 211 Прил. 1 (Прил. 1): S1 – S20. Дои:10.1093 / infdis / jiu828. ЧВК 4345819. PMID 25713060.
- ^ а б c d е ж грамм Борчерс А.Т., Чанг С., Гершвин М.Э., Гершвин Л.Дж. (декабрь 2013 г.). «Респираторно-синцитиальный вирус - всесторонний обзор». Клинические обзоры по аллергии и иммунологии. 45 (3): 331–79. Дои:10.1007 / s12016-013-8368-9. ЧВК 7090643. PMID 23575961.
- ^ а б c d е ж Смит Д.К., Силз С., Будзик С. (январь 2017 г.). «Респираторно-синцитиальный вирусный бронхиолит у детей». Американский семейный врач. 95 (2): 94–99. PMID 28084708.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар Джа А., Джарвис Х, Фрейзер С., Openshaw PJ (2016). Хуэй Д.С., Росси Г.А., Джонстон С.Л. (ред.). Респираторно-синцитиальный вирус. SARS, MERS и другие вирусные инфекции легких. Монографии и главы книг, финансируемые фондом Wellcome Trust. Шеффилд (Великобритания): Европейское респираторное общество. ISBN 978-1-84984-070-5. PMID 28742304. Получено 2020-10-29.
- ^ Лонг СС, Брэди М.Т., Джексон Массачусетс, Кимберлин Д.В. Красная книга: отчет Комитета по инфекционным болезням за 2018-2021 гг. (Тридцать первое изд.). Деревня Элк Гроув, штат Иллинойс. ISBN 978-1-61002-147-0. OCLC 1035556489.
- ^ а б Фридман Дж. Н., Ридер М. Дж., Уолтон Дж. М. (ноябрь 2014 г.). «Бронхиолит: рекомендации по диагностике, мониторингу и ведению детей в возрасте от 1 до 24 месяцев». Педиатрия и здоровье детей. 19 (9): 485–98. Дои:10.1093 / пч / 19.9.485. ЧВК 4235450. PMID 25414585.
- ^ "RSV | Симптомы и лечение | Респираторно-синцитиальный вирус | CDC". www.cdc.gov. 2019-02-04. Получено 2020-10-28.
- ^ а б Хиджано Д.Р., Марон Г., Хайден Р.Т. (декабрь 2018 г.). «Респираторные вирусные инфекции у больных раком или перенесших трансплантацию гемопоэтических клеток». Границы микробиологии. 9: 3097. Дои:10.3389 / fmicb.2018.03097. ЧВК 6299032. PMID 30619176.
- ^ Уолш Э.Е. (март 2017 г.). «Респираторно-синцитиальная вирусная инфекция: болезнь для всех возрастов». Клиники грудной медицины. 38 (1): 29–36. Дои:10.1016 / j.ccm.2016.11.010. ЧВК 5844562. PMID 28159159.
- ^ а б c d е ж грамм час Фалси А. Р., Уолш Э. Э. (июль 2000 г.). «Респираторно-синцитиальная вирусная инфекция у взрослых». Обзоры клинической микробиологии. 13 (3): 371–84. Дои:10.1128 / см 13.3.371-384.2000. ЧВК 88938. PMID 10885982.
- ^ Джартти Т., Герн Дж. Э. (октябрь 2017 г.). «Роль вирусных инфекций в развитии и обострении астмы у детей». Журнал аллергии и клинической иммунологии. 140 (4): 895–906. Дои:10.1016 / j.jaci.2017.08.003. ЧВК 7172811. PMID 28987219.
- ^ Кастро-Родригес Х.А., Форно Э., Родригес-Мартинес CE, Селедон JC (2016). "Риск и защитные факторы детской астмы: каковы доказательства?". Журнал аллергии и клинической иммунологии. На практике. 4 (6): 1111–1122. Дои:10.1016 / j.jaip.2016.05.003. ЧВК 5107168. PMID 27286779.
- ^ Ши Т., Бальселлс Э., Вастнедж Э., Синглтон Р., Расмуссен З.А., Зар Х.Дж. и др. (Декабрь 2015 г.). «Факторы риска респираторно-синцитиального вируса, связанного с острой инфекцией нижних дыхательных путей у детей до пяти лет: систематический обзор и метаанализ». Журнал глобального здравоохранения. 5 (2): 020416. Дои:10.7189 / jogh.05.020416. ЧВК 4676580. PMID 26682048.
- ^ Хаваджа Ф., Чемалы РФ (июль 2019 г.). «Респираторно-синцитиальный вирус у реципиентов трансплантата гемопоэтических клеток и пациентов с гематологическими злокачественными новообразованиями». Haematologica. 104 (7): 1322–1331. Дои:10.3324 / haematol.2018.215152. ЧВК 6601091. PMID 31221784.
- ^ "Респираторно-синцитиальный вирус | Руководство по ABX Джонса Хопкинса". www.hopkinsguides.com. Получено 2020-10-29.
- ^ «Род: Orthopneumovirus - Pneumoviridae - Вирусы с отрицательной РНК». Международный комитет по таксономии вирусов (ICTV). Получено 2020-10-29.
- ^ а б Каутон В.М., МакГиверн Д.Р., Фернс Р. (июль 2006 г.). «Раскрытие сложностей синтеза РНК респираторно-синцитиального вируса». Журнал общей вирусологии. 87 (Pt 7): 1805–1821. Дои:10.1099 / vir.0.81786-0. PMID 16760383.
- ^ а б c d е ж грамм час я Коллинз П.Л., Фирнс Р., Грэм Б.С. (2013). «Респираторно-синцитиальный вирус: вирусология, обратная генетика и патогенез заболевания». Актуальные темы микробиологии и иммунологии. 372: 3–38. Дои:10.1007/978-3-642-38919-1_1. ISBN 978-3-642-38918-4. ЧВК 4794264. PMID 24362682.
- ^ а б c Drysdale SB, Green CA, Sande CJ (апрель 2016 г.). «Передовой опыт профилактики и лечения респираторно-синцитиальной вирусной инфекции у детей». Терапевтические достижения при инфекционных заболеваниях. 3 (2): 63–71. Дои:10.1177/2049936116630243. ЧВК 4784570. PMID 27034777.
- ^ а б "RSV | Передача и профилактика | Респираторно-синцитиальный вирус | CDC". www.cdc.gov. 2019-02-04. Получено 2020-11-09.
- ^ а б c d е ж Ralston SL, Lieberthal AS, Meissner HC, Alverson BK, Baley JE, Gadomski AM и др. (Ноябрь 2014 г.). «Руководство по клинической практике: диагностика, лечение и профилактика бронхиолита». Педиатрия. 134 (5): e1474-502. Дои:10.1542 / пед.2014-2742. PMID 25349312. S2CID 3192188.
- ^ а б Zhang N, Wang L, Deng X, Liang R, Su M, He C и др. (Апрель 2020 г.). «Последние достижения в обнаружении респираторных вирусных инфекций у людей». Журнал медицинской вирусологии. 92 (4): 408–417. Дои:10.1002 / jmv.25674. ЧВК 7166954. PMID 31944312.
- ^ а б c d Хенриксон К.Дж., Холл CB (ноябрь 2007 г.). «Диагностические тесты респираторно-синцитиального вируса». Журнал детских инфекционных болезней. 26 (11 Прил.): S36-40. Дои:10.1097 / INF.0b013e318157da6f. PMID 18090198. S2CID 205692472.
- ^ Чиен Дж. У., Джонсон Дж. Л. (март 2000 г.). «Вирусные пневмонии. Эпидемические респираторные вирусы». Последипломная медицина. 107 (3): 41–2, 45–7, 51–2. Дои:10,3810 / пгм. 2000.03.941. PMID 10728134. S2CID 33643168.
- ^ а б c d е Каслоу Р.А., Стэнберри Л.Р., Ледюк Дж.В. (2014). Вирусные инфекции человека: эпидемиология и контроль (Пятое изд.). Нью-Йорк: Спрингер. С. 601–610. ISBN 978-1-4899-7448-8. OCLC 891646285.
- ^ Андабака Т., Никерсон Дж. В., Рохас-Рейес МХ, Руэда Дж. Д., Бачич Врка V, Барсич Б. (апрель 2013 г.). «Моноклональные антитела для снижения риска респираторно-синцитиальной вирусной инфекции у детей». Кокрановская база данных систематических обзоров (4): CD006602. Дои:10.1002 / 14651858.CD006602.pub4. PMID 23633336.
- ^ Ярес Багливо S, Polack FP (2019-05-02). «Долгий путь к защите младенцев от тяжелого заболевания нижних дыхательных путей, вызванного RSV». F1000 Исследования. 8: 610. Дои:10.12688 / f1000research.18749.1. ЧВК 6498742. PMID 31105933.
- ^ Ван З.Й., Ли XD, Сунь А.Л., Фу XQ (август 2019 г.). «Эффективность 3% гипертонического раствора при бронхиолите: метаанализ». Экспериментальная и лечебная медицина. 18 (2): 1338–1344. Дои:10.3892 / etm.2019.7684. ЧВК 6639771. PMID 31384334.
- ^ Zhang L, Mendoza-Sassi RA, Wainwright C, Klassen TP, et al. (Кокрановское сотрудничество) (октябрь 2008 г.). Чжан Л. (ред.). «Небулизированный гипертонический физиологический раствор при остром бронхиолите у младенцев». Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd (4): CD006458. Дои:10.1002 / 14651858.cd006458.pub2. PMID 18843717.
- ^ Liet JM, Ducruet T, Gupta V, Cambonie G и др. (Кокрановская группа по острым респираторным инфекциям) (сентябрь 2015 г.). «Ингаляционная терапия гелиоксом при бронхиолите у младенцев». Кокрановская база данных систематических обзоров (9): CD006915. Дои:10.1002 / 14651858.CD006915.pub3. PMID 26384333.
- ^ Роке-и-Фигульс М., Жине-Гаррига М., Гранадос Ругелес С., Перротта С., Виларо Дж. (Февраль 2016 г.). «Физиотерапия грудной клетки при остром бронхиолите у детей в возрасте от 0 до 24 месяцев». Кокрановская база данных систематических обзоров. 2: CD004873. Дои:10.1002 / 14651858.cd004873.pub5. ЧВК 6458017. PMID 26833493.
- ^ Энрикес А., Чу И.В., Меллис С., Лин В.Й. и др. (Кокрановская группа по острым респираторным инфекциям) (ноябрь 2012 г.). «Распыленная дезоксирибонуклеаза при вирусном бронхиолите у детей младше 24 месяцев». Кокрановская база данных систематических обзоров. 11: CD008395. Дои:10.1002 / 14651858.CD008395.pub2. ЧВК 7388903. PMID 23152257.
- ^ Ventre K, Randolph AG (январь 2007 г.). Вентр К. (ред.). «Рибавирин при респираторно-синцитиальной вирусной инфекции нижних дыхательных путей у младенцев и детей младшего возраста». Кокрановская база данных систематических обзоров (1): CD000181. Дои:10.1002 / 14651858.CD000181.pub3. PMID 17253446.
- ^ Бейгель Дж. Х., Нам Х. Х., Адамс П. Л., Краффт А., Инс В. Л., Эль-Камари С. С., Симс АС. Достижения в терапии респираторных вирусов - отчет о заседании 6-й конференции ISIRV Antiviral Group. Противовирусный Res. 2019 июль; 167: 45-67. PMID 30974127 Дои:10.1016 / j.antiviral.2019.04.006
- ^ Сандерс С.Л., Агван С., Хассан М., ван Дриел М.Л., Дель Мар CB и др. (Кокрановская группа по острым респираторным инфекциям) (август 2019 г.). «Лечение иммуноглобулином для госпитализированных младенцев и детей раннего возраста с респираторно-синцитиальной вирусной инфекцией». Кокрановская база данных систематических обзоров. 8: CD009417. Дои:10.1002 / 14651858.CD009417.pub2. ЧВК 6708604. PMID 31446622.
- ^ а б Гадомский AM, Скрибани МБ (июнь 2014 г.). «Бронходилататоры при бронхиолите». Кокрановская база данных систематических обзоров. 2014 (6): CD001266. Дои:10.1002 / 14651858.CD001266.pub4. ЧВК 7055016. PMID 24937099.
- ^ Лю Ф, Оуян Дж., Шарма А.Н., Лю С., Ян Б., Сюн В., Сюй Р. (март 2015 г.). «Ингибиторы лейкотриенов при бронхиолите у детей грудного и раннего возраста». Кокрановская база данных систематических обзоров (3): CD010636. Дои:10.1002 / 14651858.cd010636.pub2. PMID 25773054.
- ^ Фарли Р., Сперлинг Г. К., Эрикссон Л., Дель Мар С. Б. и др. (Кокрановская группа по острым респираторным инфекциям) (октябрь 2014 г.). «Антибиотики при бронхиолите у детей до двух лет». Кокрановская база данных систематических обзоров (10): CD005189. Дои:10.1002 / 14651858.CD005189.pub4. PMID 25300167.
- ^ Hall CB, Weinberg GA, Iwane MK, Blumkin AK, Edwards KM, Staat MA, et al. (Февраль 2009 г.). «Бремя респираторно-синцитиальной вирусной инфекции у детей младшего возраста». Медицинский журнал Новой Англии. 360 (6): 588–98. Дои:10.1056 / NEJMoa0804877. ЧВК 4829966. PMID 19196675.
- ^ Блаунт Р. Э., Моррис Дж. А., Сэвидж Р. Р. (июль 1956 г.). «Извлечение цитопатогенного агента от шимпанзе с ринитом». Труды Общества экспериментальной биологии и медицины. Общество экспериментальной биологии и медицины. 92 (3): 544–9. Дои:10.3181/00379727-92-22538. PMID 13359460. S2CID 29764422.
- ^ Чанок Р., Ройзман Б., Майерс Р. (ноябрь 1957 г.). «Восстановление от младенцев с респираторным заболеванием вируса, связанного с возбудителем ринита шимпанзе (CCA). I. Выделение, свойства и характеристика». Американский журнал гигиены. 66 (3): 281–90. Дои:10.1093 / oxfordjournals.aje.a119901. PMID 13478578. S2CID 4529751.
- ^ Чанок Р., Финберг Л. (ноябрь 1957 г.). «Выздоровление у младенцев с респираторным заболеванием от вируса, связанного с возбудителем ринита шимпанзе (CCA). II. Эпидемиологические аспекты инфекции у младенцев и детей младшего возраста». Американский журнал гигиены. 66 (3): 291–300. Дои:10.1093 / oxfordjournals.aje.a119902. PMID 13478579.
| Классификация | |
|---|---|
| Внешние ресурсы |