WikiDer > Карбонат кальция - Википедия
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Карбонат кальция | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.006.765 | ||
| Номер ЕС |
| ||
| Номер E | E170 (цвета) | ||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CaCO3 | |||
| Молярная масса | 123,0869 г / моль | ||
| Внешность | Мелкий белый порошок; меловой вкус | ||
| Запах | без запаха | ||
| Плотность | 2,711 г / см3 (кальцит) 2,83 г / см3 (арагонит) | ||
| Температура плавления | 1339 ° С (2442 ° F, 1612 К) (кальцит) 825 ° С (1517 ° F, 1098 К) (арагонит)[4][5] | ||
| Точка кипения | разлагается | ||
| 0,013 г / л (25 ° С)[1][2] | |||
Продукт растворимости (Kзр) | 3.3×10−9[3] | ||
| Растворимость в разбавленных кислотах | растворимый | ||
| Кислотность (пKа) | 9.0 | ||
| −3.82×10−5 см3/ моль | |||
| 1.59 | |||
| Структура | |||
| Тригональный | |||
| 32 / м | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 93 Дж · моль−1· K−1[6] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1207 кДж · моль−1[6] | ||
| Фармакология | |||
| A02AC01 (ВОЗ) A12AA04 (ВОЗ) | |||
| Опасности | |||
| Паспорт безопасности | ICSC 1193 | ||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза) | 6450 мг / кг (перорально, крыса) | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 15 мг / м3 (всего) TWA 5 мг / м3 (соответственно)[7] | ||
| Родственные соединения | |||
Другой анионы | Бикарбонат кальция | ||
Другой катионы | Карбонат магния Карбонат стронция Карбонат бария | ||
Родственные соединения | Сульфат кальция | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Карбонат кальция это химическое соединение с формула CaCO3. Это обычное вещество, которое содержится в горные породы как минералы кальцит и арагонит (особенно как известняк, который представляет собой тип осадочной породы, состоящей в основном из кальцита) и является основным компонентом жемчуг и раковины морских организмов, улитки, и яйца. Карбонат кальция является активным ингредиентом в сельскохозяйственная известь и создается, когда ионы кальция в жесткая вода реагировать с карбонат-ионы создавать известковый налет. В медицине используется как кальций дополнение или как антацид, но чрезмерное употребление может быть опасным и вызвать плохое пищеварение. Карбонат кальция содержит самое большое количество элементарного кальция (40%) среди всех, к тому же он дешев. Может быть связан легкий запор, метеоризм и вздутие живота. Карбонат кальция хорошо всасывается в присутствии желудочного сока, поэтому его следует принимать с пищей, что также снижает количество жалоб. Цитрат кальция имеет 2-й по величине элементарный кальций (не железо) 21%. И он легче всасывается, поэтому его можно давать натощак.
Химия
Карбонат кальция обладает типичными свойствами других карбонатов. Примечательно это
- реагирует с кислоты, выпуская углекислый газ (технически говоря, угольная кислота, но он быстро распадается на CO2 и H2O):
- CaCO3(s) + 2 H+(водный) → Ca2+(водный) + CO2(грамм) + H2O (л)
- при нагревании выделяет углекислый газ, называемый термическое разложение реакция, или прокаливание (до более 840 ° C в случае CaCO3), чтобы сформировать оксид кальция, обычно называемый негашеная известь, с реакцией энтальпия 178 кДж / моль:
- CaCO3(s) → CaO (s) + CO2(грамм)
Карбонат кальция вступает в реакцию с водой, насыщенной диоксидом углерода, с образованием растворимого бикарбонат кальция.
- CaCO3(s) + CO2(грамм) + H2O (л) → Ca (HCO3)2(водный)
Эта реакция важна в эрозия из карбонатная порода, формируя пещеры, и приводит к жесткая вода во многих регионах.
Необычная форма карбоната кальция - гексагидрат, икаите, CaCO3· 6H2О. Икаите стабильна только при температуре ниже 8 ° C.
Подготовка
Подавляющее большинство карбоната кальция, используемого в промышленности, добывается при добыче полезных ископаемых. Чистый карбонат кальция (например, для пищевых или фармацевтических целей) может быть получен из чистого карьерного источника (обычно мрамор).
В качестве альтернативы карбонат кальция получают из оксид кальция. Вода добавляется, чтобы дать гидроксид кальция тогда углекислый газ пропускают через этот раствор для осаждения желаемого карбоната кальция, называемого в промышленности осажденным карбонатом кальция (ОКК):[8]
- CaO + H2О → Са (ОН)2
- Са (ОН)2 + CO2 → CaCO3↓ + H2О
Структура
Термодинамически стабильная форма CaCO3 при нормальных условиях это шестиугольник β-CaCO3 (минерал кальцит).[9] Могут быть приготовлены другие формы, более плотные (2,83 г / см3) ромбический λ-CaCO3 (минерал арагонит) и гексагональной μ-CaCO3, встречающийся как минерал ватерит.[9] Форма арагонита может быть получена осаждением при температуре выше 85 ° C, форма ватерита может быть получена осаждением при 60 ° C.[9] Кальцит содержит атомы кальция, координированные шестью атомами кислорода, в арагоните они координированы девятью атомами кислорода.[9] Структура ватерита до конца не изучена.[10] Карбонат магния (MgCO3) имеет структуру кальцита, тогда как карбонат стронция и карбонат бария (SrCO3 и BaCO3) принимают структуру арагонита, отражая их большую ионные радиусы.[9]
Вхождение

Геологические источники
Кальцит, арагонит и ватерит являются чистыми минералами карбоната кальция. Промышленно важные нефтематеринские породы, состоящие преимущественно из карбоната кальция, включают: известняк, мел, мрамор и травертин.
Биологические источники

Яичная скорлупа, улитка снаряды и большинство ракушки представляют собой преимущественно карбонат кальция и могут использоваться в качестве промышленных источников этого химического вещества.[12] устрица Раковины недавно получили признание как источник диетического кальция, но также являются практическим промышленным источником.[13][14] Тьма зеленые овощи Такие как брокколи и капуста содержат значительное количество карбоната кальция с пищей, однако они не могут использоваться в качестве промышленного источника.[15]
Внеземной
За пределами Земли убедительные доказательства указывают на присутствие карбоната кальция на Марс. Признаки карбоната кальция были обнаружены более чем в одном месте (особенно в Гусев и Гюйгенс кратеры). Это дает некоторые свидетельства присутствия жидкой воды в прошлом.[16][17]
Геология
Карбонат часто встречается в геологических условиях и составляет огромное количество резервуар углерода. Карбонат кальция встречается как арагонит, кальцит и доломит как важные составляющие кальциевый цикл. В карбонатные минералы образуют типы горных пород: известняк, мел, мрамор, травертин, туф, и другие.
В теплой прозрачной тропической воде кораллы более многочисленны, чем к полюсам, где вода холодная. Вклады карбоната кальция, в том числе планктон (Такие как кокколиты и планктон фораминиферы), коралловые водоросли, губки, брахиоподы, иглокожие, мшанки и моллюски, как правило, встречаются на мелководье, где больше солнечного света и фильтруемой пищи. Карбонаты холодной воды существуют в более высоких широтах, но имеют очень медленную скорость роста. В кальцификация процессы изменены закисление океана.
Где океаническая кора является подчиненный под континентальная плита осадки будут перенесены в более теплые зоны в астеносфера и литосфера. В этих условиях карбонат кальция разлагается с образованием углекислый газ которые вместе с другими газами вызывают взрывоопасные извержения вулканов.
Глубина компенсации карбоната
В глубина карбонатной компенсации (CCD) - точка в океане, где скорость осаждения карбоната кальция уравновешивается скоростью растворения из-за имеющихся условий. Глубоко в океане температура падает, а давление увеличивается. Карбонат кальция необычен тем, что его растворимость увеличивается с понижением температуры.[18] Повышение давления также увеличивает растворимость карбоната кальция. Глубина карбонатной компенсации может составлять от 4000 до 6000 метров ниже уровня моря.
Роль в тафономии
Карбонат кальция может сохранить окаменелости через перминерализация. Большинство окаменелостей позвоночных Формирование двух лекарств—А геологическая формация известен своим утконосый динозавр яйца - сохраняются CaCO3 перминерализация.[19] Этот тип сохранения позволяет сохранить высокий уровень детализации даже до микроскопического уровня. Однако это также делает образцы уязвимыми для выветривание при воздействии на поверхность.[19]
Трилобит когда-то считалось, что популяции составляли большую часть водных организмов во время Кембрийскийиз-за того, что их богатые карбонатом кальция раковины сохранялись легче, чем раковины других видов,[20] который имел чисто хитиновый снаряды.
Использует
Промышленное применение
В основном карбонат кальция используется в строительной промышленности в качестве строительного материала или известняка. совокупность для дорожного строительства, в составе цемент, или в качестве исходного материала для получения строительная известь сжигая в печь. Однако из-за выветривания, в основном вызванного кислотный дождь,[21] Карбонат кальция (в форме известняка) больше не используется в строительных целях сам по себе, а только как сырье для строительных материалов.
Карбонат кальция также используется для очистки утюг из железная руда в доменная печь. Карбонат кальцинированный на месте давать оксид кальция, что образует шлак с различными примесями и отделяется от очищенного железа.[22]
в нефтяная промышленность, карбонат кальция добавлен в буровые растворы как закупоривающий пласт и агент для герметизации корки; это также утяжелитель, который увеличивает плотность буровых растворов для контроля забойного давления. Карбонат кальция добавлен в бассейны, как pH корректор для поддержания щелочность и компенсирует кислотные свойства дезинфицирующее средство агент.[23]
Он также используется в качестве сырья в рафинирование сахара из сахарная свекла; его прокаливают в печи с антрацит производить оксид кальция и диоксид углерода. Эту негашеную известь затем гасят пресной водой для получения гидроксида кальция. приостановка для осаждения примесей в сыром соке во время карбонизация.[24]
Карбонат кальция в виде мел традиционно был основным компонентом доска мел. Однако мел современного производства в основном гипс, гидратированный сульфат кальция CaSO4· 2H2О. Карбонат кальция - главный источник выращивания Seacrete. Осажденный карбонат кальция (ОКК), предварительно диспергированный в суспензия форма, является обычным наполнителем для резиновые перчатки с целью достижения максимальной экономии материальных и производственных затрат.[25]
Карбонат кальция мелкого помола (GCC) является важным ингредиентом микропористой пленки, используемой в подгузники и некоторые строительные пленки, поскольку поры образуются вокруг частиц карбоната кальция во время изготовления пленки путем двухосного растяжения. GCC и PCC используются в качестве наполнителя в бумага потому что они дешевле чем древесное волокно. С точки зрения объема рынка GCC являются наиболее важными типами наполнителей, используемых в настоящее время.[26] Бумага для печати и письма может содержать 10–20% карбоната кальция. В Северной Америке карбонат кальция начал заменять каолин в производстве глянцевая бумага. Европа практиковала это как щелочной производство бумаги или бескислотное производство бумаги в течение нескольких десятилетий. PCC, используемый для наполнения бумаги и бумажных покрытий, осаждается и готовится в различных формах и размерах, имеющих характерное узкое распределение размеров частиц и эквивалентные сферические диаметры от 0,4 до 3 микрометров.[нужна цитата]
Карбонат кальция широко используется в качестве расширитель в краски,[27] особенно матовый эмульсионная краска где обычно 30% по весу краски составляет мел или мрамор. Это также популярный наполнитель в пластмассах.[27] Некоторые типичные примеры включают от 15 до 20% содержания мела в непластифицированный поливинилхлорид (НПВХ) водосточные трубы, От 5% до 15% загрузки стеарат- покрытый мелом или мрамором оконный профиль из ПВХ. ПВХ В кабелях может использоваться карбонат кальция при нагрузках до 70 частей на сто частей смолы для улучшения механических свойств (прочность на разрыв и относительное удлинение) и электрических свойств (объемное сопротивление).[нужна цитата] Полипропилен Компаунды часто заполняются карбонатом кальция для увеличения жесткости, что становится важным при высоких температурах использования.[28] Здесь процент часто составляет 20–40%. Он также обычно используется в качестве наполнителя в термореактивные смолы (листовые и объемные формовочные массы)[28] а также был смешан с АБС, и другие ингредиенты, чтобы сформировать некоторые типы прессованной "глины" покерные фишки.[29] Осажденный карбонат кальция, полученный каплями оксид кальция в воду, используется сама по себе или с добавками в виде белой краски, известной как побелка.[30][31]
Карбонат кальция добавляется в широкий спектр торговых и сделай это сам клеи, герметики и отделочные наполнители.[27] Клеи для керамической плитки обычно содержат от 70% до 80% известняка. Заполнители для отделки трещин содержат аналогичный уровень мрамора или доломита. Также смешивается со шпатлевкой при схватывании. витраж окон, а также в качестве резиста для предотвращения прилипания стекла к полкам печи при обжиге глазури и красок при высокой температуре.[нужна цитата]
В керамическая глазурь применения карбонат кальция известен как путассу,[27] и является обычным ингредиентом многих глазурей в виде белого порошка. Когда глазурь, содержащая этот материал, обжигается в печи, отбеливание действует как поток материал в глазури. Молотый карбонат кальция - это абразивный (как чистящий порошок, так и ингредиент бытовых чистящих кремов), в частности, в форме кальцита, который имеет относительно низкий уровень твердости 3 на Шкала Мооса, и поэтому не поцарапает стекло и большинство других керамика, эмаль, бронза, утюг, и сталии оказывают умеренное влияние на более мягкие металлы, такие как алюминий и медь. Паста из карбоната кальция и деионизированная вода можно использовать для очистки тускнеть на серебро.[32]
Приложения для здоровья и питания
Карбонат кальция широко используется в медицине в качестве недорогой пищевой добавки кальция для желудочный антацид[33] (Такие как Tums). Может использоваться как фосфатное связующее для лечения гиперфосфатемия (в первую очередь у пациентов с хроническая почечная недостаточность). Он используется в фармацевтической промышленности как инертный наполнитель за таблетки и другие фармацевтические препараты.[34]
Карбонат кальция используется в производстве оксида кальция, а также в зубной пасте и получил возрождение в качестве пищевого консерванта и фиксатора цвета при использовании в таких продуктах, как органические яблоки, или с ними.[35]
Карбонат кальция используется в терапевтических целях в качестве связывающего фосфата у пациентов на поддерживающей терапии. гемодиализ. Это наиболее часто назначаемая форма связывающего фосфата, особенно при недиализной хронической болезни почек. Карбонат кальция является наиболее часто используемым связывающим фосфатом, но клиницисты все чаще назначают более дорогие фосфатсвязывающие средства не на основе кальция, особенно севеламер.
Избыток кальция из добавок, обогащенных продуктов и диет с высоким содержанием кальция может вызвать молочно-щелочной синдром, который имеет серьезную токсичность и может привести к летальному исходу. В 1915 году Бертрам Сиппи ввел «режим сиппи» - ежечасное употребление молока и сливок и постепенное добавление яиц и вареных злаков в течение 10 дней в сочетании с щелочными порошками, что обеспечивало облегчение симптомов при язвенной болезни. В течение следующих нескольких десятилетий режим Сиппи привел к почечная недостаточность, алкалоз, и гиперкальциемия, в основном у мужчин с язвенной болезнью. Эти побочные эффекты были обращены вспять после отмены режима, но у некоторых пациентов с длительной рвотой это было фатальным. Молочно-щелочной синдром снизился у мужчин после эффективных методов лечения язвенная болезнь возникла болезнь. С 1990-х годов это наиболее часто встречается у женщин, принимающих добавки кальция сверх рекомендуемого диапазона от 1,2 до 1,5 граммов в день для профилактики и лечения остеопороза.[36][37] и усугубляется обезвоживание. Кальций добавлен в безрецептурные продукты, что способствует непреднамеренному чрезмерному потреблению. Чрезмерное потребление кальция может привести к гиперкальциемия, к осложнениям которого относятся рвота, боль в животе и изменение психического статуса.[38]
Как пищевая добавка это обозначено E170,[39] и у него есть INS номер 170. Используется как регулятор кислотности, агент против слеживания, стабилизатор или же цвет одобрен для использования в ЕС,[40] Соединенные Штаты Америки[41] и Австралия и Новая Зеландия.[42] Он используется в некоторых соевое молоко и миндальное молоко продукты как источник диетического кальция; одно исследование предполагает, что карбонат кальция может быть как биодоступный как кальций в коровье молоко.[43] Карбонат кальция также используется в качестве укрепляющий агент во многих овощных консервах и бутылках.
Сельскохозяйственное использование
Сельскохозяйственная известь, измельченный мел или известняк, используется как дешевый метод нейтрализации кислая почва, что делает его пригодным для посадки.[44]
Бытовое использование
Карбонат кальция - ключевой ингредиент многих бытовых чистящих порошков, таких как Комета и используется как моющее средство.
Экологические приложения
В 1989 году исследователь Кен Симмонс представил CaCO3 в ручей Уэтстоун в Массачусетс.[45] Он надеялся, что карбонат кальция противодействует кислоте в ручье от кислотных дождей и спасет форель, которая перестала нереститься. Хотя его эксперимент был успешным, он действительно увеличил количество ионов алюминия в области ручья, не обработанной известняком. Это показывает, что CaCO3 можно добавлять для нейтрализации кислотных дождей в река экосистемы. В настоящее время карбонат кальция используется для нейтрализации кислых условий как в почве, так и в воде.[46][47][48] С 1970-х годов такие известкование широко применяется в Швеции для уменьшения подкисления, и несколько тысяч озер и ручьев неоднократно покрываются известью.[49]
Карбонат кальция также используется в десульфуризация дымовых газов приложения, устраняющие вредные SO2 и нет2 выбросы от угля и других ископаемых видов топлива, сжигаемых на крупных электростанциях, работающих на ископаемом топливе.[46]
Равновесие прокаливания
Кальцинирование из известняк с помощью уголь пожары производить негашеная известь с древних времен практикуется культурами всего мира. Температура, при которой известняк дает оксид кальция, обычно составляет 825 ° C, но указание абсолютного порогового значения вводит в заблуждение. Карбонат кальция находится в равновесии с оксидом кальция и углекислый газ при любой температуре. При каждой температуре есть частичное давление углекислого газа, который находится в равновесии с карбонатом кальция. При комнатной температуре равновесие в подавляющем большинстве случаев благоприятствует карбонату кальция, потому что равновесный CO2 давление составляет лишь крошечную часть парциального CO2 давление в воздухе, которое составляет около 0,035 кПа.
При температурах выше 550 ° C равновесный CO2 давление начинает превышать CO2 давление в воздухе. Таким образом, при температуре выше 550 ° C карбонат кальция начинает выделять CO.2 в воздух. Однако в печи, работающей на древесном угле, концентрация CO2 будет намного выше, чем в воздухе. Действительно, если бы все кислород в печи расходуется в огне, тогда парциальное давление CO2 в печи может достигать 20 кПа.[50]
Таблица показывает, что это парциальное давление не достигается, пока температура не достигнет почти 800 ° C. Для дегазации CO2 из карбоната кальция, чтобы происходить с экономически целесообразным расходом, равновесное давление должно значительно превышать атмосферное давление CO2. И для того, чтобы это произошло быстро, равновесное давление должно превышать общее атмосферное давление 101 кПа, что происходит при 898 ° C.
Равновесное давление CO2 над CaCO3 (п) от температуры (Т).[51] п (кПа) 0.055 0.13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 Т (° C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Растворимость
С изменяющимся CO2 давление
Карбонат кальция плохо растворяется в чистой воде (47 мг / л при нормальном атмосферном CO.2 парциальное давление, как показано ниже).
Равновесие его раствора определяется уравнением (с растворенным карбонатом кальция справа):
CaCO3 ⇌ Ca2+ + CO2−
3Kзр = 3.7×10−9 к 8.7×10−9 при 25 ° C
где произведение растворимости за [Ca2+][CO2−
3] дается откуда угодно Kзр = 3.7×10−9 к Kзр = 8.7×10−9 при 25 ° C, в зависимости от источника данных.[51][52] Уравнение означает, что произведение молярной концентрации ионов кальция (родинки растворенного Ca2+ на литр раствора) с молярной концентрацией растворенных CO2−
3 не может превышать значение Kзр. Однако это, казалось бы, простое уравнение растворимости необходимо рассматривать вместе с более сложным равновесием углекислый газ с воды (видеть угольная кислота). Несколько из CO2−
3 сочетается с H+ в растворе согласно
HCO−
3 ⇌ H+ + CO2−
3Kа2 = 5.61×10−11 при 25 ° C
HCO−
3 известен как бикарбонат ион. Бикарбонат кальция во много раз более растворим в воде, чем карбонат кальция - действительно, он существует Только в растворе.
Несколько из HCO−
3 сочетается с H+ в растворе согласно
ЧАС2CO3 ⇌ H+ + HCO−
3Kа1 = 2.5×10−4 при 25 ° C
Некоторые из H2CO3 распадается на воду и растворенный углекислый газ согласно
ЧАС2O + CO2(водный) ⇌ H2CO3 Kчас = 1.70×10−3 при 25 ° C
А растворенный диоксид углерода находится в равновесии с атмосферным диоксидом углерода согласно
куда kЧАС = 29,76 атм / (моль / л) при 25 ° C (Константа Генри), пCO2 будучи CO2 частичное давление.
Для окружающего воздуха, пCO2 вокруг 3.5×10−4 атмосфер (или эквивалентно 35Па). Последнее уравнение выше фиксирует концентрацию растворенного CO2 как функция пCO2, независимо от концентрации растворенного CaCO3. При атмосферном парциальном давлении CO2, растворенный CO2 концентрация 1.2×10−5 моль на литр. Уравнение перед этим фиксирует концентрацию H2CO3 как функция CO2 концентрация. Для [CO2] = 1.2×10−5, это приводит к [H2CO3] = 2.0×10−8 моль на литр. Когда [H2CO3], оставшиеся три уравнения вместе с
| пCO2 (атм) | pH | [Ca2+] (моль / л) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
ЧАС2O ⇌ H+ + ОН− K = 10−14 при 25 ° C
(что верно для всех водных растворов) и тот факт, что раствор должен быть электрически нейтральным,
- 2 [Ca2+] + [H+] = [HCO−
3] + 2 [CO2−
3] + [ОН−]
позволяют одновременно решать оставшиеся пять неизвестных концентраций (обратите внимание, что приведенная выше форма уравнения нейтральности действительна только в том случае, если карбонат кальция контактировал с чистой водой или с раствором с нейтральным pH; в случае, когда исходная вода pH растворителя не является нейтральным, уравнение модифицировано).
В соседней таблице показан результат для [Ca2+] и [H+] (в виде pH) как функция парциального давления CO2 (Kзр = 4.47×10−9 взято для расчета).
- При атмосферном уровне CO в окружающей среде2 в таблице указано, что раствор будет слабощелочным с максимальным содержанием CaCO3 растворимость 47 мг / л.
- Как окружающий CO2 парциальное давление снижается ниже атмосферного, раствор становится все более щелочным. На очень низком уровне пCO2, растворенный CO2, бикарбонат-ион и карбонат-ион в значительной степени испаряются из раствора, оставляя сильно щелочной раствор гидроксид кальция, который более растворим, чем CaCO3. Обратите внимание, что для пCO2 = 10−12 атм, [Ca2+][ОЙ−]2 продукт все еще ниже продукта растворимости Ca (OH)2 (8×10−6). Для еще более низкого CO2 давление, Ca (OH)2 осадки произойдут до CaCO3 осадки.
- Как окружающий CO2 парциальное давление возрастает до уровней выше атмосферного, pH падает, и большая часть карбонат-иона превращается в бикарбонат-ион, что приводит к более высокой растворимости Ca2+.
Эффект последнего особенно заметен в повседневной жизни людей с жесткой водой. Вода в подземных водоносных горизонтах может подвергаться воздействию CO.2 намного выше атмосферного. Поскольку такая вода просачивается через породу карбоната кальция, CaCO3 растворяется по второй тенденции. Когда та же самая вода выходит из-под крана, со временем она приходит в равновесие с CO.2 уровни в воздухе за счет выделения избыточного CO2. В результате карбонат кальция становится менее растворимым, а его избыток осаждается в виде известкового налета. Этот же процесс отвечает за формирование сталактиты и сталагмиты в известняковых пещерах.
Две гидратированные фазы карбоната кальция, моногидрокальцит CaCO3·ЧАС2O и икаите CaCO3· 6H2О, может осадок из воды в условиях окружающей среды и сохраняются в виде метастабильных фаз.
При изменении pH, температуры и солености: CaCO3 скейлинг в бассейнах
В отличие от описанного выше сценария открытого равновесия, многие бассейны управляются добавлением бикарбонат натрия (NaHCO3) примерно до 2 мМ в качестве буфера, затем контроль pH с помощью HCl, NaHSO4, Na2CO3, NaOH или составы хлора, которые являются кислыми или основными. В этой ситуации растворенный неорганический углерод (общий неорганический углерод) далека от равновесия с атмосферным CO2. Движение к равновесию за счет дегазации CO2 замедляется
- медленная реакция
- ограниченная аэрация в глубокой толще воды; и
- периодическое пополнение бикарбоната для поддержания буферной емкости (часто оценивается путем измерения «Общая щелочность»).
В этой ситуации константы диссоциации для гораздо более быстрых реакций
- ЧАС2CO3 ⇌ H+ + HCO−
3 ⇌ 2 часа+ + CO2−
3
позволяют прогнозировать концентрации каждого растворенного неорганического углерода в растворе, исходя из добавленной концентрации HCO−
3 (что составляет более 90% Сюжет Бьеррума виды от pH 7 до pH 8 при 25 ° C в пресной воде).[54] Добавление HCO−
3 увеличится CO2−
3 концентрация при любом pH. Переставляя приведенные выше уравнения, мы видим, что [Ca2+] = Kзр/[CO2−
3], и [CO2−
3] = Kа2 [HCO−
3]/[ЧАС+]. Следовательно, когда HCO−
3 концентрация известна, максимальная концентрация Ca2+ ионы перед масштабированием через CaCO3 количество осадков можно предсказать по формуле:
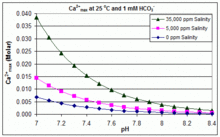
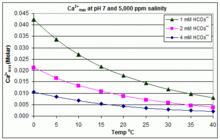
Произведение растворимости CaCO3 (Kзр) и константы диссоциации для растворенных форм неорганического углерода (включая Kа2) все существенно зависят от температуры и соленость,[54] с общим эффектом, что [Ca2+]Максимум увеличивается от пресной воды к соленой и уменьшается с повышением температуры, pH или уровня добавленного бикарбоната, как показано на прилагаемых графиках.
Тенденции иллюстративны для управления пулом, но произойдет ли масштабирование, также зависит от других факторов, включая взаимодействие с Mg2+, В (ОН)−
4 и другие ионы в бассейне, а также эффекты перенасыщения.[55][56] Накипь обычно наблюдается в электролитических генераторах хлора, где у поверхности катода высокий pH, а отложение накипи еще больше увеличивает температуру. Это одна из причин, по которой некоторые операторы бассейнов предпочитают борат бикарбонату в качестве основного буфера pH и избегают использования химикатов, содержащих кальций.[57]
Растворимость в сильном или слабом кислотном растворе
Решения сильный (HCl), умеренно сильная (сульфаминовый) или же слабый (уксусный, лимонный, сорбиновый, молочный, фосфорный) кислоты коммерчески доступны. Они обычно используются как средства для удаления накипи удалять известковый налет депозиты. Максимальное количество CaCO3 который может быть «растворен» одним литром раствора кислоты, можно рассчитать, используя приведенные выше уравнения равновесия.
- В случае сильной одноосновной кислоты с уменьшающейся концентрацией кислоты [A] = [A−], получаем (с CaCO3 молярная масса = 100 г / моль):
[A] (моль / л) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Начальный pH 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Конечный pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Растворенный CaCO3
(г / л кислоты)50.0 5.00 0.514 0.0849 0.0504 0.0474 0.0471 0.0470 0.0470
- где исходное состояние - раствор кислоты без Ca2+ (без учета возможного CO2 растворение) и конечное состояние - раствор с насыщенным Ca2+. Для сильных кислотных концентраций все виды имеют незначительную концентрацию в конечном состоянии по отношению к Ca2+ и А− так что уравнение нейтральности сводится примерно к 2 [Ca2+] = [A−] уступая [Ca2+] ≈ 1/2 [А−]. Когда концентрация уменьшается, [HCO−
3] становится неотъемлемой частью, так что предыдущее выражение больше не действует. Для исчезающих концентраций кислоты можно восстановить конечный pH и растворимость CaCO.3 в чистой воде.
- В случае слабой одноосновной кислоты (здесь мы берем уксусную кислоту с пKа = 4,76) с уменьшением общей концентрации кислоты [A] = [A−] + [AH], мы получаем:
[A] (моль / л) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Начальный pH 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Конечный pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Растворенный CaCO3
(г / л кислоты)49.5 4.99 0.513 0.0848 0.0504 0.0474 0.0471 0.0470 0.0470
- При одинаковой общей концентрации кислоты начальный pH слабой кислоты менее кислый, чем pH сильной кислоты; однако максимальное количество CaCO3 который может быть растворен примерно одинаково. Это потому, что в конечном состоянии pH больше, чем pKа, так что слабая кислота почти полностью диссоциирует, давая в итоге столько же H+ ионы как сильная кислота для «растворения» карбоната кальция.
- Расчет в случае фосфорная кислота (который наиболее широко используется в домашних условиях) является более сложным, поскольку концентрации четырех состояний диссоциации, соответствующих этой кислоте, должны быть рассчитаны вместе с [HCO−
3], [CO2−
3], [Ca2+], [H+] и [OH−]. Система может быть сведена к уравнению седьмой степени для [H+] численное решение которого дает
[A] (моль / л) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Начальный pH 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Конечный pH 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Растворенный CaCO3
(г / л кислоты)62.0 7.39 0.874 0.123 0.0536 0.0477 0.0471 0.0471 0.0470
- где [A] = [H3PO4] + [ЧАС
2PO−
4] + [HPO2−
4] + [PO3−
4] - общая концентрация кислоты. Таким образом, фосфорная кислота более эффективна, чем монокислота, поскольку при конечном почти нейтральном pH концентрация во втором диссоциированном состоянии [HPO2−
4] нельзя пренебречь (см. фосфорная кислота).
Смотрите также
Рекомендации
- ^ Эйлуорд, Гордон; Финдли, Тристан (2008). SI Химическая книга данных (4-е изд.). Джон Уайли и сыновья Австралия. ISBN 978-0-470-81638-7.
- ^ Rohleder, J .; Крокер, Э. (2001). Карбонат кальция: от мелового периода до 21 века. Springer Science & Business Media. ISBN 978-3-7643-6425-0.
- ^ Бенджамин, Марк М. (2002). Химия воды. Макгроу-Хилл. ISBN 978-0-07-238390-4.
- ^ «Руководство по безопасности и гигиене труда для карбоната кальция» (PDF). Департамент здравоохранения и социальных служб США. Получено 31 марта 2011.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) 29 октября 2018 г.. Получено 29 октября 2018.CS1 maint: заархивированная копия как заголовок (связь)
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A21. ISBN 978-0-618-94690-7.
- ^ Карманный справочник NIOSH по химической опасности. "#0090". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Осажденный карбонат кальция». Архивировано из оригинал 11 января 2014 г.. Получено 11 января 2014.
- ^ а б c d е Ропп, Р. К. (6 марта 2013 г.). Энциклопедия соединений щелочноземельных металлов. Эльзевир. С. 359–370. ISBN 9780444595508.
- ^ Демикелис, Рафаэлла; Райтери, Паоло; Гейл, Джулиан Д .; Довеси, Роберто (2013). «Множественные структуры ватерита». Рост кристаллов и дизайн. 13 (6): 2247–2251. Дои:10.1021 / cg4002972. ISSN 1528-7483.
- ^ Рассел, Дэниел Э. 17 февраля 2008 г. Проверено 31 декабря 2010 г. "Исландский шпатовый рудник Хельгустадир" mindat.org
- ^ Хорн, Фрэнсис (23 октября 2006 г.). "Как создаются ракушки?". Scientific American. Получено 25 апреля 2012.
- ^ «Кальций из устриц». WebMD. Получено 25 апреля 2012.
- ^ «Карбонат кальция из раковин устриц». Caltron Clays & Chemicals. Архивировано из оригинал 10 сентября 2013 г.. Получено 25 апреля 2012.
- ^ Мангельс, Энн Рид (4 июня 2014 г.). «Питательные вещества для костей для вегетарианцев». Американский журнал клинического питания. 100 (1): 469S – 475S. Дои:10.3945 / ajcn.113.071423. PMID 24898231.CS1 maint: дата и год (связь)
- ^ Boynton, W. V .; Ming, D. W .; Kounaves, S.P .; и другие. (2009). "Свидетельства наличия карбоната кальция в месте посадки на Марс Феникс" (PDF). Наука. 325 (5936): 61–64. Bibcode:2009 Наука ... 325 ... 61B. Дои:10.1126 / science.1172768. PMID 19574384. S2CID 26740165.
- ^ Кларк, Б.С., III; Arvidson, R.E .; Gellert, R .; и другие. (2007). «Свидетельства наличия монтмориллонита или его эквивалента по составу на холмах Колумбия, Марс» (PDF). Журнал геофизических исследований. 112 (E6): E06S01. Bibcode:2007JGRE..112.6S01C. Дои:10.1029 / 2006JE002756. HDL:1893/17119.
- ^ Вейль, П. (1959). «Изменение растворимости карбоната кальция с температурой и содержанием диоксида углерода». Geochimica et Cosmochimica Acta. 17 (3–4): 214–225. Bibcode:1959GeCoA..17..214W. Дои:10.1016/0016-7037(59)90096-1.
- ^ а б Трекслер, Д. (2001). «Формирование Два Медицины, Монтана: геология и фауна». В Танке, Д. Х .; Карпентер, К. (ред.). Мезозойская жизнь позвоночных. Издательство Индианского университета. стр.298–309. ISBN 978-0-253-33907-2.
- ^ Уорд, Питер (2006). Из воздуха: динозавры, птицы и древняя атмосфера Земли. Дои:10.17226/11630. ISBN 9780309666121.
- ^ «Эффекты кислотного дождя». Агентство по охране окружающей среды США. Получено 14 марта 2015.
- ^ «Доменная печь». Научная помощь. Архивировано из оригинал 17 декабря 2007 г.. Получено 30 декабря 2007.
- ^ Сфецу, Николае (2 мая 2014 г.). Здоровье и лекарства: болезни, рецепты и лекарства. Николае Сфецу.
- ^ Макгиннис, Р.А. Свекло-сахарная технология (2-е изд.). Фонд развития свекольного сахара. п. 178.
- ^ «Использование осажденного карбоната кальция». Архивировано из оригинал 25 июля 2014 г.
- ^ "Маркетинговые наполнители, 2-е изд.". Черезана. Сентябрь 2011 г.
- ^ а б c d «Порошок карбоната кальция». Прочтите передовые материалы. 4 февраля 2006 г. Архивировано с оригинал 22 февраля 2008 г.. Получено 30 декабря 2007.
- ^ а б «Карбонат кальция в пластиках». Imerys Performance Minerals. Архивировано из оригинал 4 августа 2008 г.. Получено 1 августа 2008.
- ^ «Почему карбонат кальция играет важную роль в промышленности». www.xintuchemical.com. Получено 7 октября 2018.
- ^ "цена на осажденный карбонат кальция". www.dgci.be. Архивировано из оригинал 7 октября 2018 г.. Получено 7 октября 2018.
- ^ Jimoh, O.A .; и другие. (2017). «Понимание механизма производства осажденного карбоната кальция (PCC) и его характеристик в системе жидкость-газ с использованием суспензии извести извести (MOL)» (PDF). Южноафриканский химический журнал. 70: 1–7. Дои:10.17159 / 0379-4350 / 2017 / v70a1.
- ^ "Блог исторического общества Огайо: Сделайте это сияющим". Историческое общество Огайо. Архивировано из оригинал 23 марта 2012 г.. Получено 2 июн 2011.
- ^ "Карбонат кальция". Медлайн Плюс. Национальные институты здоровья. 1 октября 2005 г. Архивировано с оригинал 17 октября 2007 г.. Получено 30 декабря 2007.
- ^ Либерман, Герберт А .; Лахман, Леон; Шварц, Джозеф Б. (1990). Фармацевтические лекарственные формы: таблетки.. Нью-Йорк: Деккер. п.153. ISBN 978-0-8247-8044-9.
- ^ «Пищевые добавки - названия, начинающиеся с C». Chemistry.about.com. 10 апреля 2012 г. Архивировано с оригинал 16 октября 2006 г.. Получено 24 мая 2012.
- ^ Карузо Дж. Б., Патель Р. М., Юлка К., округ Колумбия (июль 2007 г.). «Болезнь, вызванная здоровым поведением: возвращение молочно-щелочного синдрома». J Gen Intern Med. 22 (7): 1053–5. Дои:10.1007 / s11606-007-0226-0. ЧВК 2219730. PMID 17483976.
- ^ Beall DP, Henslee HB, Webb HR, Scofield RH (май 2006 г.). «Молочно-щелочной синдром: исторический обзор и описание современной версии синдрома». Являюсь. J. Med. Наука. 331 (5): 233–42. Дои:10.1097/00000441-200605000-00001. PMID 16702792. S2CID 45802184.
- ^ Габриэли, Илан; Leu, James P .; Барзель, Уриэль С. (2008). «Решение клинических проблем, назад к основам». Медицинский журнал Новой Англии. 358 (18): 1952–6. Дои:10.1056 / NEJMcps0706188. PMID 18450607.
- ^ «E-номера: E170 Карбонат кальция». Food-Info.net. 080419 food-info.net
- ^ «Текущие добавки, одобренные ЕС, и их номера E». Агентство по пищевым стандартам Великобритании. Получено 27 октября 2011.
- ^ «Перечень пищевых добавок, часть I». нас Управление по контролю за продуктами и лекарствами. Архивировано из оригинал 14 марта 2013 г.. Получено 27 октября 2011.
- ^ «Стандарт 1.2.4 - Маркировка ингредиентов». Кодекс пищевых стандартов Австралии и Новой Зеландии. Получено 27 октября 2011.
- ^ Zhao, Y .; Martin, B.R .; Уивер, К. М. (2005). «Биодоступность кальция соевого молока, обогащенного карбонатом кальция, у молодых женщин эквивалентна коровьему молоку». Журнал питания. 135 (10): 2379–2382. Дои:10.1093 / jn / 135.10.2379. PMID 16177199.
- ^ Оутс, Дж. А. Х. (11 июля 2008 г.). Известь и известняк: химия и технология, производство и использование. Джон Вили и сыновья. С. 111–113. ISBN 978-3-527-61201-7.
- ^ "Дозатор известняка борется с кислотным дождем в ручье". Нью-Йорк Таймс. Ассошиэйтед Пресс. 13 июня 1989 г.
- ^ а б «Экологическое использование карбоната кальция». Congcal. Получено 5 августа 2013.
- ^ Шрайбер, Р. К. (1988). «Совместные федерально-штатные исследования известкования поверхностных вод, подверженных воздействию кислотных отложений». Загрязнение воды, воздуха и почвы. 41 (1): 53–73. Дои:10.1007 / BF00160344 (неактивно 30 октября 2020 г.).CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь)
- ^ Кирхейс, Дан; Дилл, Ричард (2006). «Влияние низкого pH и высокого содержания алюминия на смолтов атлантического лосося в Восточном штате Мэн и анализ осуществимости проекта известкования» (перепечатано в Федерации лосося Дауниста). Национальная служба морского рыболовства и Комиссия по атлантическому лососю штата Мэн.[постоянная мертвая ссылка]
- ^ Guhrén, M .; Bigler, C .; Ренберг, И. (2006). «Известкование в долгосрочной перспективе: палеолимнологическое исследование 12 озер в рамках шведской программы известкования». Журнал палеолимнологии. 37 (2): 247–258. Bibcode:2007JPall..37..247G. Дои:10.1007 / s10933-006-9014-9. S2CID 129439066.
- ^ «Осажденный карбонат кальция Solvay: производство». Solvay. 9 марта 2007 г.. Получено 30 декабря 2007.
- ^ а б Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ^ «Избранные продукты растворимости и константы образования при 25 ° C». Калифорнийский государственный университет, Домингес-Хиллз.
- ^ Ван, X .; Conway, W .; Burns, R .; McCann, N .; Мэдер, М. (2010). «Комплексное изучение реакций гидратации и дегидратации диоксида углерода в водном растворе». Журнал физической химии A. 114 (4): 1734–40. Bibcode:2010JPCA..114.1734W. Дои:10.1021 / jp909019u. PMID 20039712.
- ^ а б Мук, В. (2000). «Химия углекислоты в воде». Экологические изотопы в гидрологическом цикле: принципы и применение (PDF). Париж: INEA / ЮНЕСКО. С. 143–165. Архивировано из оригинал (PDF) 18 марта 2014 г.. Получено 18 марта 2014.
- ^ Войтович, Дж. А. (1998). «Факторы, влияющие на осаждение карбоната кальция» (PDF). Журнал индустрии бассейнов и спа. 3 (1): 18–23. Архивировано из оригинал (PDF) 18 марта 2014 г.. Получено 18 марта 2014.
- ^ Войтович, Дж. А. (1998). «Исправления, возможные ошибки и значение индекса насыщения» (PDF). Журнал индустрии бассейнов и спа. 3 (1): 37–40. Архивировано из оригинал (PDF) 24 августа 2012 г.. Получено 18 марта 2014.
- ^ Берч, Р. Г. (2013). «BABES: лучший метод, чем BBB для бассейнов с генератором хлора в соленой воде» (PDF). scithings.id.au.







![{ Displaystyle { frac {P _ {{ ce {CO2}}}} {[{ ce {CO2}}]}} = k _ {{ ce {H}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ea24aea352cf487469aff16947f0df5355eba48)
![{ displaystyle [{ ce {Ca ^ 2 +}}] _ { max} = { frac {K _ { mathrm {sp}}} {K _ { mathrm {a} 2}}} times { гидроразрыв {[{ ce {H +}}]} {[{ ce {HCO3-}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c29788e95a3ab2725c1dcf13bc21810814294dc)
