WikiDer > Камптотецин
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.113.172 |
| Химические и физические данные | |
| Формула | C20ЧАС16N2О4 |
| Молярная масса | 348.358 г · моль−1 |
| 3D модель (JSmol) | |
| Температура плавления | От 275 до 277 ° C (от 527 до 531 ° F) |
| |
| |
| (проверять) | |
Камптотецин (CPT) это яд топоизомеразы. Он был открыт в 1966 г. М. Э. Уоллом и М. К. Вани при систематическом изучении натуральные продукты для противорака наркотики. Он был изолирован от лаять и корень из Camptotheca acuminata (Camptotheca, Счастливое дерево), дерево родной для Китай используется в качестве лечения рака в традиционная китайская медицина.[1][2] Совсем недавно в Китае его начали использовать в клинической практике для лечения опухолей желудочно-кишечного тракта.[3]CPT показал замечательную противоопухолевую активность в предварительном клинические испытания особенно против рака груди, яичников, толстой кишки, легких и желудка[4] Однако у него низкий растворимость сообщалось о побочных эффектах при терапевтическом использовании,[5] Таким образом, синтетические и медицинские химики разработали многочисленные способы синтеза камптотецина.[6][7][8] и различные производные для увеличения преимуществ химический, с хорошими результатами. Четыре CPT аналоги были одобрены и используются в рак химиотерапия[9] сегодня, топотекан, иринотекан, белотекан, и трастузумаб друкстекан.[10][11] Камптотецин также был обнаружен в других растениях, включая Chonemorpha Fragrans.[12] Камптотецин не только является противоопухолевым агентом, но и проявляет активность против ВИЧ, поскольку он прерывает самоассоциацию фактора вирусной инфекционности, обнаруженного во многих ретровирусах, включая ВИЧ.[13]
Структуры
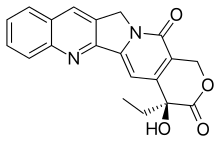
CPT имеет плоское пентациклическое кольцо структура, который включает пирроло[3,4-β] -хинолиновый фрагмент (кольца A, B и C), сопряженный пиридон фрагмент (кольцо D) и один хиральный центр в позиции 20 внутри альфа-гидрокси лактон кольцо с (S) конфигурация (E-кольцо). Его планарная структура считается одним из наиболее важных факторов ингибирования топоизомеразы.[14][15]
Привязка
CPT связывается с топоизомеразой I и комплексом ДНК (ковалентным комплексом), образуя тройной комплекс и тем самым стабилизируя его. Это предотвращает повторное лигирование ДНК и, следовательно, вызывает повреждение ДНК, что приводит к апоптоз.[16]CPT связывается как с ферментом, так и с ДНК с водородные связи. Наиболее важной частью структуры является E-кольцо, которое взаимодействует с ферментом из трех разных положений. Гидроксильная группа в положении 20 образует водородную связь с боковой цепью на аспарагиновая кислота номер 533 (Asp533) в ферменте. Очень важно, чтобы конфигурация хирального углерод равно (S), потому что (R) неактивен. Лактон связан двумя водородными связями с амино- группы на аргинин 364 (Arg364). D-кольцо взаимодействует с +1 цитозин на нерасщепленной цепи и стабилизирует ковалентный комплекс топоизомераза I-ДНК за счет образования водородной связи. Эта водородная связь находится между карбонил группа в положении 17 на D-кольце и аминогруппа на пиримидин кольцо +1 цитозина.[17][18] CPT избирательно цитотоксичен для клеток, реплицирующих ДНК во время S-фазы. [19] и его токсичность в первую очередь является результатом превращения одноцепочечных разрывов в двухцепочечные разрывы, когда репликационная вилка сталкивается с комплексами расщепления, образованными ДНК и СРТ.[20]
Химия
Лактоновое кольцо в CPT очень чувствительно к гидролиз. Форма с открытым кольцом неактивна, и поэтому она должна быть замкнута, чтобы ингибировать топоизомеразу I. Замкнутая форма предпочтительна в кислой среде, как и при многих раковых заболеваниях. клетки микроокружение. CPT транспортируется в клетку пассивная диффузия. Клеточному поглощению способствует липофильность, что усиливает внутриклеточный накопление. Липофильность делает соединения более стабильный из-за улучшенного разделения лактона на красные кровяные тельца и, следовательно, меньший гидролиз лактона. CPT имеет сродство к человеческому сывороточному альбумину (HSA), особенно к карбоксилатной форме CPT. Из-за этого равновесие между лактоновым кольцом и карбоксилатной формой движется к карбоксилату. Сниженный препарат-HSA взаимодействия может привести к повышению активности.[17][21]
Связь структура-деятельность
Исследования показали, что замена в позиции 7, 9, 10 и 11 может положительно влиять на активность CPT и физические свойства, например потенция и метаболическая стабильность. Увеличение лактонового кольца на единицу CH
2 единица измерения также усиливает свои способности, как в гомокамптотецине. Замена в положениях 12 и 14 приводит к неактивной производной.[21]
Модификация A- и B-кольца
Алкильное замещение
Алкил замена в положении 7 показала повышенную цитотоксичность, например этил (C2ЧАС5) или хлорметил (CH2Cl). Эти группы способны реагировать с ДНК в присутствии топоизомеразы I, что приводит к большему опухоль Мероприятия. Также было показано, что увеличение длины углеродной цепи (в положении 7) приводит к увеличению липофильности и, следовательно, большей активности и стабильности у человека. плазма.[17][21]Другими аналогами 7-модифицированного СРТ являются силатеканы и каренитецины. Они являются мощными ингибиторами топоизомеразы I и оба имеют алкилсилильные группы в положении 7, что делает их липофильными и более стабильными. Силатеканы или 7-силилкамптотецины показали сниженное взаимодействие лекарственное средство-HSA, что способствует стабильности его крови, и они также могут пересекать гематоэнцефалический барьер. DB-67 представляет собой 10-гидроксипроизводное и входит в число наиболее активных силатеканов. BNP1350, который принадлежит к серии каренитецинов, проявляет цитотоксическую активность и способность преодолевать устойчивость к лекарству. Еще один способ сделать СРТ липофильным - это введение липофильных заместителей, таких как иминометил или оксииминометил. Одним из наиболее эффективных соединений является оксиминометильное производное ST1481, которое обладает преимуществом в преодолении лекарственной устойчивости, вызванной транспортными системами.[21]Базовый азот в углеродной цепи в положении 7 делает соединение более гидрофильный и, следовательно, более растворим в воде. Например, это производное под названием CKD-602, которое является мощным ингибитором топоизомеразы I и успешно преодолевает плохую растворимость в воде и токсичность, наблюдаемую при использовании CPT.[21][22]
Значительно большей активности можно добиться, поместив электроноакцепторные группы, такие как амино, нитро, бром или же хлор в положениях 9 и 10 и гидроксильная группа в положениях 10 или 11. Но эти соединения относительно нерастворимы в водных растворах, что вызывает трудности при введении. Метокси группа в положении 10 и 11 одновременно приводит к бездействию.[14][21]
Гексациклические аналоги CPT
Гексациклические аналоги CPT показали высокую эффективность. Например, метилендиокси или этилендиоксигруппа, соединенная между 10 и 11, образуют 5 или 6-членное кольцо, что приводит к большему количеству водорастворимых производных и повышению эффективности. Исследования показали, что аналоги этилендиокси менее эффективны, чем метилендиокси. Причина - неблагоприятные стерические взаимодействия аналогов этилендиокси с ферментом.[14][21]
Добавление амино- или хлор-группы в 9-м положении или хлорметильной группы в 7-м положении к этим 10, 11-метилендиокси или этилендиокси аналогам приводит к соединениям с еще большей цитотоксичностью, но меньшей растворимостью в воде. Для получения 10, 11-метилендиокси или этилендиокси аналогов с хорошей растворимостью в воде хорошим способом является введение водорастворимого заместителя в положение 7. Луртотекан удовлетворяет этим требованиям; это 10,11-этилендиокси-аналог с 4-метилпиперазинометиленом в положении 7, который продемонстрировал большую эффективность в клинических исследованиях.[14]
Кольцо также может быть образовано между положениями 7 и 9, например положениями 10 и 11. Это дает новые возможности для получения водорастворимых производных [5]. Эти гексациклические СРТ становятся более активными, когда электроноакцепторные группы помещаются в положение 11, а метильные или аминогруппы в положение 10. Эксатекан является примером гексациклического СРТ, который имеет 6-членное кольцо над положениями 7 и 9 и представляет собой 10-метил, 11 -фторзамещенный [4]. Он водорастворим и более эффективен, чем топотекан.[14][21][23]
Модификация C- и D-кольца
C- и D-кольца играют важную роль в противоопухолевой активности. Замена в любом положении приводит к гораздо менее активному соединению, чем исходное соединение, в другом анализе цитотоксичности.[14]
Модификации E-ring
E-кольцо не допускает многих структурных изменений без потери активности CPT, потому что оно необходимо для связывания с активным сайтом TOP I.[24] Одна из возможных замен - это изменение гидроксильной группы на Cl, F или Br, потому что их поляризуемость достаточно для стабилизации ферментного комплекса.[21]
Другой возможной модификацией является введение метилена между гидроксилом и лактоном на E-кольце с образованием семичленной группы β-гидроксилактона, так называемого гомокамптотецина (hCPT). Гидроксил hCPT имеет меньше индуктивный эффект на карбоксильной группе, что делает лактон очень реактивным. Это оптимально усиливает взаимодействие свободной гидроксильной группы с топоизомеразой I, и ковалентный комплекс, образующийся в ее присутствии, становится более стабильным. E-кольцо hCPT открывается медленнее, и отверстие необратимый. hCPT демонстрируют повышенную стабильность плазмы человека из-за снижения белок связывание и большее сродство к эритроцитам, чем CPT.[14][21]
Аналоги CPT
С момента открытия CPT было синтезировано много аналогов. Ниже приведено схематическое изображение аналогов CPT, упомянутых в тексте выше.
 | ||||
| Аналог | р1 | р2 | р3 | р4 |
| Топотекан | -ЧАС |  | -ОЙ | -ЧАС |
| Иринотекан (CPT-11) | -ЧАС | 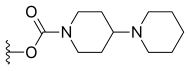 | -ЧАС | |
| Силатекан (ДБ-67, АР-67) | 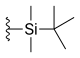 | -ЧАС | -ОЙ | -ЧАС |
| Козитекан (БНП-1350) |  | -ЧАС | -ЧАС | -ЧАС |
| Exatecan |  | —CH3 | —F | |
| Луртотекан |  | -ЧАС |  | |
| Гиматекан (ST1481) |  | -ЧАС | -ЧАС | -ЧАС |
| Белотекан (CKD-602) |  | -ЧАС | -ЧАС | -ЧАС |
| Рубитекан | -ЧАС | 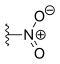 | -ЧАС | -ЧАС |
CPT связан с циклодекстринполимер на основе для создания исследуемого противоракового препарата CRLX101.[25]
Биосинтез
Как и все другие монотерпеноидные индол-алкалоиды, для биосинтеза камптотецина требуется производство стриктозидина. Стриктозидин синтезируется путем реакции конденсации между трипамином из шикиматного пути и секологанином из мевалонатного (MVA) или немевалонатного пути (MEP).[26] Затем стриктозидин подвергается межмолекулярной циклизации с образованием стриктозамида, который превращается в камптотецин в результате серии реакций окисления ферментами, которые еще предстоит решить.[27]
Путь шикимата, ведущий к биосинтезу триптамина, в основном изучен. Во-первых, хоризмат превращается в антранилат альфа-субъединицей антранилатсинтазы (ASA). Антранилат реагирует с пиррофосфатом 5-фосфорибозы с образованием 5-фосфорибозилантранилата. Затем это промежуточное соединение превращается в индол-глицеринфосфат, который взаимодействует с альфа-субъединицей триптофан (TSA) синтазы с образованием индола. Бета-субъединица триптофансинтазы (TSB) катализирует конденсацию индола с серином, что приводит к триптофану. На следующем этапе триптоамин производится в результате декарбоксилирования триптофандекарбоксилазой (TDC).[28]
Синтез секологанина начинается с реакции конденсации между пируватом и D-глицеральдегид-3-фосфатом, катализируемой 1-дезокси-D-ксилулозо-5-фосфатсинтазой (DXS), с образованием 1-дезокси-D-ксилулозо-5-фосфата (DXP). Превращение DXP в изопентенилдифосфат (IPP), который является обычным предшественником биосинтеза терпеноидов, включает 1-дезокси-D-ксилулозо-5-фосфатредуктоизомеразу (DXR) и 1-гидрокси-2-метил-2 (E) -бутенил- 4-дифосфатредуктаза (HDR). Образование IPP может быть достигнуто как путями MVA, так и MEP.[29] Конденсация IPP и диметилаллилдифосфата (DMAPP) дает геранилдифосфат (GPP). Затем гераниолсинтаза (GS) превращает GPP в гераниол.[26] Превращение гераниола в секологанин происходит посредством различных ферментативных реакций. На основании исследований радиоактивного мечения и ингибиторов, специфичных для пути, путь MEP является основным источником секологанина.[30]
Триптамин из пути шикимата и секологанин из пути MVA или MEP превращаются в стриктозидин в результате реакции конденсации, катализируемой стриктозидинсинтазой. Хотя это не решено полностью, было высказано предположение, что камптотецин продуцируется из стриктозидина через стриктозамид, 3 (S) -пумилозид и 3 (S) -дезоксипумилозид.[27]
Рекомендации
- ^ Govindachari TR, Viswnathan N (1972). "стволовая кора Mappia foetida, дерево, произрастающее в Индии, оказалось еще одним важным источником для выделения камптотецина ». Фитохимия. 11 (12): 3529–31. Дои:10.1016 / s0031-9422 (00) 89852-0.
- ^ Эфферт Т., Фу Ю.Дж., Цзу Ю.Г., Шварц Г., Конкималла В.С., Винк М. (2007). «Молекулярно-направленная терапия опухолей с использованием натуральных продуктов, полученных из традиционной китайской медицины». Современная лекарственная химия. 14 (19): 2024–32. Дои:10.2174/092986707781368441. PMID 17691944.
- ^ "Chemnetbase - Словарь лекарственных средств - Камптотецин".
- ^ Ван, Сиань Х. «Дизайн, синтез и оценка биологической активности конъюгатов камптотецин-HAA-норкантаридин в качестве противоопухолевых агентов in vitro». Химическая биология и дизайн лекарств.
- ^ "Chemnetbase - Словарь лекарственных средств - Камптотецин".
- ^ «Курран синтез камптотецина». Архивировано из оригинал на 2009-09-05.
- ^ «Комины синтеза камптотецина». Архивировано из оригинал на 2009-09-05.
- ^ «Рапапорт-синтез камптотецина».[постоянная мертвая ссылка]
- ^ Такимото СН, Кальво Э. «Принципы онкологической фармакотерапии» in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (ред.) Лечение рака: мультидисциплинарный подход. 11 изд. 2008 г.
- ^ M.E. Wall; М.С. Вани; C.E. Cook; К. Х. Палмер; А.И. Макфайл; Г. А. Сим (1966). «Растительные противоопухолевые агенты. I. Выделение и структура камптотецина, нового алкалоидного лейкоза и ингибитора опухолей из камптотека остроконечного». Журнал Американского химического общества. 88 (16): 3888–3890. Дои:10.1021 / ja00968a057.
- ^ Г. Самуэльссон (2004). Лекарства природного происхождения: учебник фармакогнозии (5-е изд.). Стокхольм: шведская фармацевтическая пресса. ISBN 91-974318-4-2.
- ^ Иса, Тасиу; Умар, Шахид (сентябрь 2018 г.). «Влияние на клональное размножение Chonemorpha Fragrans (луна) Alston in vitro за счет прочности питательной среды, регуляторов роста растений, источника углерода и фотопериодической инкубации». Журнал исследований лесного хозяйства. Дои:10.1007 / s11676-018-0794-3.
- ^ Беннетт, Райан П. «Производные камптотецина в качестве агентов против ВИЧ и методы идентификации агентов, которые нарушают самоассоциацию Vif».
- ^ а б c d е ж грамм Х. Улукан; П.В. Swaan (2002). «Камптотецины, обзор их химиотерапевтического потенциала». Наркотики (27-е изд.). 62 (2): 2039–2057. Дои:10.2165/00003495-200262140-00004. PMID 12269849.
- ^ А. Дж. Лу; З. С. Чжан; M. Y. Zheng; Х. Дж. Цзоу; X. М. Луо; Х. Л. Цзян (2007). «Исследование 20 (S) -камптотецина с помощью 3D-QSAR». Acta Pharmacologica Sinica. 28 (2): 307–314. Дои:10.1111 / j.1745-7254.2007.00477.x. PMID 17241535.
- ^ «Камптотецин». DrugBank. Получено 9 октября 2016.
- ^ а б c Д. Дж. Адамс; М. Л. Валь; Дж. Л. Флауэрс; Б. Сен; М. Колвин; М. В. Дьюхёрст; Г. Маникумар; М. К. Вани (2005). «Аналоги камптотецина с повышенной активностью против клеток рака груди человека. II. Влияние градиента pH опухоли». Химиотерапия и фармакология рака. 57 (2): 145–154. Дои:10.1007 / s00280-005-0008-5. PMID 16001167.
- ^ М. Р. Рединбо; Л. Стюарт; П. Кун; Ж. Ж. Шампу; В. Г. Дж. Хол (1998). «Кристаллическая структура топоизомеразы I человека в ковалентных и нековалентных комплексах с ДНК». Наука. 279 (5356): 1504–1513. Bibcode:1998Научный ... 279.1504R. Дои:10.1126 / science.279.5356.1504. PMID 9488644.
- ^ Дель Бино Г., Лассота П., Дарзинкевич З. (1991). «Цитотоксичность S-фазы камптотецина». Экспериментальные исследования клеток. 193 (1): 27–35. Дои:10.1016/0014-4827(91)90534-2. PMID 1995300.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Y. Pommier; К. Редон; В.А. Рао; J.A. Зайлер; О. Сорде; Х. Такемура; С. Антоний; Л. Менг; З. Ляо; Г. Кольхаген (2003). «Ремонт и контрольная точка ответа на опосредованное топоизомеразой I повреждение ДНК». Мутационные исследования. 532 (1–2): 173–203. Дои:10.1016 / j.mrfmmm.2003.08.016. PMID 14643436.
- ^ а б c d е ж грамм час я j Ф. Зунино; С. Даллавалле; Д. Лаккабу; Г. Беретта; Л. Мерлини; Г. Пратеси (2002). «Текущее состояние и перспективы развития камптотецинов». Текущий фармацевтический дизайн (27-е изд.). 8 (27): 2505–2520. Дои:10.2174/1381612023392801. PMID 12369944.
- ^ М. К. Чунг; С. С. Хан; Дж. К. Ким (2006). «Оценка токсического потенциала нового противоракового агента камптотецина CKD-602 на фертильность и раннее эмбриональное развитие у крыс». Нормативная токсикология и фармакология. 45 (3): 273–281. Дои:10.1016 / j.yrtph.2006.05.004. PMID 16814440.
- ^ М. Паламбо; К. Сисси; Б. Гатто; С. Моро; Дж. Заготто (2001). «Количественное определение камптотецина и родственных ему соединений». Журнал хроматографии B. 764 (1–2): 121–40. Дои:10.1016 / S0378-4347 (01) 00345-0. PMID 11817024.
- ^ Вендитто, Винсент Дж .; Симанек, Эрик Э. (02.03.2010). «Лечение рака с использованием камптотецинов: обзор литературы in vivo». Молекулярная фармацевтика. 7 (2): 307–349. Дои:10.1021 / mp900243b. ISSN 1543-8384. ЧВК 3733266. PMID 20108971.
- ^ «Cerulean привлекает 24 миллиона долларов на развитие клинических разработок нанофармацевтических препаратов». 15 ноя 2010.
- ^ а б Ямазаки, Ясуйо; Китадзима, Марико; Арита, Масанори; Такаяма, Хиромицу; Судо, Хироши; Ямазаки, Мами; Айми, Норио; Сайто, Кадзуки (2004). «Биосинтез камптотецина. Исследование in Silico и in vivo из [1-13C] глюкозы». Физиология растений. 134 (1): 161–170. Дои:10.1104 / стр.103.029389. ISSN 0032-0889.
- ^ а б Лоренс, Аргелия; Несслер, Крейг Л. (2004). «Камптотецин, более четырех десятилетий удивительных открытий». Фитохимия. 65 (20): 2735–2749. Дои:10.1016 / j.phytochem.2004.09.001. ISSN 0031-9422.
- ^ Новый взгляд на биосинтез алкалоидов и перспективы на будущее. Академическая пресса. 27 июля 2013. С. 143–149. ISBN 978-0-08-099411-6.
- ^ Новый взгляд на биосинтез алкалоидов и перспективы на будущее. Академическая пресса. 27 июля 2013. С. 143–149. ISBN 978-0-08-099411-6.
- ^ Новый взгляд на биосинтез алкалоидов и перспективы на будущее. Академическая пресса. 27 июля 2013. С. 143–149. ISBN 978-0-08-099411-6.





