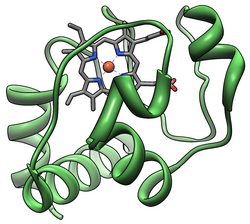
WikiDer > Цитохром с
В цитохромный комплекс, или же cyt c, это небольшой гемепротеин найден слабо связанным с внутренняя мембрана из митохондрия. Он принадлежит к семейство цитохрома с белков и играет важную роль в апоптозе клеток. Цитохром с высоко вода, в отличие от других цитохромы, и является важным компонентом электронная транспортная цепь, где он несет один электрон. Он способен переносить окисление и снижение как его утюг атом преобразуется между железо и железо образует, но не связывает кислород. Он переносит электроны между Комплексы III (Коэнзим Q - Cyt C редуктаза) и IV (Cyt C оксидаза). У человека цитохром с кодируется CYCS ген.[5][6]
Распространение видов
Цитохром с - это высококонсервативный белок для всех видов, обнаруженный у растений, животных и многих одноклеточных организмов. Это, наряду с его небольшими размерами (молекулярная масса около 12000 дальтон),[7] делает его полезным при изучении кладистика.[8] Молекула цитохрома с была изучена с точки зрения эволюционной биологии.
Цитохром с имеет первичную структуру, состоящую из цепочки примерно из 100 аминокислоты. Многие организмы высшего порядка обладают цепочкой из 104 аминокислот.[9] Последовательности цитохрома с у человека идентичны последовательностям шимпанзе (наши ближайшие родственники), но отличаются от последовательностей лошадей.[10]
Цитохром c имеет аминокислотную последовательность, которая является высококонсервативной у эукариот и отличается всего несколькими остатками. У более чем тридцати видов, протестированных в одном исследовании, 34 из 104 аминокислот были консервативными; идентичны в их характерном положении.[11] Например, человек цитохромоксидаза реагирует с цитохромом пшеницы c, in vitro; что справедливо для всех пар исследованных видов.[11] Кроме того, окислительно-восстановительный потенциал +0,25 В одинаков для всех цитохромов. c молекулы изучены.[11]
Структура

Цитохром с относится к I классу семейство цитохромов c-типа[13] и содержит характерный аминокислотный мотив CXXCH (цистеин-любой-любой-цистеин-гистидин), который связывает гем.[14]Этот мотив расположен в направлении N-конец из пептид цепи и он содержит гистидин в качестве пятого лиганда гемового железа. Шестой лиганд обеспечивается метионин остаток найден к C-конец. Основа белка складывается в пять частей. α-спирали которые пронумерованы α1-α5 от N-конца до C-конца. Спирали α3, α4 и α5 называются спиралями 50, 60 и 70 соответственно, когда речь идет о митохондриальном цитохроме с.[15]
Heme c
В то время как большинство гемовых белков присоединяются к простетической группе посредством лигирования ионов железа и третичных взаимодействий, гемовая группа цитохрома с образует тиоэфирные связи с двумя цистеин боковые цепи белка.[16] Одним из основных свойств гема с, который позволяет цитохрому с выполнять множество функций, является его способность иметь в природе различные восстановительные потенциалы. Это свойство определяет кинетику и термодинамику реакции переноса электрона.[17]
Дипольный момент
Дипольный момент играет важную роль в ориентации белков в правильном направлении и повышении их способности связываться с другими молекулами.[18][19] Дипольный момент цитохрома с является результатом кластера отрицательно заряженных боковых цепей аминокислот в «задней части» фермента.[19] Несмотря на вариации в количестве связанных гемовых групп и вариации в последовательности, дипольный момент цитохромов c позвоночных заметно сохраняется. Например, цитохромы c позвоночных имеют дипольный момент примерно 320 дебай в то время как цитохромы c растений и насекомых имеют дипольный момент приблизительно 340 дебай.[19]
Функция
Цитохром с входит в состав электронная транспортная цепь в митохондриях. В гем группа цитохрома с принимает электроны от до н.э1 сложный и переносит электроны на комплекс IV. Цитохром c также участвует в инициации апоптоз. При высвобождении цитохрома с в цитоплазму белок связывается фактор активации апоптотической протеазы-1 (Apaf-1).[5]
Цитохром c может также катализировать несколько окислительно-восстановительных реакций, таких как гидроксилирование и ароматный окисление, и показывает пероксидаза активность за счет окисления различных доноров электронов, таких как 2,2-азино-бис(3-этилбензтиазолин-6-сульфоновая кислота) (ABTS), 2-кето-4-тиометилмасляная кислота и 4-аминоантипирин.
Бактериальный цитохром c функционирует как нитритредуктаза.[20]
Роль в апоптозе
Цитохром c был также открыт в 1996 г. Доктор Сяодун Ван играть промежуточную роль в апоптоз, контролируемая форма гибели клеток, используемая для уничтожения клеток в процессе развития или в ответ на инфекцию или повреждение ДНК.[21]
Цитохром c связывается с кардиолипин во внутренней митохондриальной мембране, тем самым закрепляя его присутствие и не давая ему выйти из митохондрий и инициировать апоптоз. В то время как первоначальное притяжение между кардиолипином и цитохромом c является электростатическим из-за чрезвычайно положительного заряда цитохрома c, конечное взаимодействие является гидрофобным, когда гидрофобный хвост кардиолипина вставляется в гидрофобную часть цитохрома c.
Во время ранней фазы апоптоза продукция митохондриальных АФК стимулируется, а кардиолипин окисляется пероксидазной функцией комплекса кардиолипин-цитохром с. Затем гемопротеин отделяется от внутренней митохондриальной мембраны и может экструдироваться в растворимую цитоплазму через поры на внешней мембране.[22]
Устойчивый подъем в кальций уровни предшествуют cyt c выброс из митохондрий. Выделение небольшого количества цит c приводит к взаимодействию с Рецептор IP3 (IP3R) на эндоплазматический ретикулум (ER), вызывая высвобождение кальция ER. Общее повышение уровня кальция вызывает массовое выделение цитокинов. c, который затем действует в петле положительной обратной связи, чтобы поддерживать высвобождение кальция ER через IP3R.[23] Это объясняет, как высвобождение кальция из ER может достигать цитотоксических уровней. Этот выпуск цитохрома с, в свою очередь, активирует каспаза 9, цистеин протеаза. Затем Caspase 9 может активировать каспаза 3 и каспаза 7, которые несут ответственность за разрушение клетки изнутри.
Подавление апоптоза
Один из способов активации апоптоза клеток - высвобождение цитохрома с из митохондрий в цитозоль. Исследование показало, что клетки способны защищать себя от апоптоза, блокируя высвобождение цитохрома c с помощью Bcl-x.L.[24] Другой способ, которым клетки могут контролировать апоптоз, - это фосфорилирование Tyr48, которое превратит цитохром с в антиапоптотический переключатель.[25]
Как антиоксидантный фермент
Известно, что цитохром с играет роль в электронная транспортная цепь и сотовый апоптоз. Однако недавнее исследование показало, что он также может действовать как антиоксидантный фермент в митохондриях; и делает это, удаляя супероксид (O2–) и пероксид водорода (ЧАС2О2) из митохондрии.[26] Следовательно, цитохром c необходим не только в митохондриях для клеточного дыхания, но он также необходим в митохондриях для ограничения производства O2– и H2О2.[26]
Внемитохондриальная локализация
Широко распространено мнение, что цитохром c локализуется исключительно в митохондриальном межмембранном пространстве при нормальных физиологических условиях.[27] Высвобождение цитохрома-с из митохондрий в цитозоль, где он активирует каспаза семья протеазы считается основным триггером, приводящим к началу апоптоза.[28] Измерение количества цитохрома с, просачивающегося из митохондрий в цитозоль и из клетки в культуральную среду, является чувствительным методом контроля степени апоптоза.[29][30] Однако подробные иммуноэлектронные микроскопические исследования срезов тканей крысы с использованием специфичных к цитохрому c антител предоставляют убедительные доказательства того, что цитохром-c в нормальных клеточных условиях также присутствует во внемитохондриальных участках.[31] В ацинарных клетках поджелудочной железы и передний гипофиз, сильное и специфическое присутствие цитохрома-с было обнаружено в зимоген гранулы и в гормон роста гранулы соответственно. В поджелудочной железе цитохром-с также обнаружен в конденсирующейся вакуоли и в ацинаре просвет. Было показано, что экстрамитохондриальная локализация цитохрома c является специфической, поскольку она полностью исчезает при адсорбции первичного антитела очищенным цитохромом c.[31] Присутствие цитохрома-с вне митохондрий в определенном месте при нормальных физиологических условиях поднимает важные вопросы, касающиеся его клеточной функции и механизма транслокации.[31] Помимо цитохрома с, внемитохондриальная локализация также наблюдалась для большого количества других белков, включая те, которые кодируются митохондриальной ДНК.[32][33][34] Это повышает вероятность существования пока не идентифицированных специфических механизмов транслокации белков из митохондрий в другие клеточные места назначения.[34][35]
Приложения
Обнаружение супероксида
Цитохром c был использован для обнаружения производства перекиси в биологических системах. По мере образования супероксида количество окисленного цитохрома с3+ увеличивает и снижает цитохром с2+ уменьшается.[36] Однако супероксид часто получают из оксида азота. В присутствии оксида азота восстановление цитохрома с3+ заблокирован.[37] Это приводит к окислению цитохрома с.2+ к цитохрому с3+ к пероксинизотистая кислота, промежуточное соединение, полученное в результате реакции оксида азота и супероксида.[37] Присутствие пероксинитрит или H2О2 и диоксид азота НЕТ2 в митохондриях может быть летальным, так как они нитрат тирозин остатков цитохрома с, что приводит к нарушению функции цитохрома с как переносчика электронов в цепи переноса электронов.[38]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000172115 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000063694 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б «Энтрез Джен: цитохром с».
- ^ Тафани М., Карпинич Н.О., Хёрстер К.А., Пасторино Дж. Г., Шнайдер Т., Руссо М. А., Фарбер Дж. Л. (март 2002 г.). «Высвобождение цитохрома с при активации рецептора Fas зависит от транслокации полноразмерного бид и индукции перехода митохондриальной проницаемости». Журнал биологической химии. 277 (12): 10073–82. Дои:10.1074 / jbc.M111350200. PMID 11790791.
- ^ «Цитохром c - Homo sapiens (человек)». P99999. Консорциум UniProt.
масса 11,749 Дальтон
- ^ Марголиаш Э. (октябрь 1963 г.). «Первичная структура и эволюция цитохрома с». Труды Национальной академии наук Соединенных Штатов Америки. 50 (4): 672–9. Дои:10.1073 / пнас.50.4.672. ЧВК 221244. PMID 14077496.
- ^ Аминокислотные последовательности в белках цитохрома с разных видовадаптировано из Strahler, Arthur; Наука и история Земли, 1997. стр. 348.
- ^ Луркин П.Ф., Стоун Л., Кавалли-Сфорца Л.Л. (2007). Гены, культура и эволюция человека: синтез. Оксфорд: Блэквелл. п. 79. ISBN 978-1-4051-5089-7.
- ^ а б c Страйер Л. (1975). Биохимия (1-е изд.). Сан-Франциско: W.H. Фримен и компания. п.362. ISBN 978-0-7167-0174-3.
- ^ Макферсон А., ДеЛукас Л.Дж. (2015). «Микрогравитационная кристаллизация белка». NPJ Микрогравитация. 1: 15010. Дои:10.1038 / npjmgrav.2015.10. ЧВК 5515504. PMID 28725714.
- ^ Эмблер Р.П. (май 1991 г.). «Вариабельность последовательности бактериальных цитохромов c». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1058 (1): 42–7. Дои:10.1016 / S0005-2728 (05) 80266-X. PMID 1646017.
- ^ Мавриду Д.А., Фергюсон С.Дж., Стивенс Дж.М. (март 2013 г.). «Сборка цитохрома с». IUBMB Life. 65 (3): 209–16. Дои:10.1002 / iub.1123. PMID 23341334. S2CID 32216217.
- ^ Лю Дж., Чакраборти С., Хоссейнзаде П., Ю Й, Тиан С., Петрик И., Бхаги А., Лу И (2014-04-23). «Металлопротеины, содержащие цитохромные, железо-серные или окислительно-восстановительные центры меди». Химические обзоры. 114 (8): 4366–4469. Дои:10.1021 / cr400479b. ISSN 0009-2665. ЧВК 4002152. PMID 24758379.
- ^ Кан Х, Кэри Дж (ноябрь 1999 г.). «Роль гема в структурной организации цитохрома с, исследуемого методом полусинтеза». Биохимия. 38 (48): 15944–51. Дои:10.1021 / bi9919089. PMID 10625461.
- ^ Чжао Ю., Ван З.Б., Сюй Дж.Х. (январь 2003 г.). "Влияние цитохрома с на образование и удаление O2– и H2О2 в митохондриях ». Журнал биологической химии. 278 (4): 2356–60. Дои:10.1074 / jbc.M209681200. PMID 12435729.
- ^ Коппенол WH, Марголиаш Э (апрель 1982 г.). «Асимметричное распределение зарядов на поверхности цитохрома c лошади. Функциональные последствия». Журнал биологической химии. 257 (8): 4426–37. PMID 6279635.
- ^ а б c Коппенол WH, Раш Д.Д., Миллс Д.Д., Марголиаш Э. (июль 1991 г.). «Дипольный момент цитохрома с». Молекулярная биология и эволюция. 8 (4): 545–58. Дои:10.1093 / oxfordjournals.molbev.a040659. PMID 1656165.
- ^ Шнайдер Дж, Кронек PM (2014). «Глава 9: Производство аммиака мультигемными цитохромами c». В Kroneck PM, Torres ME (ред.). Металлическая биогеохимия газообразных соединений окружающей среды. Ионы металлов в науках о жизни. 14. Springer. С. 211–236. Дои:10.1007/978-94-017-9269-1_9. ISBN 978-94-017-9268-4. PMID 25416396.
- ^ Лю X, Ким CN, Ян Дж, Джеммерсон Р., Ван X (июль 1996 г.). «Индукция апоптотической программы в бесклеточных экстрактах: потребность в дАТФ и цитохроме с». Клетка. 86 (1): 147–57. Дои:10.1016 / S0092-8674 (00) 80085-9. PMID 8689682. S2CID 12604356.
- ^ Оррениус С., Животовский Б. (сентябрь 2005 г.). «Окисление кардиолипина освобождает цитохром с». Природа Химическая Биология. 1 (4): 188–9. Дои:10.1038 / nchembio0905-188. PMID 16408030. S2CID 45381495.
- ^ Бенинг Д., Паттерсон Р.Л., Седагат Л., Глебова Н.О., Куросаки Т., Снайдер С.Х. (декабрь 2003 г.). «Цитохром c связывается с рецепторами инозитола (1,4,5) трифосфата, усиливая кальций-зависимый апоптоз». Природа клеточной биологии. 5 (12): 1051–61. Дои:10.1038 / ncb1063. PMID 14608362. S2CID 27761335.
- ^ Харбанда С., Пандей П., Скофилд Л., Исраэльс С., Рончинске Р., Йошида К., Бхарти А., Юань З. М., Саксена С., Вейксельбаум Р., Налин С., Куфе Д. (июнь 1997 г.). «Роль Bcl-xL как ингибитора накопления цитозольного цитохрома С в апоптозе, вызванном повреждением ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 94 (13): 6939–42. Дои:10.1073 / пнас.94.13.6939. ЧВК 21263. PMID 9192670.
- ^ Гарсиа-Эредиа Дж. М., Диас-Кинтана А., Сальсано М., Орзаэс М., Перес-Пая Е., Тейшейра М., Де ла Роса М. А., Диас-Морено I (декабрь 2011 г.). «Фосфорилирование тирозина превращает щелочной переход в биологически значимый процесс и заставляет цитохром с человека действовать как антиапоптотический переключатель». Журнал биологической неорганической химии. 16 (8): 1155–68. Дои:10.1007 / s00775-011-0804-9. PMID 21706253. S2CID 24156094.
- ^ а б Bowman SE, Bren KL (декабрь 2008 г.). «Химия и биохимия гема c: функциональные основания для ковалентного связывания». Отчеты о натуральных продуктах. 25 (6): 1118–30. Дои:10.1039 / b717196j. ЧВК 2654777. PMID 19030605.
- ^ Neupert W (1997). «Импорт белка в митохондрии». Ежегодный обзор биохимии. 66: 863–917. Дои:10.1146 / annurev.biochem.66.1.863. PMID 9242927.
- ^ Кремер Г., Даллапорта Б., Реш-Ригон М. (1998). «Регулятор митохондриальной смерти / жизни при апоптозе и некрозе». Ежегодный обзор физиологии. 60: 619–42. Дои:10.1146 / annurev.physiol.60.1.619. PMID 9558479.
- ^ Лу Дж. Ф., Лау П. М., Хо ХП, Конг СК (октябрь 2013 г.). «Анализ биострих-кода на основе аптамера с амплификацией изотермической рекомбиназной полимеразы для обнаружения цитохрома-с и скрининга противораковых лекарств». Таланта. 115: 159–65. Дои:10.1016 / j.talanta.2013.04.051. PMID 24054573.
- ^ Waterhouse NJ, Trapani JA (июль 2003 г.). «Новый количественный анализ высвобождения цитохрома с в апоптотических клетках». Гибель клеток и дифференциация. 10 (7): 853–5. Дои:10.1038 / sj.cdd.4401263. PMID 12815469.
- ^ а б c Солтис Б.Дж., Эндрюс Д.В., Джеммерсон Р., Гупта Р.С. (2001). «Цитохром-C локализуется в секреторных гранулах поджелудочной железы и передней доли гипофиза». Cell Biology International. 25 (4): 331–8. Дои:10.1006 / cbir.2000.0651. PMID 11319839. S2CID 2106599.
- ^ Гупта Р.С., Рамачандра Н.Б., Боуз Т., Сингх Б. (2008). «Необычное расположение в клетках митохондриальных молекулярных шаперонов Hsp60, Hsp70 и Hsp10». Биология внеклеточных молекулярных шаперонов. Симпозиум Фонда Новартис. Симпозиумы Фонда Новартис. 291. С. 59–68, обсуждение 69–73, 137–40. Дои:10.1002 / 9780470754030.ch5. ISBN 978-0-470-75403-0. PMID 18575266.
- ^ Садачаран С.К., Сингх Б., Боуз Т., Гупта Р.С. (ноябрь 2005 г.). «Локализация митохондриальной ДНК, кодируемой субъединицами I и II цитохром с оксидазы, в гранулах зимогена поджелудочной железы крысы и гранулах гормона роста гипофиза». Гистохимия и клеточная биология. 124 (5): 409–21. Дои:10.1007 / s00418-005-0056-2. PMID 16133117. S2CID 24440427.
- ^ а б Солтыс Б.Дж., Гупта Р.С. (2000). Митохондриальные белки в неожиданных клеточных местоположениях: экспорт белков из митохондрий с эволюционной точки зрения. Международный обзор цитологии. 194. С. 133–96. Дои:10.1016 / s0074-7696 (08) 62396-7. ISBN 978-0-12-364598-2. PMID 10494626.
- ^ Солтыс Б.Дж., Гупта Р.С. (май 1999 г.). «Белки митохондриального матрикса в неожиданных местах: экспортируются ли они?». Тенденции в биохимических науках. 24 (5): 174–7. Дои:10.1016 / s0968-0004 (99) 01390-0. PMID 10322429.
- ^ МакКорд Дж. М., Фридович И. (ноябрь 1969 г.). «Супероксиддисмутаза. Ферментативная функция эритрокупреина (гемокупреина)». Журнал биологической химии. 244 (22): 6049–55. PMID 5389100.
- ^ а б Томсон Л., Трухильо М., Теллери Р., Ради Р. (июнь 1995 г.). «Кинетика цитохрома с2+ окисление пероксинитритом: значение для измерений супероксида в биологических системах, производящих оксид азота ". Архивы биохимии и биофизики. 319 (2): 491–7. Дои:10.1006 / abbi.1995.1321. PMID 7786032.
- ^ Domazou AS, Gebicka L, Didik J, Gebicki JL, van der Meijden B, Koppenol WH (апрель 2014 г.). «Кинетика реакции диоксида азота с железом (II) - и цитохромом железа (III) с». Свободная радикальная биология и медицина. 69: 172–80. Дои:10.1016 / j.freeradbiomed.2014.01.014. PMID 24447894.
дальнейшее чтение
- Кумарсвами Р., Чандна С. (февраль 2009 г.). «Предполагаемые партнеры в Bax-опосредованном высвобождении цитохрома-c: ANT, CypD, VDAC или ни один из них?». Митохондрия. 9 (1): 1–8. Дои:10.1016 / j.mito.2008.10.003. PMID 18992370.
- Скулачев В.П. (февраль 1998 г.). «Цитохром с в апоптотических и антиоксидантных каскадах». Письма FEBS. 423 (3): 275–80. Дои:10.1016 / S0014-5793 (98) 00061-1. PMID 9515723. S2CID 10267410.
- Маннелла CA (1998). «Конформационные изменения в белке митохондриального канала, VDAC, и их функциональные последствия». Журнал структурной биологии. 121 (2): 207–18. Дои:10.1006 / jsbi.1997.3954. PMID 9615439.
- Ферри KF, Jacotot E, Blanco J, Esté JA, Kroemer G (2000). «Митохондриальный контроль гибели клеток, индуцированной белками, кодируемыми ВИЧ-1». Летопись Нью-Йоркской академии наук. 926: 149–64. Дои:10.1111 / j.1749-6632.2000.tb05609.x. PMID 11193032. S2CID 21997163.
- Бриттон Р.С., Лестер К.Л., Бэкон Б.Р. (октябрь 2002 г.). «Железная токсичность и хелатотерапия». Международный журнал гематологии. 76 (3): 219–28. Дои:10.1007 / BF02982791. PMID 12416732. S2CID 22572183.
- Хайдер Н., Нарула Н., Нарула Дж. (Декабрь 2002 г.). «Апоптоз при сердечной недостаточности представляет собой запрограммированное выживание клеток, а не смерть кардиомиоцитов и вероятность обратного ремоделирования». Журнал сердечной недостаточности. 8 (6 Прил.): S512–7. Дои:10.1054 / jcaf.2002.130034. PMID 12555167.
- Кастедо М., Перфеттини Дж. Л., Андрео К., Румье Т., Пьячентини М., Кремер Дж. (Декабрь 2003 г.). «Апоптоз митохондрий, индуцированный оболочкой ВИЧ-1». Летопись Нью-Йоркской академии наук. 1010: 19–28. Дои:10.1196 / анналы.1299.004. PMID 15033690. S2CID 37073602.
- Ng S, Smith MB, Smith HT, Millett F (ноябрь 1977 г.). «Влияние модификации отдельных лизинов цитохрома c на реакцию с цитохромом b5». Биохимия. 16 (23): 4975–8. Дои:10.1021 / bi00642a006. PMID 199233.
- Линч С.Р., Шерман Д., Коупленд Р.А. (январь 1992 г.). «Связывание цитохрома с влияет на конформацию цитохрома а в цитохром с оксидазе». Журнал биологической химии. 267 (1): 298–302. PMID 1309738.
- Гарбер Э.А., Марголиаш Э. (февраль 1990 г.). «Взаимодействие цитохрома с с цитохром с оксидазой: понимание перехода от высокого к низкому сродству». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1015 (2): 279–87. Дои:10.1016 / 0005-2728 (90) 90032-У. PMID 2153405.
- Bedetti CD (май 1985 г.). «Иммуноцитохимическая демонстрация цитохром с оксидазы с помощью метода иммунопероксидазы: специфическое окрашивание митохондрий в фиксированных формалином и залитых парафином тканях человека». Журнал гистохимии и цитохимии. 33 (5): 446–52. Дои:10.1177/33.5.2580882. PMID 2580882.
- Танака Ю., Асикари Т., Шибано Ю., Амачи Т., Йошизуми Н., Мацубара Н. (июнь 1988 г.). «Конструирование человеческого гена цитохрома c и его функциональная экспрессия в Saccharomyces cerevisiae». Журнал биохимии. 103 (6): 954–61. Дои:10.1093 / oxfordjournals.jbchem.a122393. PMID 2844747.
- Эванс М.Дж., Скарпулла Р.К. (декабрь 1988 г.). «Ген соматического цитохрома с человека: два класса обработанных псевдогенов разграничивают период быстрой молекулярной эволюции». Труды Национальной академии наук Соединенных Штатов Америки. 85 (24): 9625–9. Дои:10.1073 / пнас.85.24.9625. ЧВК 282819. PMID 2849112.
- Пассон П.Г., Халтквист Д.Е. (июль 1972 г.). «Растворимая цитохром b 5 редуктаза из эритроцитов человека». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 275 (1): 62–73. Дои:10.1016/0005-2728(72)90024-2. HDL:2027.42/34070. PMID 4403130.
- Доу Р. Дж., Вителло Л. Б., Эрман Дж. Э. (август 1984 г.). «Исследования седиментационного равновесия по взаимодействию между цитохромом с и цитохромом с пероксидазой». Архивы биохимии и биофизики. 232 (2): 566–73. Дои:10.1016/0003-9861(84)90574-5. PMID 6087732.
- Мишель Б., Босхард HR (август 1984 г.). «Спектроскопический анализ взаимодействия между цитохромом с и цитохром с оксидазой». Журнал биологической химии. 259 (16): 10085–91. PMID 6088481.
- Брогер C, Налец MJ, Аззи A (октябрь 1980 г.). «Взаимодействие цитохрома с с комплексом цитохрома bc1 дыхательной цепи митохондрий». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 592 (3): 519–27. Дои:10.1016/0005-2728(80)90096-1. PMID 6251869.
- Смит Х.Т., Ахмед А.Дж., Миллет Ф. (май 1981 г.). «Электростатическое взаимодействие цитохрома с с цитохромом с1 и цитохромоксидазой». Журнал биологической химии. 256 (10): 4984–90. PMID 6262312.
- Герен Л. М., Миллет Ф. (октябрь 1981 г.). «Исследования переноса энергии флуоресценции при взаимодействии адренодоксина и цитохрома с». Журнал биологической химии. 256 (20): 10485–9. PMID 6270113.
- Фавр Б., Зольнерович С., Туровски П., Хеммингс Б.А. (июнь 1994 г.). «Каталитическая субъединица протеинфосфатазы 2A карбоксиметилирована in vivo». Журнал биологической химии. 269 (23): 16311–7. PMID 8206937.
- Гао Б., Айзенберг Е., Грин Л. (июль 1996 г.). «Влияние конститутивной полимеризации белка теплового шока 70 кДа на его взаимодействие с белковым субстратом». Журнал биологической химии. 271 (28): 16792–7. Дои:10.1074 / jbc.271.28.16792. PMID 8663341.
внешняя ссылка
| Викискладе есть медиафайлы по теме Цитохром с. |
- Белок цитохрома с
- Апоптоз и каспаза 3 - PMAP Карта протеолиза-анимация
- Цитохром + с в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P99999 (Цитохром c) в PDBe-KB.