WikiDer > Дигидролипоил трансацетилаза
Дигидролипоил трансацетилаза (или дигидролипоамидацетилтрансфераза) является фермент компонент мультиэнзима пируватдегидрогеназный комплекс. Комплекс пируватдегидрогеназы отвечает за декарбоксилирование пирувата шаг, который связывает гликолиз к цикл лимонной кислоты. Это предполагает преобразование пируват из гликолиза в ацетил-КоА который затем используется в цикле лимонной кислоты для выполнения клеточное дыхание.
В комплексе пируватдегидрогеназы есть три различных ферментных компонента. Пируватдегидрогеназа (EC 1.2.4.1) отвечает за окисление пирувата, дигидролипоилтрансацетилаза (этот фермент; EC 2.3.1.12) переносит ацетильную группу в коэнзим А (CoA) и дигидролипоилдегидрогеназа (EC 1.8.1.4) регенерирует липоамид. Поскольку дигидролипоилтрансацетилаза является вторым из трех компонентов фермента, участвующих в механизме реакции превращения пирувата в ацетил-КоА, ее иногда называют E2.
У людей ферментативная активность дигидролипоилтрансацетилазы проявляется в компонент комплекса пируватдегидрогеназы E2 (PDCE2), который закодирован DLAT (dихидролипоамид S-ацетилтransferase) ген.[5]
Номенклатура
В систематическое название к этому классу ферментов относится ацетил-КоА: фермент N6- (дигидролипоил) лизин-S-ацетилтрансфераза.
Другие широко используемые имена включают:
- ацетил-КоА: дигидролипоамид S-ацетилтрансфераза,
- ацетил-КоА: фермент 6-N- (дигидролипоил) лизин-S-ацетилтрансфераза.
- дигидролипоамид S-ацетилтрансфераза,
- дигидролипоатацетилтрансфераза,
- дигидролипоевая трансацетилаза,
- дигидролипоилацетилтрансфераза,
- фермент-дигидролипоиллизин: ацетил-КоА S-ацетилтрансфераза,
- липоатацетилтрансфераза,
- липоаттрансацетилаза,
- липоевая ацетилтрансфераза,
- ацетилтрансфераза липоевой кислоты,
- липоевая трансацетилаза,
- липоилацетилтрансфераза,
- тиолтрансацетилаза А и
- трансацетилаза X.
Структура
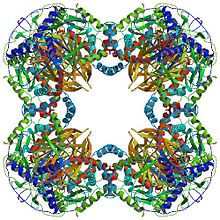
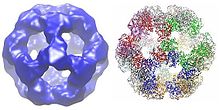
Все дигидролипоилтрансацетилазы имеют уникальную многодоменную структуру, состоящую из (от N до C): 3 липоильных домена, домена взаимодействия и каталитического домена (см. Архитектуру домена на Pfam). Все домены связаны неупорядоченными линкерными областями низкой сложности.
В зависимости от вида, несколько субъединиц ферментов дигидролипоилтрансацетилазы могут объединяться в кубическую или додекаэдрическую форму. Эти структуры затем образуют каталитическое ядро комплекса пируватдегидрогеназы, которое не только катализирует реакцию, которая переносит ацетильную группу на КоА, но также выполняет решающую структурную роль в создании архитектуры всего комплекса.[7]
Куб
Кубическая структура ядра, встречающаяся у таких видов, как Azotobacter vinelandii, состоит из 24 субъединиц.[8][9] Каталитические домены собраны в тримеры с активным центром, расположенным на границе раздела субъединиц. Топология активного центра этого тримера идентична топологии хлорамфениколацетилтрансфераза. Затем восемь из этих тримеров складываются в полый усеченный куб. Два основных субстрата, КоА и липоамид (Lip (SH) 2), находятся у двух противоположных входов в канал длиной 30 Å, который проходит между субъединицами и образует каталитический центр. КоА поступает изнутри куба, а липоамид - снаружи.[10]
Додекаэдр
У многих видов, включая такие бактерии, как Geobacillus stearothermophilus и Enterococcus faecalis [7] а также млекопитающие, такие как люди[11] и коровы,[12] додекаэдрическая структура ядра состоит всего из 60 субъединиц. Субъединицы расположены в наборах по три, аналогично тримерам в форме кубического ядра, причем каждый набор составляет одну из 20 додекаэдрических вершин.
Функция
| дигидролипоиллизин-остаток ацетилтрансферазы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.12 | ||||||||
| Количество CAS | 9032-29-5 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Дигидролипоилтрансацетилаза участвует в реакции декарбоксилирования пирувата, которая связывает гликолиз с циклом лимонной кислоты. Эти метаболические процессы важны для клеточного дыхания - преобразования биохимической энергии из питательных веществ в аденозинтрифосфат (АТФ), который затем можно использовать для проведения множества биологических реакций внутри клетки. Различные части клеточного дыхания происходят в разных частях клетки. У эукариот гликолиз происходит в цитоплазме, декарбоксилирование пирувата в митохондриях, цикл лимонной кислоты в митохондриальном матриксе и окислительного фосфорилирования через электронная транспортная цепь на митохондриальной кристы. Таким образом, пируватдегидрогеназные комплексы (содержащие ферменты дигидролипоилтрансацетилазы) обнаруживаются в митохондриях эукариот (и просто в цитозоле прокариот).
Механизм
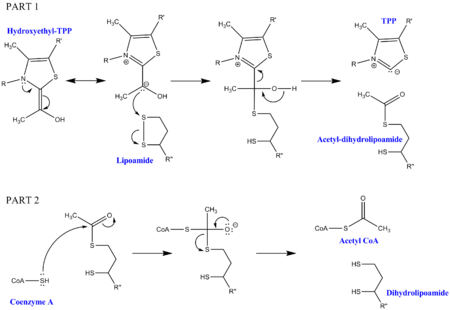
Для декарбоксилирования пирувата требуется несколько кофакторов в дополнение к ферментам, составляющим комплекс. Первый - это пирофосфат тиамина (TPP), который используется пируватдегидрогеназой для окисления пирувата и образования промежуточного продукта гидроксиэтил-TPP. Этот промежуточный продукт поглощается дигидролипоилтрансацетилазой и реагирует со вторым липоамидным кофактором с образованием промежуточного ацетил-дигидролипоила, высвобождая TPP в процессе. Этот второй промежуточный продукт затем может быть атакован нуклеофильной серой, присоединенной к коферменту А, и высвобождается дигидролипоамид. Это приводит к производству ацетил-КоА, что является конечной целью декарбоксилирования пирувата. Дигидролипоамид поглощается дигидролипоилдегидрогеназой, а с дополнительными кофакторами FAD и NAD + регенерирует исходный липоамид (с NADH в качестве полезного побочного продукта).
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Клиническое значение
Первичный билиарный цирроз
Первичный билиарный цирроз (PBC) является аутоиммунное заболевание был характеризован аутоантитела против митохондриальных и ядерных антигенов. Они называются антимитохондриальные антитела (AMA) и антиядерные антитела (ANA) соответственно. Эти антитела обнаруживаются в сыворотках пациентов с ПБЦ и сильно различаются в отношении эпитоп специфичность от пациента к пациенту. Из митохондриальных антигенов, которые могут вызывать реактивность аутоантител у пациентов с ПБЦ, субъединица E2 пируватдегидрогеназного комплекса, дигидролипоилтрансацетилаза, является наиболее распространенным эпитопом (другие антигены включают ферменты комплексов 2-оксокислоты дегидрогеназы, а также другие ферменты пируватдегидрогеназные комплексы).[13] Недавние данные показали, что пептиды в каталитическом сайте могут представлять иммунодоминантные эпитопы, распознаваемые антителами против PDC-E2 у пациентов с ПБЦ.[14] Есть также свидетельства наличия антител против PDC-E2 в аутоиммунный гепатит (AIH) пациенты.[15]
Дефицит пируватдегидрогеназы
Дефицит пируватдегидрогеназы (ПДГ) - это генетическое заболевание, приводящее к лактоацидоз а также неврологическая дисфункция в младенчестве и раннем детстве. Обычно ПДГ является результатом мутации Х-сцепленного гена для субъединицы E1 пируватдегидрогеназного комплекса. Однако было несколько редких случаев, когда у пациента с ПДГ действительно была мутация в аутосомном гене для субъединицы E2. Сообщалось, что у этих пациентов наблюдались гораздо менее серьезные симптомы, причем наиболее ярким проявлением болезни была эпизодическая дистония, хотя оба гипотония и атаксия также присутствовали.[16]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000150768 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000000168 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Леунг П.С., Ватанабе Ю., Муньос С., Тойбер С.С., Пател М.С., Коренберг-младший, Хара П., Коппель Р., Гершвин М.Э. (1993). «Хромосомная локализация и ПДРФ-анализ PDC-E2: основного аутоантигена первичного билиарного цирроза». Аутоиммунитет. 14 (4): 335–40. Дои:10.3109/08916939309079237. PMID 8102256.
- ^ Маттеви А, Обмолова Г, Калк Х., Тепляков А, Хол В.Г. (апрель 1993 г.). «Кристаллографический анализ связывания субстрата и катализа в дигидролипоил трансацетилазе (E2p)». Биохимия. 32 (15): 3887–901. Дои:10.1021 / bi00066a007. PMID 8471601.
- ^ а б c PDB: 1Б5С; Изард Т., Эйварссон А., Аллен М.Д., Вестфаль А.Х., Перхам Р.Н., де Кок А., Хол В.Г. (февраль 1999 г.). «Принципы квазиэквивалентности и евклидовой геометрии управляют сборкой кубических и додекаэдрических ядер комплексов пируватдегидрогеназы». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 96 (4): 1240–5. Bibcode:1999PNAS ... 96.1240I. Дои:10.1073 / pnas.96.4.1240. ЧВК 15447. PMID 9990008.
- ^ де Кок А., Хенгевельд А.Ф., Мартин А., Вестфаль А.Х. (июнь 1998 г.). «Мультиферментный комплекс пируватдегидрогеназы из грамотрицательных бактерий». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1385 (2): 353–66. Дои:10.1016 / S0167-4838 (98) 00079-X. PMID 9655933.
- ^ Hanemaaijer R, Westphal AH, Van Der Heiden T, De Kok A, Veeger C (февраль 1989 г.). «Четвертичная структура дигидролипоилтрансацетилазного компонента пируватдегидрогеназного комплекса из Azotobacter vinelandii. Пересмотр». Европейский журнал биохимии / FEBS. 179 (2): 287–92. Дои:10.1111 / j.1432-1033.1989.tb14553.x. PMID 2917567.
- ^ Маттеви А., Обмолова Г., Шульце Э., Калк К. Х., Вестфаль А. Х., де Кок А., Хол WG (март 1992 г.). «Атомная структура кубического ядра мультиферментного комплекса пируватдегидрогеназы». Наука. 255 (5051): 1544–50. Bibcode:1992Научный ... 255.1544М. Дои:10.1126 / science.1549782. PMID 1549782.
- ^ Brautigam CA, Wynn RM, Chuang JL, Chuang DT (май 2009 г.). «Стехиометрия субъединиц и каталитических компонентов восстановленного in vitro комплекса пируватдегидрогеназы человека». Журнал биологической химии. 284 (19): 13086–98. Дои:10.1074 / jbc.M806563200. ЧВК 2676041. PMID 19240034.
- ^ Чжоу Ж., Маккарти Д. Б., О'Коннор С. М., Рид Л. Дж., Ступс Дж. К. (декабрь 2001 г.). «Замечательная структурная и функциональная организация пируватдегидрогеназных комплексов эукариот». Труды Национальной академии наук Соединенных Штатов Америки. 98 (26): 14802–7. Bibcode:2001PNAS ... 9814802Z. Дои:10.1073 / pnas.011597698. ЧВК 64939. PMID 11752427.
- ^ Маккей И.Р., Уиттингем С., Фида С., Майерс М., Икуно Н., Гершвин М.Э., Роули М.Дж. (апрель 2000 г.). «Своеобразный аутоиммунитет первичного билиарного цирроза». Иммунологические обзоры. 174: 226–37. Дои:10.1034 / j.1600-0528.2002.017410.x. PMID 10807519. S2CID 596338. Архивировано из оригинал на 2013-01-05.
- ^ Браун С., Берг С., Бак С., Грегор М., Кляйн Р. (февраль 2010 г.). «Каталитический домен PDC-E2 содержит эпитопы, распознаваемые антимитохондриальными антителами при первичном билиарном циррозе». Всемирный журнал гастроэнтерологии. 16 (8): 973–81. Дои:10.3748 / wjg.v16.i8.973. ЧВК 2828602. PMID 20180236. Архивировано из оригинал на 2012-03-01.
- ^ О'Брайен С., Джоши С., Фельд Дж. Дж., Гуинди М., Диенес Х. П., Хиткот Э. Дж. (Август 2008 г.). «Долгосрочное наблюдение за антимитохондриальными антителами аутоиммунного гепатита». Гепатология. 48 (2): 550–6. Дои:10.1002 / hep.22380. PMID 18666262. S2CID 5400712.
- ^ Глава Р.А., Браун Р.М., Золкипли З., Шахдадпури Р., Кинг М.Д., Клейтон П.Т., Браун Г.К. (август 2005 г.). «Клинико-генетический спектр недостаточности пируватдегидрогеназы: дефицит дигидролипоамидацетилтрансферазы (E2)». Анналы неврологии. 58 (2): 234–41. Дои:10.1002 / ana.20550. PMID 16049940. S2CID 38264402.
дальнейшее чтение
- Маттеви А, Обмолова Г, Калк Х., Тепляков А, Хол В.Г. (апрель 1993 г.). «Кристаллографический анализ связывания субстрата и катализа в дигидролипоил трансацетилазе (E2p)». Биохимия. 32 (15): 3887–901. Дои:10.1021 / bi00066a007. PMID 8471601.
- Брэди Р.О., Штадтман ER (декабрь 1954 г.). «Ферментативное тиолтрансацетилирование». Журнал биологической химии. 211 (2): 621–9. PMID 13221570.
- Gunsalus IC, Бартон Л.С., Грубер В. (1956). «Биосинтез и строение производных липоевой кислоты». Варенье. Chem. Soc. 78 (8): 1763–1766. Дои:10.1021 / ja01589a079.
- Перхам Р.Н. (2000). «Качающиеся рычаги и качающиеся домены в многофункциональных ферментах: каталитические машины для многоступенчатых реакций». Ежегодный обзор биохимии. 69: 961–1004. Дои:10.1146 / annurev.biochem.69.1.961. PMID 10966480.
- Ховард MJ, Фуллер C, Бродхерст RW, Perham RN, Tang JG, Quinn J, Diamond AG, Yeaman SJ (июль 1998 г.). «Трехмерная структура основного аутоантигена при первичном билиарном циррозе». Гастроэнтерология. 115 (1): 139–46. Дои:10.1016 / S0016-5085 (98) 70375-0. PMID 9649469.
- Мацумура С., Кита Х., Хе XS, Ансари А.А., Лиан З. Х., Ван Де Ватер Дж., Ямамото К., Цуджи Т., Коппель Р. Л., Каплан М., Гершвин М. Е. (ноябрь 2002 г.). «Комплексное картирование HLA-A0201-ограниченных эпитопов CD8 Т-клеток на PDC-E2 при первичном билиарном циррозе». Гепатология. 36 (5): 1125–34. Дои:10.1053 / jhep.2002.36161. PMID 12395322. S2CID 20687454.
- Судзуки Ю., Ёситомо-Накагава К., Маруяма К., Суяма А., Сугано С. (октябрь 1997 г.). «Конструирование и характеристика полноразмерной библиотеки кДНК с обогащением по 5'-концу». Ген. 200 (1–2): 149–56. Дои:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Короткина Л.Г., Пател М.С. (фев 2008). «Связывание пируватдегидрогеназы с ядром пируватдегидрогеназного комплекса человека». Письма FEBS. 582 (3): 468–72. Дои:10.1016 / j.febslet.2007.12.041. ЧВК 2262399. PMID 18206651.
- Глава Р.А., Браун Р.М., Золкипли З., Шахдадпури Р., Кинг М.Д., Клейтон П.Т., Браун Г.К. (август 2005 г.). «Клинико-генетический спектр недостаточности пируватдегидрогеназы: дефицит дигидролипоамидацетилтрансферазы (E2)». Анналы неврологии. 58 (2): 234–41. Дои:10.1002 / ana.20550. PMID 16049940. S2CID 38264402.
- Богданос Д.П., Парес А., Баум Х., Кабаллерия Л., Ригопулу Е.И., Ма Y, Берроуз А.К., Родес Дж., Вергани Д. (июнь 2004 г.). «Специфическая для заболевания перекрестная реактивность между пептидами, имитирующими белок теплового шока Mycobacterium gordonae, и доминантным эпитопом субъединицы E2 пируватдегидрогеназы распространена у испанских, но не у британских пациентов с первичным билиарным циррозом». Журнал аутоиммунитета. 22 (4): 353–62. Дои:10.1016 / яут.2004.03.002. PMID 15120760.
- Ллео А., Селми К., Инверницци П., Подда М., Коппель Р.Л., Маккей И.Р., Горс Г.Дж., Ансари А.А., Ван де Уотер Дж., Гершвин М.Э. (март 2009 г.). «Апотопы и билиарная специфичность первичного билиарного цирроза» (PDF). Гепатология. 49 (3): 871–9. Дои:10.1002 / hep.22736. HDL:2434/55031. ЧВК 2665925. PMID 19185000.
- Беллуччи Р., Ортелт С., Галлахер М., Ли С., Цорн Е., Веллер Е., Порчерей Ф., Алиеа Е. П., Сойфер Р. Дж., Мунши Н. С., Гершвин М. Е., Ритц Дж. (Март 2007 г.). «Дифференциальное картирование эпитопов антител к PDC-E2 у пациентов с гематологическими злокачественными новообразованиями после аллогенной трансплантации гемопоэтических стволовых клеток и первичного билиарного цирроза». Кровь. 109 (5): 2001–7. Дои:10.1182 / кровь-2006-06-030304. ЧВК 1801041. PMID 17068145.
- Хиромаса Y, Roche TE (сентябрь 2003 г.). «Облегченное взаимодействие между изоформой 2 киназы пируватдегидрогеназы и дигидролипоилацетилтрансферазой». Журнал биологической химии. 278 (36): 33681–93. Дои:10.1074 / jbc.M212733200. PMID 12816949.
- Трынка Г., Жернакова А., Романос Дж., Франке Л., Хант К. А., Тернер Дж., Брюненберг М., Хип Г. А., Платтил М., Райан А. В., де Ковель С., Холмс Г. К., Хоудл П. Д., Уолтерс-младший, Сандерс Д. С., Малдер К. Дж., Мерин ML, Verbeek WH, Trimble V, Stevens FM, Kelleher D, Barisani D, Bardella MT, McManus R, van Heel DA, Wijmenga C (август 2009 г.). «Варианты риска, связанные с глютеновой болезнью, в TNFAIP3 и REL предполагают изменение передачи сигналов NF-kappaB». Кишечник. 58 (8): 1078–83. Дои:10.1136 / гут.2008.169052. PMID 19240061. S2CID 17111427.
- Хиромаса Ю., Фудзисава Т., Асо Ю., Roche TE (февраль 2004 г.). «Организация ядер комплекса пируватдегидрогеназы млекопитающих, образованного E2 и E2 плюс E3-связывающим белком, и их способность связывать компоненты E1 и E3». Журнал биологической химии. 279 (8): 6921–33. Дои:10.1074 / jbc.M308172200. PMID 14638692.
- Кори CF (1981). «Глюкозо-молочно-кислотный цикл и глюконеогенез». Актуальные темы регулирования сотовой связи. 18: 377–87. Дои:10.1016 / B978-0-12-152818-8.50028-1. ISBN 9780121528188. PMID 7273846.
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Туганова А., Булатников И., Попов К.М. (август 2002 г.). «Взаимодействие между отдельными изоферментами киназы пируватдегидрогеназы и внутренним липоилсодержащим доменом трансацетилазного компонента пируватдегидрогеназного комплекса». Биохимический журнал. 366 (Пт 1): 129–36. Дои:10.1042 / BJ20020301. ЧВК 1222743. PMID 11978179.
внешняя ссылка
- PDB: 1EAA, PDB: 1dpb
- Дигидролипоил + трансацетилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P10515 (Дигидролипоилтрансацетилаза) на PDBe-KB.