WikiDer > Открытие и развитие триптанов
Триптаны это слово обычно используется для обозначения класса противомигрень препараты селективного действия 5-гидрокситриптамин / серотонин1B / 1D (5-HT1B / 1D) агонисты.[1] Мигрень это сложный болезнь которым страдают около 15% населения и могут быть очень тяжелыми.[2]Триптаны имеют преимущества перед эрготамин и дигидроэрготамин, например, выборочный фармакология, хорошо зарекомендовавшие себя показатели безопасности и доказательный инструкция по применению. Поэтому триптаны часто являются предпочтительным средством лечения мигрени.[1]
История
Поиск нового препарата против мигрени начался в Glaxo в 1972 году. Исследования 1960-х годов показали, что вазоконстрикция из 5-HT, эрготамина и норадреналин может уменьшить приступы мигрени. Исследования также показали, что тромбоцит Уровень 5-HT снижается при мигрени. Поскольку у 5-HT слишком много побочных эффектов, чтобы использовать его в качестве лекарства, ученые начали исследования рецепторы 5-HT с целью открытия и разработки более специфического агониста рецепторов 5-HT. Исследования рецепторов 5-HT и их влияния привели к открытию нескольких типов и подтипов 5-HT. AH24167 показал расширение сосудов эффект вместо сужения сосудов из-за действия агониста на другой тип 5-HT рецепторов, позже получивший название 5-HT7. AH25086 был вторым разработанным соединением, показавшим вазоконстрикционный эффект, но не был выпущен как лекарство из-за низкого перорального приема. биодоступность. Продолжение исследований привело к открытию первого препарата триптана, суматриптан, который обладал как вазоконстрикционным эффектом, так и лучшей пероральной биодоступностью. Суматриптан был впервые запущен в продажу в Нидерландах в 1991 году и стал доступен в Соединенных Штатах в 1993 году.[3]
Механизм
Триптаны являются специфическими и селективными агонистами 5-HT1 рецепторы. Суматриптан[4] связывается с 5-HT1D рецепторы, золмитриптан,[5] ризатриптан,[6] наратриптан,[7] алмотриптан,[8] и фроватриптан[9] связывается с 5-HT1B / 1D и элетриптан[10] связывается с 5-HT1B / 1D / 1F рецепторы. Считается, что триптаны оказывают свое действие посредством сужения сосудов, что приводит к снижению кровообращения в сонных артериях, не влияя на церебральный кровоток, ингибирование периферических нейронов или ингибирование передачи через нейроны второго порядка тригеминоцервикального комплекса. [1]
Рецепторы
5-HT рецепторы все Рецепторы, сопряженные с G-белком (GPCR) кроме 5-HT3 который является лигандный ионный канал. Рецепторы, которые, как было установлено, участвуют в мигрени, - это 5-HT.1B, 5-HT1D и 5-HT1F рецепторы. 5-HT1B обнаружены в менингеальных артериях, агонизм 5-HT1B вызывает вазоконстрикцию черепных нервов. 5-HT1D рецепторы расположены в основном в тройничном нерве в Центральная нервная система (ЦНС). Они также встречаются в гладкие мышцы сосудов, опосредуя сокращение. Агонизм 5-HT1D рецепторы подавляют высвобождение нервных стимуляторов, вызывающих воспаление. В аминокислоты способствуют связыванию лигандов с рецептором: аспарагиновая кислота (Asp), фенилаланин (Phe), серин (Сер), треонин (Thr), триптофан (Trp) и тирозин (Тюр). Было показано, что как 5-HT1B и 5-HT1D рецепторы у людей имеют очень похожие структуры аминокислот, что демонстрирует сходство в связывающих свойствах.[11][12][13]
Дизайн
Все триптаны имеют индол структура идентична нейротрансмиттер 5-НТ. Классическая триптановая структура содержит боковую цепь на индольном кольце и основной азот на таком же расстоянии от индольной структуры. Основное структурное различие триптанов - это положение сульфонамида и присоединенной к нему боковой цепи (см. Рисунок 1 и таблицу 1). Ризатриптан и золмитриптан вместо сульфонамида имеют триазол и 2-оксазолидон соответственно. Другое исключение из классической структуры наблюдается в элетриптане, где азот-алкильная цепь, связанная с индольным кольцом, заменена диметил-пирролидином, и в наратриптане, где азот-алкильная цепь заменена на 1-метилпиперидиновое кольцо.
Одна из боковых цепей фроватриптана образует с индолом дополнительное кольцо, в результате чего карбазол кольцевая система.
Структуры триптанов
| Триптан | р1 | р2 | Триптан | р1 | р2 |
|---|---|---|---|---|---|
| Суматриптан | 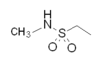 |  | Элетриптан |  |  |
| Ризатриптан |  |  | Наратриптан |  |  |
| Алмотриптан |  |  | Фроватриптан |  |  |
| Золмитриптан |  |  | – | – | – |
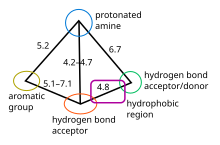
5-HT1B / D фармакофор

5-HT1B и 5-HT1D рецепторы считаются очень похожими, они разделяют аминокислоты гомология и их лиганды выставлять аналогичные свойства привязки, таким образом, они фармакофор. Модель фармакофоров для этих рецепторов-лигандов является качественной и определяет относительное положение важных групп. Он определяется следующими пятью основными характеристиками: ароматическая группа (обычно индол), протонированный амин (донор водородной связи), акцептор водородной связи, дополнительный сайт водородной связи (как донор, так и акцептор) и гидрофобная область, расположенная между ними водородная связь сайты, см. рисунок 2.[11][14] Был сделан вывод, что основными точками связывания являются протонированный амин и сайт водородной связи. Было обнаружено, что область двойной связи в индоле необходима для агонизма в этом ряду соединений. На рисунке 3 показано, как разные препараты подходят для фармакофоров с C- и N-связанными аналогами 5-HT.1D агонист. Отмеченные на рисунке сайты отвечают за родство.[14][15] Фармакофор можно охарактеризовать как амфипатический, это означает, что в структуре есть гидрофобный и гидрофильный группы.[16]
Соответствующие структурные особенности триптанов и связывание с рецептором
Триптановые структуры были созданы на основе структуры 5-HT для достижения сродства к рецепторам 5-HT, следовательно, идентичная структура индола. Гидроксильная группа (-ОН) в гексане ядра индола и боковой цепи алкиламина в положении C3 на 5-HT были заменены другими соединениями, такими как сульфонамиды или производные со структурой азольного кольца и различными амино-алкильными боковыми цепями. Электроотрицательная группа может образовывать водородную связь с Thr в кармане рецептора. Производные сульфонамида, присоединенные к гексановому кольцу структуры индола, обладают электроотрицательными свойствами, так же как триазол и 2-оксазолидон на ризатриптане и золмитриптане соответственно. Это может увеличить связывающую способность соединения и эффективность, особенно с 5-HT.1D рецептор.[11]
Схематическое изображение связывания суматриптана с 5-HT1D рецептор можно увидеть на рисунке 4. Одно исследование[11] показали, что суматриптан лучше подходит для сайта связывания рецептора, когда боковая цепь с протонированным атомом азота загибается назад по структуре индола. Это выравнивание способствует образованию водородных связей между азотом в сульфонамине и Ser138 в месте привязки. Это также способствует образованию водородной связи между кислородом сульфонамина и Thr202. Другое связывание в кармане сайта связывания происходит с атомом азота в пентеновом кольце индольной структуры триптана и аминокислоты. Ser352. Это энергетически выгодное положение агониста делает возможным дополнительное связывание лиганда с другими Сер в месте связывания, вместе с дополнительной фиксацией между Phe в кармане сайта связывания и индол агониста. Связывание Phe а триптан вызывается π-стэкинг-взаимодействиями индола и аминокислоты, а дополнительный эффект на это взаимодействие обусловлен диспергирующим действием аминокислоты лейцин (Leu; не показано на рисунке 4). Аминокислоты Trp343 и Tyr346 оба имеют богатые электронами π-системы в своих ароматических структурах. Благодаря своему положению в сайте связывания они создают своего рода ароматическую клетку вокруг протонированного атома азота боковой цепи в положении C.3 на триптанах (этот атом азота протонирован в физиологических условиях) и тем самым стабилизирует ионную связь, образованную атомом азота с карбоксилатом на аспарагиновой кислоте. Боковые цепи окружающих аминокислот могут влиять на связывание атома азота, в основном трех Phe может влиять на метильные группы, связанные с атомом азота (не показаны на рисунке 4).[11][12][13]
Элетриптан имеет более высокий близость для рецептора, что, вероятно, является результатом объемных заместителей в структуре.[нужна цитата] Амин протонируется при физиологическом pH, вызывая лучшее поглощение.[16][17] Скорость поглощения агониста различается в зависимости от того, амин в R2 является первичным, вторичным или третичным, но последнее, похоже, дает лучшие результаты. Для R1 заместитель, богатый электронами сульфонамид группы и амидная группа показала лучшие результаты в рецепторном связывании и активности.[16] Было замечено, что существует взаимосвязь между абсорбцией и размером молекулы, поэтому более крупные гидрофильные молекулы имеют тенденцию к плохому всасыванию. Маленький R1 заместитель необходим для поддержания быстрой пероральной биодоступности триптанов.[15]
Поместив электроноакцепторную группу или большую группу в положение C2 в структуре индола агонист 5-HT превращается в антагонист. Считается, что это происходит потому, что индольное кольцо не может занимать ароматическую часть сайта связывания.[12]
Триптановые препараты
Свойства составов
Суматриптан был первым лекарством в этом классе. Вскоре стали доступны триптаны второго поколения, такие как золмитриптан, наратриптан, ризатриптан, алмотриптан, элетриптан и фроватриптан.[18]Доступны разные триптаны в разных составы и в разной силе (см. таблицу 2). Они были сформулированы как подкожные инъекции, устный таблетки, перорально распадающиеся таблетки, назальный спрей и как ректальный суппозитории. Система доставки триптанов может играть важную роль в начале действия. Подбор препарата против мигрени при пациенты зависит от их симптомов. Первый селективный 5-HT1B / 1D агонист суматриптан был сначала синтезирован в виде подкожных инъекций, затем в виде таблеток для перорального применения, а в последнее время в виде назального спрея, он также доступен в некоторых странах в виде суппозиториев. Подкожная инъекция - самый быстрый способ остановить быстро прогрессирующий приступ мигрени. Назальный спрей суматриптан обеспечивает более быстрое начало действия, чем таблетки, но вызывает аналогичную головную боль через 2 часа. Некоторые пациенты предпочитают назальный спрей, поскольку он действует быстрее, чем таблетки, и в нем не так много побочные эффекты как подкожная инъекция. Назальный спрей подходит не всем пациентам, потому что некоторые пациенты испытывают неприятный вкус и непостоянство реакции. Золмитриптан был разработан с стратегия для создания более липофильного сложный, с более быстрым поглощение и лучшая способность пересечь гематоэнцефалический барьер чем суматриптан. В некоторых странах он доступен в виде таблеток, таблеток, распадающихся при пероральном введении, и в виде назального спрея. Ризатриптан доступен в виде таблеток и таблеток, распадающихся при пероральном введении, но наратриптан, алмотриптан, элетриптан и фроватриптан пока доступны только в таблетках.[19]
| Универсальный | Составы[19] | Дозы (мг)[19] | Максимум суточная доза (мг)[19] | Начало действия (мин)[20] | Продолжительность действия[20] | Сродство (pKI в нМ) | Метаболизм[21] | Экскреция[20] |
|---|---|---|---|---|---|---|---|---|
| Суматриптан | Таблетки | 25, 50, 100 | 200 | короткий | 7.9–8.5 | МАО-А | Моча (57%), | |
| Золмитриптан | Таблетки | 2.5, 5 | 10 | 45 | короткий | 9.2 | CYP1A2 | Моча (65%), |
| Наратриптан | Таблетки | 1, 2.5 | 5 | 60–180 | Длинный | 8.3 | CYPа | Моча |
| Ризатриптан | Таблетки | 5, 10 | 30 | 30–120 | короткий | 7.7 | МАО-А | Моча |
| Алмотриптан | Таблетки | 6.25, 12.5 | 25 | 60–180 | короткий | 7.8 | МАО-А | Моча (40%), |
| Элетриптан | Таблетки | 20, 40 | 80 | <60[23] | – | 8.9 | CYP3A4 | – |
| Фроватриптан | Таблетки | 2.5 | 7.5 | 60–120 | Длинный | 8.4 | CYP1A2 | Моча (40%) |
а О конкретном ферменте пока не сообщается.
В Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) 15 апреля 2008 г. одобрило новый препарат, который представляет собой комбинацию суматриптана 85 мг и напроксен 500 мг (НПВП).[24]Триптаны и НПВП действуют по разному механизму, участвующему в мигрени, и поэтому могут предложить улучшенное лечение при совместном применении.[25]
Фармакокинетика
Фармакокинетический свойства (см. таблицу 3) важны при разработке новых лекарств.[26]
Пациенты стремятся к быстрому началу действия, чтобы облегчить головную боль. Относительно короткий тМаксимум, хорошая биодоступность и липофильность являются фармакокинетическими свойствами, которые связаны с быстрым началом действия. Было высказано предположение, что хорошая способность преодолевать гематоэнцефалический барьер и относительно длинный терминальный период полувыведения может снизить частоту повторения головной боли. Суматриптан и ризатриптан подвергаются метаболизм в печени первого прохождения и приводит к более низкой биодоступности.[18]
| Универсальный | Биодоступность (%)[26] | Липофильность[19] | Протеин привязка (%)[20] | т1/2 (час)[26] | тМаксимум (час)[22] | Clр (мл мин-1)[27] | Журнал DpH7,4[28] | VD[20] |
|---|---|---|---|---|---|---|---|---|
| Суматриптан | 14 | Низкий | 10–21 | 2–2.5 | 2–2.5 | 260 | -1.5 | 2,4–3,3 л / кг |
| Золмитриптан | 40 | Умеренный | 25 | 3 | 2 | 193 | -1.0 | 7,0 л / кг |
| Наратриптан | 63 (м) / 74 (ж) | Высоко | 28–31 | 5–6 | 2–3 | 220 | -0.2 | 2,4 л / кг |
| Ризатриптан | 47 | Умеренный | 14 | 2–2.5 | 1.3 | 414 | -0.7 | 140 (м) / 110 (ж) л |
| Алмотриптан | 69 | – | 35 | 3.6 | 1.4–3.8 | – | -2.1 | 180–200 л |
| Элетриптан | 50 | Высоко | 85[10] | 4–5 | 1–2 | 597 | 0.5 | 138 л[10] |
| Фроватриптан | 24 (м) / 30 (ж) | Низкий | 20–30 | 25[18][26] | 2–4 | 216 (М) / 132 (Ж)[9] | -1.0[29] | 4,2 (M) / 3,0 (F) л / кг |
т1/2 = Период полувыведения;тМаксимум = Время достижения пиковой концентрации лекарственного средства в плазме;Clр = Почечный клиренс;LogDpH7,4 = Измерение липофильности при pH 7,4. Увеличение числа указывает на большую растворимость;VD = Объем распределения
M = Мужской; F = Женский
Будущие исследования
Большинство триптанов были разработаны и внедрены в 1990-х годах. Дальнейшие исследования не показали многообещающих результатов в отношении разработки новых триптанов с большей продолжительностью действия, эффективностью и профилем безопасности. Следовательно, маловероятно, что будут разработаны дальнейшие варианты, и новые препараты от мигрени, вероятно, будут иметь другой механизм действия.[29]
Рекомендации
- ^ а б c Ferrari, M.D .; Goadsby, P.J .; Roon, K. I .; Липтон, Р. Б. (2002), «Триптаны (серотонин, агонисты 5-HT1B / 1D) при мигрени: подробные результаты и методы метаанализа 53 исследований», Цефалгия, 22 (8): 633–658, Дои:10.1046 / j.1468-2982.2002.00404.x, PMID 12383060, заархивировано из оригинал на 2012-12-17
- ^ Гоудсби, Питер Дж. (2006), «Последние достижения в понимании механизма, молекул и терапии мигрени», Тенденции в молекулярной медицине, 13 (1): 39–44, Дои:10.1016 / j.molmed.2006.11.005, PMID 17141570
- ^ Хамфри, Патрик П.А. (2007), «Открытие нового класса препаратов для лечения острой мигрени», Головная боль, 47 [Приложение 1]: 10–19, Дои:10.1111 / j.1526-4610.2007.00672.x, PMID 17425704[мертвая ссылка]
- ^ "Имигран Таблетки 50 мг Имигран Таблетки 100 мг". Получено 2008-11-09.
- ^ "Зомиг Таблетки 2,5 мг". Получено 2008-11-09.
- ^ «Maxalt 5 мг, 10 мг таблетки, Maxalt Melt 10 мг пероральных липофилизатов». Архивировано из оригинал на 2008-05-02. Получено 2008-11-09.
- ^ «Нарамиг Таблетки 2,5 мг». Получено 2008-11-09.
- ^ «Аксерт». Получено 2008-11-09.
- ^ а б «Мигард». Получено 2008-11-09.
- ^ а б c «Релпакс - 20 мг и 40 мг». Получено 2008-11-09.
- ^ а б c d е Бремнер, DH; Ринган, Н.С.; Wishart, G (1997), "Моделирование сайта связывания агониста серотонина человеческого 5-HT".1А, 5-HTDα и 5-HTDβ рецепторы », Европейский журнал медицинской химии, 32 (1): 59–69, Дои:10.1016 / S0223-5234 (97) 84362-0
- ^ а б c Боярски, Анджей Дж. (2006), "Фармакофорные модели для метаботропных лигандов рецепторов 5-HT", Актуальные темы медицинской химии, 6 (18): 2005–2026, Дои:10.2174/156802606778522186, PMID 17017971
- ^ а б Терзиоглу, Налан; Höltje, Hans-Dieter (2005), "3D QSAR-анализ серотонина 5-HT на основе рецепторов.1D агонисты рецепторов », Сборник чехословацких химических сообщений, 70 (9): 1482–1492, Дои:10.1135 / cccc20051482
- ^ а б c Букингем, Джанет; Глен, Роберт С .; Хилл, Алан П .; Хайд, Ричард М .; Martin, Graeme R .; Робертсон, Алан Д.; Woollard, Патрик М. (1995). «Компьютерный дизайн и синтез 5-замещенных триптаминов и их фармакология на рецепторе 5-HT1D: открытие соединений с потенциальными свойствами против мигрени». Журнал медицинской химии. 38 (18): 3566–3580. Дои:10.1021 / jm00018a016.
- ^ а б Jandu, K. S .; Barrett, V .; Brockwell, M .; Cambridge, D .; Farrant, D. R .; Фостер, С .; Селвуд, Д. Л. (2001). «Открытие 4- [3- (транс-3-диметиламиноциклобутил) -1H-индол-5-илметил] - (4S) -оксазолидин-2-она (4991W93), частичного агониста рецептора 5HT1B / 1D и потенциального ингибитора Электроиндуцированная плазменная экстравазация ". Журнал медицинской химии. 44 (5): 681–693. Дои:10.1021 / jm000956k.
- ^ а б c Ченг, Цзыцян; Лю, Хоуфу; Ю, На; Ван, Фэй; Ань, банда; Сюй, Ян; Айртон, Эндрю (2012). «Гидрофильные триптаны против мигрени являются субстратами для OATP1A2, переносчика, экспрессируемого через гематоэнцефалический барьер человека». Ксенобиотика. 42 (9): 880–890. Дои:10.3109/00498254.2012.675455. PMID 22509823.
- ^ Стрит, Лесли Дж .; Бейкер, Раймонд; Castro, Jose L .; Chambers, Mark S .; Гиблин, Александр Р .; Хоббс, Сара С .; Пиво, Маргарет С. (1993). «Синтез и серотонинергическая активность 5- (оксадиазолил) триптаминов: сильные агонисты рецепторов 5-HT1D». Журнал медицинской химии. 36 (11): 1529–1538. Дои:10.1021 / jm00063a003. PMID 8496922.
- ^ а б c Mathew, Ninan T .; Лодер, Элизабет В. (2005), «Оценка триптанов», Американский журнал медицины, 118 (12): 28–35, Дои:10.1016 / j.amjmed.2005.09.014, PMID 16356805
- ^ а б c d е Бигал, Марсело Э .; Бордини, Карлос А .; Antoniazzi, Ana L .; Speciali, Хосе Дж. (2003), «Составы триптана, критическая оценка» (PDF), Arquivos de Neuro-Psiquiatria, 61 (2A): 313–320, Дои:10.1590 / с0004-282x2003000200032, PMID 12806521
- ^ а б c d е "Обзор класса лекарств: пероральный 5HT1 Агонисты рецепторов » (PDF). Департамент США по делам ветеранов. Архивировано из оригинал (PDF) на 2009-01-14. Получено 2008-11-03.
- ^ Armsterong, Scott C .; Козза, Келли Л. (2002), «Триптаны», Психосоматика, 43 (6): 502–504, Дои:10.1176 / appi.psy.43.6.502, PMID 12444236, заархивировано из оригинал на 2003-07-12
- ^ а б c d е Рапопорт, Алан М .; Теппер, Стюарт Дж .; Шефтелл, Фред Д .; Кунг, Эдна; Бигал, Марсело Э. (2006), «Какой триптан для какого пациента?», Неврологические науки, 27: 123–129, Дои:10.1007 / s10072-006-0586-у, PMID 16688615
- ^ Färkkilä, M .; Dalhlöf, C .; Stovner, L.J .; Bruggen, J.P ter; Rasmussen, S .; Muirhead, N .; Sikes, C .; Сайкс, C (2003), «Элетриптан для лечения мигрени у пациентов с предыдущей плохой реакцией или переносимостью перорального суматриптана», Цефалгия, 23 (6): 463–471, Дои:10.1046 / j.1468-2982.2003.00554.x, PMID 12807526, заархивировано из оригинал на 2012-12-17
- ^ «пресс-релиз - таблетки Treximet (суматриптан и напроксен натрия) одобрены FDA для лечения острых приступов мигрени». GlaxoSmithKline. Архивировано из оригинал на 2008-12-04. Получено 2008-11-09.
- ^ Смит, Тимоти Р .; Саншайн, Авраам; Старк, Стюарт Р .; Литтлфилд, Дайан Э .; Spruill, Susan E .; Александр, В. Джеймс (2005), «Суматриптан и натрий напроксен для острого лечения мигрени», Головная боль, 45 (8): 983–991, Дои:10.1111 / j.1526-4610.2005.05178.x, PMID 16109111, заархивировано из оригинал на 2012-12-18
- ^ а б c d Jhee, Stanford S .; Шиовиц, Томас; Crawford, AAron W .; Катлер, Нил Р. (2001), "Фармакокинетика и фармакодинамика триптановых противомигреневых агентов", Клиническая фармакокинетика., 40 (3): 189–205, Дои:10.2165/00003088-200140030-00004, PMID 11327198
- ^ Saxena, Pramod R .; Тфельт-Хансен, Пер (2001), «Успех и неудача триптанов», Журнал головной боли и боли, 2: 3–11, Дои:10.1007 / с101940170040
- ^ Паскуаль, Хулио; Муньос, Педро (2005), «Корреляция между липофильностью и результатами триптанов», Головная боль, 45 (1): 3–6, Дои:10.1111 / j.1526-4610.2005.05003.x, PMID 15663606[мертвая ссылка]
- ^ а б Ламберт, Джеффри А. (2005), «Доклиническая нейрофармакология Наратриптана», Обзоры препаратов для ЦНС, 11 (3): 289–316, Дои:10.1111 / j.1527-3458.2005.tb00048.x, ЧВК 6741765, PMID 16389295[мертвая ссылка]