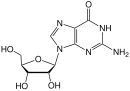
WikiDer > Открытие и разработка нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы
Открытие и развитие нуклеозид и нуклеотид ингибиторы обратной транскриптазы (НИОТ и НИОТ) появились в 1980-х годах, когда СПИД эпидемия ударил по западным обществам. НИОТ подавляют обратная транскриптаза (RT), фермент который контролирует репликацию генетического материала вируса иммунодефицита человека (ВИЧ). Первый НИОТ был зидовудин, одобрено США Управление по контролю за продуктами и лекарствами (FDA) в 1987 году, что стало первым шагом на пути к лечению ВИЧ. За этим последовали шесть НИОТ и один НИОТ. НИОТ и НИОТ являются аналогами эндогенного 2´-дезоксинуклеозида и нуклеотида. Лекарственно устойчивый вирусы являются неизбежным следствием длительного воздействия на ВИЧ-1 препаратов против ВИЧ.
История
Летом 1981 г. впервые было сообщено о синдроме приобретенного иммунодефицита (СПИД).[1] Два года спустя этиологический связь со СПИДом, вирус иммунодефицита человека (ВИЧ) был идентифицирован.[2][3] С момента выявления ВИЧ разработка эффективных антиретровирусных препаратов и научные достижения в исследованиях ВИЧ были огромными.[3][4] Антиретровирусные препараты для лечения ВИЧ-инфекций относятся к шести категориям: нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы, Ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы протеазы, ингибиторы входа, ингибиторы корецепторов и ингибиторы интегразы.[4] Обратная транскриптаза ВИЧ-1 была основной основой для разработки лекарств против ВИЧ.[5] Первым нуклеозидным ингибитором обратной транскриптазы с активностью против ВИЧ in vitro был зидовудин.[6] С тех пор, как зидовудин был одобрен в 1987 году, FDA одобрило шесть нуклеозидов и один нуклеотидный ингибитор обратной транскриптазы (НИОТ).[6] НИОТ, одобренные FDA, - это зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абакавир и эмтрицитабин и единственным одобренным ингибитором нуклеотидной обратной транскриптазы (NtRTI) является тенофовир (см. таблицу 4).[4][6]
Фермент обратной транскриптазы ВИЧ-1
Функция
Большинство стандартных лекарств против ВИЧ основаны на ингибировании фермента обратной транскриптазы (RT), фермента, необходимого для вируса ВИЧ-1 и других ретровирусы завершить свой жизненный цикл.[5] Фермент RT выполняет две ключевые функции. Во-первых, он контролирует репликацию генетического материала вирусов через его полимераза Мероприятия. Он преобразует вирусные одноцепочечные РНК в интеграцию компетентный двухцепочечный ДНК. Впоследствии сгенерированная ДНК переносится в ядро хозяина ячейка где он интегрирован в геном ретровирусной интегразой. Другая роль RT - это его рибонуклеаза H активность, которая разрушает РНК, только когда она находится в гетеродуплекс с ДНК.[7][8]
Структура
ОТ ВИЧ-1 представляет собой асимметричный гетеродимер, который составляет 1000 аминокислота длинный и состоит из двух подразделения. Более крупная субъединица, p66, имеет длину 560 аминокислот и проявляет все ферментативные активности RT.[8] Меньшая субъединица, называемая p51, имеет длину 440 аминокислот и, как считается, стабилизирует гетеродимер, но также может принимать участие в связывании тРНК грунтовка. Субъединица p66 имеет два активных сайта: полимеразу и рибонуклеазу H. Полимераза имеет четыре субдомена, которые были названы «пальцы», «большой палец», «соединение» и «ладонь», так как ее сравнивают с правой рукой.[7][8][9]
Механизм действия
Активация нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы в первую очередь зависит от проникновения в клетку пассивная диффузия или опосредованный носителем транспорт. НИОТ очень гидрофильный и имеют ограниченную проницаемость мембраны, поэтому этот шаг очень важен. НИОТ являются аналогами эндогенный 2´-дезоксинуклеозид и нуклеотид. Они неактивны в своих родительских формах и требуют последовательных фосфорилирование.[6]
Нуклеозиды должны быть трифосфорилированы, тогда как нуклеотиды, которые имеют одну фосфонированную группу, должны быть дифосфорилированы.[10] Этот поэтапный процесс активации происходит внутри клетки и опосредуется скоординированным рядом ферментов.[11] Первый и часто ограничение скорости, стадия фосфорилирования (для аналогов нуклеозидов) чаще всего катализируется дезоксинуклеозидкиназами. Добавление второй фосфатной группы к аналогам нуклеозидмонофосфата завершается нуклеозидмонофосфаткиназами (NMP киназами). Различные ферменты способны катализировать конечную стадию фосфорилирования НИОТ, включая нуклеозиддифосфаткиназу (NDP-киназу), фосфоглицераткиназа, пируваткиназа и креатинкиназа, что приводит к образованию соответствующих антивирусно-активных трифосфат аналоги.[6]В своих соответствующих трифосфатных формах НИОТ и единственный доступный НИОТ конкурируют со своим соответствующим эндогенным дезоксинуклеотидтрифосфатом (дНТФ) за включение в зарождающуюся цепь ДНК (см. Рисунок 1).[6] В отличие от субстрата дНТФ, у НИОТ отсутствует 3´-гидроксильная группа на дезоксирибоза часть. После включения в цепь ДНК отсутствие 3´-гидроксильной группы, которая обычно образует от 5´- до 3´- фосфоэфир связь со следующим нуклеиновая кислота, блокируют дальнейшее удлинение ДНК с помощью RT, и они действуют как терминаторы цепи.[10][12]
Открытие и развитие
Первый шаг к лечению ВИЧ - зидовудин
В 1964 году зидовудин (AZT) был синтезирован Хорвицем в Мичиганском онкологическом фонде. 3´гидроксильная группа в дезоксирибозном кольце тимидина заменена на азидо группа, которая дает нам зидовудин.[13] Отсутствие 3´-гидроксильной группы, которая обеспечивает точку присоединения следующего нуклеотида в растущей цепи ДНК во время обратной транскрипции, делает ее обязательным терминатором цепи. Зидуводин используется вместо тимидина и является чрезвычайно мощным ингибитором ВИЧ. репликация.[14] Это соединение было приготовлено в 1964 году как потенциальное противораковый агент, но оказалась неэффективной.[15] В 1974 году было сообщено о том, что зидовудин обладает активностью против ретровирусов, и впоследствии он был повторно проверен как противовирусный препарат, когда в середине 1980-х годов в западных обществах поразила эпидемия СПИДа.[13][15] Однако зидовудин относительно токсичный так как он превращается в трифосфат клеточными ферментами и, следовательно, активируется в неинфицированных клетках.[14]
Дальнейшее развитие аналогов нуклеозидов
Дидезоксинуклеозиды
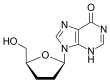
| Дидезоксиаденозин | Диданозин | |
|---|---|---|
| Химическая структура |  |  |
Дидезоксинуклеозиды являются аналогами нуклеозидов, в которых сахарное кольцо лишено как 2´, так и 3´-гидроксильных групп.[9] Через три года после синтез Из зидовудина Джером Хорвиц и его коллеги из Чикаго приготовили еще один дидезоксинуклеозид, ныне известный как зальцитабин (ddC).[16] Зальцитабин - синтетический пиримидин аналог нуклеозида, структурно связанный с дезоксицитидин, в котором 3´-гидроксильная группа рибоза фрагмент сахара замещен водородом.[17] Зальцитабин был одобрен FDA для лечения ВИЧ-1 в июне 1992 г.[3][18]
2´, 3´-дидезоксиинозин или диданозин превращается в дидезоксиаденозин in vivo. Его разработка имеет долгую историю.[19] В 1964 г. дидезоксиаденозин, соответствующий аденозин синтезирован аналог зальцитабина. Дидезоксиаденозин вызвал почка повреждение, поэтому диданозин был получен из дидезоксиаденозина путем ферментативного окисления (см. таблицу 1). Было обнаружено, что он активен против ВИЧ, не вызывая повреждения почек.[16] Диданозин был одобрен FDA для лечения ВИЧ-1 в октябре 1991 года.[18]Зальцитабин и диданозин являются облигатными терминаторами цепи, которые были разработаны для лечения против ВИЧ. К сожалению, у обоих препаратов нет избирательность и поэтому причина побочные эффекты.[14]
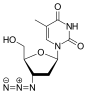
| Зальцитабин | Ламивудин | |
|---|---|---|
| Химическая структура | 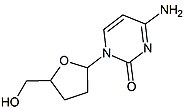 |  |
Дальнейшая модификация дидезокси-каркаса привела к развитию 2´, 3´-дидегидро-3´-дезокситимидина (ставудин, d4T). Было показано, что активность ставудина аналогична активности зидовудина, хотя их паттерны фосфорилирования различаются; тоблизость для зидовудина тимидинкиназа (фермент, ответственный за первое фосфорилирование) аналогичен ферменту тимидин, тогда как близость
для ставудина в 700 раз слабее.[9]
2 ', 3'-дидезокси-3'-тиацитидин (ламивудин, 3TC) был открыт Бернар Белло. История
ламивудина можно проследить до середины 1970-х годов, когда Бернар Белло исследовал сахар производные. Ламивудин был разработан как сера аналог зальцитабина (см. таблицу 2).[16] Первоначально он был синтезирован как рацемический смесь (BCH-189) и анализ показал, что как положительные, так и отрицательные энантиомеры BCH-189 (2 ', 3'-дидезокси-3'-тиацитидин) обладал активностью против ВИЧ in vitro. Ламивудин - отрицательный энантиомер и аналог пиримидинового нуклеозида. 3'-углерод рибозного кольца 2'-дезоксицитидина был заменен атомом серы, поскольку он обладает большей анти-ВИЧ-активностью и менее токсичен, чем положительный энантиомер.[16][20][21]
Следующим на очереди был 2 ', 3'-дидезокси-5-фтор-3'-тиацитидин (эмтрицитабин, FTC), который является структурным гомолог ламивудина. Структурное различие заключается в 5-фтор-модификации основной части ламивудина. Он во многом похож на ламивудин и активен как в отношении ВИЧ-1, так и вируса гепатита В (HBV).[21][22]
Карбоциклический нуклеозид
Карбоциклические аналоги дидезоксиаденозина были исследованы на их активность против ВИЧ. Сначала наблюдалась минимальная активность. Было приготовлено и исследовано множество аналогов нуклеозидов, но только один обладал значительной активностью и удовлетворял требованиям клинический использовать. Это был 2´, 3´-дидегидро аналог дидезоксиаденозина. Вставка циклопропил группа на его 6-амино азот из аденин кольцо увеличилось липофильность и таким образом улучшается проникновение в мозг. Полученное соединение известно как абакавир (см. Таблицу 3).[16] Абакавир был одобрен FDA для использования в терапии инфекций ВИЧ-1 в декабре 1998 года.[20]
Этот препарат является единственным одобренным антиретровирусным препаратом, который действует как гуанозин аналог in vivo. Сначала он монофосфорилируется аденозинфосфотрансферазой, а затем монофосфат превращается в карбовир 3´-монофосфат. Впоследствии он полностью фосфорилируется, и карбовир включается RT в цепь ДНК и действует как терминатор цепи. Карбовир - родственный аналог гуанозина, который плохо перорально биодоступность и поэтому был исключен из клинической разработки.[19]
| Дидезоксиаденозин | Диданозин | Абакавир | |
|---|---|---|---|
| Химическая структура |  |  |  |
Ациклический нуклеотид - единственный одобренный НИОТ
Для аналогов нуклеотидов требуется только две стадии фосфорилирования, тогда как для аналогов нуклеозидов требуется три стадии. Снижение потребности в фосфорилировании может позволить более быстрое и полное превращение лекарств в их активные метаболиты. Такие соображения привели к разработке аналогов фосфонатных нуклеотидов, таких как тенофовир. Тенофовир дизопроксил фумарат (Tenofovir DF) является пролекарство тенофовира. Тенофовир - это ациклическое производное аденозина. Ациклическая природа соединения и его фосфонатная составляющая являются уникальными структурными особенностями среди одобренных НИОТ.[21] Тенофовир DF - это гидролизованный ферментативно к тенофовиру, который проявляет активность против ВИЧ.[23][24] Он был разработан путем синтеза и Широкий спектр противовирусная активность 2,3-дигидроксипропиладенина.[24] Тенофовир DF был первым ингибитором нуклеотидной обратной транскриптазы, одобренным FDA для лечения инфекции ВИЧ-1 в октябре 2001 года.[18][23]
почему таблица съедает заголовок следующего раздела, если здесь ничего не написано?
Сопротивление
В настоящее время появление лекарственно устойчивый вирусы - неизбежное следствие длительного воздействия антиретровирусной терапии на ВИЧ-1. Лекарственная устойчивость - серьезная клиническая проблема при лечении вирусной инфекции, и это особенно сложная проблема при лечении ВИЧ.[25] Мутации устойчивости известны ко всем одобренным НИОТ.[26]
Известны два основных механизма, вызывающих лекарственную устойчивость к НИОТ: вмешательство в процесс включения НИОТ и удаление включенных НИОТ.[26][27] Вмешательство в действие включенных НИОТ включает: мутация в поддомене p66 РТ.[27] Мутация вызывает стерическое препятствие это может исключить включение некоторых лекарств, например ламивудина, во время обратной транскрипции. В случае удаления включенных НИОТ резистентные ферменты легко принимают ингибитор в качестве субстрата для включения в цепь ДНК.[27] Впоследствии фермент RT может удалить включенные НИОТ, обращая полимеризация шаг. Для реакции вырезания требуется донор пирофосфата, который RT присоединяется к NRTI на 3'-конце праймера, вырезая его из праймерной ДНК.[27]Для достижения эффективного ингибирования репликации ВИЧ-1 у пациентов, а также для задержки или предотвращения появления устойчивых к лекарствам вирусов используются комбинации лекарственных препаратов. ВААРТ, также известная как высокоактивная антиретровирусная терапия, состоит из комбинаций противовирусных препаратов, которые включают НИОТ, НИОТ, ненуклеозидные ингибиторы обратной транскриптазы и ингибиторы протеаз.[28]
Текущее состояние
В настоящее время существует несколько НИОТ на разных стадиях клинической и доклинический разработка. Основными причинами продолжения поиска новых НИОТ против ВИЧ-1 являются снижение токсичности, повышение эффективности против резистентных вирусов и упрощение лечения против ВИЧ-1.[6][26][29]
Априцитабин (АТС)
Априцитабин представляет собой аналог дезоксицитидина. Он структурно связан с ламивудином, где позиции кислород и сера по существу обращены.[21] Несмотря на то, что априцитабин немного менее эффективен in vitro по сравнению с некоторыми другими НИОТ, он сохраняет свою активность в отношении широкого спектра вариантов ВИЧ-1 с мутациями устойчивости к НИОТ. Априцитабин находится на заключительной стадии клинической разработки для лечения пациентов, уже прошедших курс НИОТ.[6]
Эльвуцитабин (L-d4FC)
Эльвуцитабин представляет собой аналог дезоксицитидина с активностью против ВИЧ, устойчивый к нескольким другим аналогам нуклеозидов, включая зидовудин и ламивудин.[22] Отчасти это из-за высокого внутриклеточный уровни его трифосфата метаболит достигли в камерах.[6] Клинические испытания эльвуцитабина приостановлены, поскольку он показал: подавление костного мозга у некоторых пациентов с CD4 + количество клеток падает уже через два дня после начала дозирования.[22][29]
Амдоксовир (DAPD)
Амдоксовир является пролекарством аналога гуанозина НИОТ с хорошей биодоступностью.[6][22][29] Он дезаминируется внутриклеточно аденозиндезаминаза к диоксолан гуанин (DXG). DXG-трифосфат, активная форма препарата, обладает большей активностью, чем DAPD-трифосфат.[22] Амдоксовир в настоящее время проходит клинические испытания II фазы.[24][29]
Рацивир (RCV)
Рацивир представляет собой рацемическую смесь двух β-энантиомеров эмтрицитабина (FTC), (-) - FTC и (+) - FTC. Рацивир обладает превосходной биодоступностью при пероральном приеме и имеет то преимущество, что его нужно принимать только один раз в день. Можно считать, что рацивир используется в комбинации с двумя НИОТ, и при использовании в комбинации он показал многообещающую противовирусную активность. Рацивир в настоящее время проходит II фазу клинических испытаний.[6][22][29]
В разработке находятся еще несколько НИОТ. Либо спонсоры подали заявку на Новый исследуемый препарат (IND), заявка была одобрена FDA или препараты находятся на разных этапах клинических испытаний. Некоторые из НИОТ, которые находятся в разработке, обладают различными привлекательными фармакологическими свойствами, которые могут сделать их желательными для лечения пациентов, нуждающихся в новых средствах.[6][22][29]
Смотрите также
- Антиретровирусный препарат
- Открытие и разработка антагонистов рецептора CCR5
- Открытие и разработка ненуклеозидных ингибиторов обратной транскриптазы
- Открытие и разработка ингибиторов протеазы ВИЧ
- Ингибитор обратной транскриптазы
- Ингибитор протеазы
- Ингибитор входа
- Открытие и разработка ингибиторов протеазы ВИЧ
- Открытие и разработка антагонистов рецептора CCR5
Рекомендации
- ^ Merson, M.D .; Майкл, Х. (2006), «Пандемия ВИЧ – СПИДа в 25 лет - Глобальные ответные меры», Медицинский журнал Новой Англии, 354 (23): 2414–2417, Дои:10.1056 / NEJMp068074, PMID 16760441, S2CID 2579436
- ^ Фаузи, А. (1999), «Соображения по поводу эпидемии СПИДа в 21 веке», Медицинский журнал Новой Англии, 351 (14): 1046–1050, Дои:10.1056 / NEJM199909303411406, PMID 10502595
- ^ а б c Фаучи, А. (2003), «ВИЧ и СПИД: 20 лет науки», Природа Медицина, 9 (7): 839–843, Дои:10,1038 / нм0703-839, PMID 12835701, S2CID 5472960, ProQuest 223114463
- ^ а б c Де-Клерк, Э. (2009), «Препараты против ВИЧ: 25 соединений, одобренных в течение 25 лет после открытия ВИЧ», Международный журнал противомикробных агентов, 33 (4): 307–320, Дои:10.1016 / j.ijantimicag.2008.10.010, PMID 19108994
- ^ а б Boyer, P.L .; Coffin, J.M .; Delviks_Frankenberry, K.A .; Hughes, S.H .; Jeren, A .; Николенко, Г.Н .; Патхак, В. (2008), «Мутации субдомена соединения обратной транскриптазы ВИЧ-1 уменьшают деградацию матричной РНК и усиливают удаление AZT», Труды Национальной академии наук Соединенных Штатов Америки, 105 (31): 10943–10948, Bibcode:2008PNAS..10510943D, Дои:10.1073 / pnas.0804660105, ЧВК 2491488, PMID 18667707
- ^ а б c d е ж грамм час я j k л Cihlar, T .; Рэй, А. (2010), «Нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы ВИЧ: 25 лет после зидовудина», Противовирусные исследования, 85 (1): 39–58, Дои:10.1016 / j.antiviral.2009.09.014, PMID 19887088
- ^ а б Herschorn, A .; Hizi (2008), «Ретровирусные обратные транскриптазы (кроме транскриптазы ВИЧ-1 и вируса лейкемии мышей): сравнение их молекулярных и биохимических свойств», Вирусные исследования, 134 (1–2): 203–220, Дои:10.1016 / j.virusres.2007.12.008, PMID 18291546
- ^ а б c Giridhar, R .; Prajapati, D.G .; Ramajayam, R .; Ядав, М.Р. (2009), "Поиск мощных низкомолекулярных ННИОТ: обзор", Биоорганическая и медицинская химия, 17 (16): 5744–5762, Дои:10.1016 / j.bmc.2009.06.060, PMID 19632850
- ^ а б c Андерсон, К. (2007), «Обратная транскрипция пандемии ВИЧ-1», Журнал FASEB, 21 (14): 3795–3808, Дои:10.1096 / fj.07-8697rev, PMID 17639073
- ^ а б Goldschmidt, V .; Марке, Р. (2004), "Разблокирование праймера обратной транскриттазой ВИЧ-1 и устойчивость к нуклеозидным ингибиторам ОТ", Международный журнал биохимии и клеточной биологии, 36 (9): 1687–1705, Дои:10.1016 / j.biocel.2004.02.028, PMID 15183338
- ^ Какуда, Т. (2010), «Фармакология нуклеозидов и нуклеотидов, митохондриальная токсичность, вызванная ингибиторами обратной транскриптазы», Клиническая терапия, 22 (6): 2717–2747, Дои:10.1016 / S0149-2918 (00) 90004-3, PMID 10929917
- ^ Herschorn, A .; Хизи, А. (2010), «Ретровирусные обратные транскриптазы», Клеточные и молекулярные науки о жизни, 67 (16): 2717–2747, Дои:10.1007 / s00018-010-0346-2, PMID 20358252, S2CID 6954555
- ^ а б Снидер, В. (1996), Прототипы лекарств и их использование, John Wileys & sons, стр. 448–450, ISBN 978-0-471-94847-6
- ^ а б c Smith, J .; Уильям, Хиуел (1998), Смит и Уильямс: Введение в принципы разработки и действия лекарств (3-е изд.), Издательство Harwood Academic, стр. 247–250, 486–490, ISBN 978-90-5702-037-7
- ^ а б Сондерс, Дж. (2000), Лучшие наркотики: лучшие синтетические маршруты, стр. 71–75
- ^ а б c d е Снейдер, В. (2005), Открытие наркотиков история, стр. 250–268, ISBN 978-0-471-89979-2
- ^ Георгиев, В. (2009), Национальный институт аллергии и инфекционных заболеваний, NIH, 2, стр. 417–426, Дои:10.1007/978-1-60327-297 (неактивно 01.09.2020), ISBN 978-1-60327-296-4CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ а б c Де-Клерк, Э. (2009), «Препараты против ВИЧ: 25 соединений, одобренных в течение 25 лет после открытия ВИЧ», Международный журнал противомикробных агентов, 33 (4): 307–320, Дои:10.1016 / j.ijantimicag.2008.10.010, PMID 19108994
- ^ а б Brunton, L .; Lazo, J .; Паркер, К. (2006), «Фармакологические основы терапии» Гудмана и Гилмана, одиннадцатое издание, McGraw-Hill, стр. 1280–1292, ISBN 978-0-07-142280-2
- ^ а б Ogden, R.C .; Сковрон, Г. (2006), Ингибиторы обратной транскриптазы в терапии ВИЧ / СПИДа, Humana press inc, стр. 33–63, ISBN 978-1-58829-649-8
- ^ а б c d ЛаФемина, Р.Л. (2009), Стратегии противовирусных исследований при открытии противовирусных препаратов, АМС пресс, стр. 51–70.
- ^ а б c d е ж грамм Отто, М.Дж. (2003 г.), «Новые ингибиторы нуклеозидной обратной транскриптазы для лечения ВИЧ-инфекций», Текущее мнение в фармакологии, 9 (7): 839–843, Дои:10.1016 / j.coph.2004.06.001, PMID 15351346
- ^ а б Fung, H.B .; Piacenti, F.J .; Стоун, Э.А. (2002), «Тенофовир дизопроксил фумарат: ингибитор нуклеотидной обратной транскриптазы для лечения ВИЧ-инфекции», Клиническая терапия, 24 (10): 1515–1548, Дои:10.1016 / S0149-2918 (02) 80058-3, PMID 12462284
- ^ а б c Nguyen-Ba, N .; Рандо, Р.Ф. (2000), «Разработка новых аналогов нуклеозидов для использования против штаммов ВИЧ-1, устойчивых к лекарствам», Открытие наркотиков сегодня, 5 (10): 465–476, Дои:10.1016 / с1359-6446 (00) 01558-0, PMID 11018598
- ^ Arnold, E .; Даса, К .; Hughesc, S.H .; Левиб, П.Дж. (2005), «Кристаллография и дизайн лекарств против СПИДа: конформационная гибкость и позиционная адаптивность важны при разработке ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1» (PDF), Прогресс в биофизике и молекулярной биологии, 88 (2): 209–231, Дои:10.1016 / j.pbiomolbio.2004.07.001, PMID 15572156
- ^ а б c Delviks-Frankenberry, K.A .; Николенко, Г.Н .; Патакар, В. (2010), «Связь между лекарственной устойчивостью ВИЧ и РНКазой H», Вирусы, 2 (7): 1476–1503, Дои:10.3390 / v2071476, ЧВК 2982141, PMID 21088701
- ^ а б c d Кирби, К.А .; Marchand, B .; Michailidis, E .; Sarafianos, S.G .; Сингх, К. (2010), «Структурные аспекты устойчивости к лекарственным препаратам и ингибирования обратной транскриптазы ВИЧ-1», Вирусы, 2 (2): 606–638, Дои:10.3390 / версия 2020606, ЧВК 2850067, PMID 20376302
- ^ Bowling, T.L .; Gu, Z .; L´Heureux, L .; Muys, J.M .; Nguyen-Ba, N .; Rando, R.F .; Вайнберг, М.А. (1999), "Механизм действия и активность in vitro аналогов 1 ', 3'-диоксоланилпурина нуклеозидов против чувствительных и устойчивых к лекарствам вариантов вируса иммунодефицита человека типа 1", Противомикробные препараты и химиотерапия, 43 (10): 2376–2382, Дои:10.1128 / AAC.43.10.2376, ЧВК 89486, PMID 10508010
- ^ а б c d е ж Agrawala, R.K .; Кришнан, П.Н .; Raman, S .; Ravichandran, S .; Веерасами, Р. (2008), «Обзор ингибиторов обратной транскриптазы ВИЧ-1» (PDF), Дайджест журнала наноматериалов и биоструктур, 3 (4): 171–187, архивировано с оригинал (PDF) на 2011-07-20