WikiDer > Пирилиевая соль
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Пирилий | |||
| Другие имена Пиран | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| C5ЧАС5О+ | |||
| Молярная масса | 81,09 г / моль | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
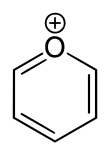
Пирилий это катион (положительный ион) с формулой C
5ЧАС
5О+
, состоящий из шестичленного кольца из пяти углерод атомы, каждый с одним водород атом, и один положительно заряженный кислород атом. Связи в кольце сопряженный как в бензол, дав ему ароматный персонаж. В частности, из-за положительного заряда атом кислорода трехвалентный. Пирилий - это моно-циклический и гетероциклический соединение, один из ионы оксония.
Соли
Пирилий и его производные образуют стабильные соли с различными анионами.[1][2][3][4][5][6]
Производные
Многие важные катионы формально являются производными пирилия путем замещения различных функциональные группы для некоторых или всех атомов водорода в кольце. В 2,4,6-трифенилпирилий, называемая солью Катрицкого (после Алан Р. Катрицки) является важным примером, используемым во многих современных примерах катализируемых металлом поперечные муфты.[7]
Химические свойства
Как и другие ионы оксония, пирилий неустойчив в нейтральной воде. Однако пирилий гораздо менее реакционноспособен, чем обычные ионы оксония, из-за ароматической стабилизации. 2,4,6-трифениловая соль обычно реагирует с алифатический амины в позиции 1, образуя пиридиний соли и активируя их окислительная добавка комплексами металлов, в первую очередь с никель.[8] Катионы пирилия также реагируют с нуклеофилы в положениях 2, 4 и 6, которые могут вызывать различные реакции. Высокая электроотрицательность кислорода приводит к сильному однократному возмущению на один гетероатом в шестичленном кольце.
Синтез
Соли пирилия легко производятся из простых исходных материалов с помощью конденсация реакция.
Пирилиевые соли с ароматическими заместителями, такие как тетрафторборат 2,4,6-трифенилпирилия, могут быть получены из двух молей ацетофенон и одна моль бензальдегид в присутствии тетрафторборная кислота и окислитель (синтез Дильтея). Для солей пирилия с алкильными заместителями, таких как соли 2,4,6-триметилпирилия, лучший метод использует Балабан-Неницеску-Синтез прайля из третичный бутанол и уксусный ангидрид в присутствии тетрафторборной, хлорной или трифторметансульфоновой кислот.[9][10] Соли 2,4,6-трифенилпирилия превращаются основаниями в стабильный 1,5-ендион (псевдоснование), но соли 2,4,6-триметилпирилия при обработке горячими гидроксидами щелочных металлов дают нестабильное псевдоснование, которое подвергается внутримолекулярной конденсации с образованием 3 , 5-диметилфенол. В теплом оксиде дейтерия соли 2,4,6-триметилпирилия претерпевают изотопный обмен 4-метильных атомов водорода быстрее, чем 2- и 6-метильные группы, что позволяет синтезировать региоселективно дейтерированные соединения.
Производные
Реакционная способность солей пирилия по отношению к нуклеофилам делает их полезными материалами для получения других соединений с более сильным ароматическим характером. Пирилиевые соли дают пиридины с аммиак,[11] пиридиний соли с первичными аминами, пиридин-N-оксиды с гидроксиламин, фосфабензолы с фосфин производные, тиопирилий соли с сероводород, и производные бензола с ацетонитрил или же нитрометан.
Пироны
Катион пирилия с гидроксил анион заместитель в позиции 2 не цвиттерионный ароматическое соединение (1), но нейтральный ненасыщенный лактон или 2-пирон или пиран-2-он (2). Важными представителями этого класса являются кумарины. Подобным образом соединение 4-гидроксилпирилия представляет собой γ-пирон или пиран-4-он (4), к какой группе принадлежат такие соединения, как мальтол.
Химические свойства
Известно, что 2-пироны реагируют с алкины в Реакция Дильса – Альдера формировать арена соединения с изгнанием углекислый газ, Например:[12]
Полициклические ионы пирилия
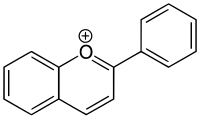
Хроменилий ион
Один бициклический пирилиевый ион называют бензопирилиевым ионом (ИЮПАК: ион хроменилия) (Формула: C
9ЧАС
7О+
, молярная масса: 131,15 г / моль, точная масса: 131.04968983). Его можно рассматривать как заряженную производную 2H-1-бензопиран (ИЮПАК: 2H-хромен) (C
9ЧАС
8О) или (заряженное) замещенное гетероциклическое производное нафталин (C
10ЧАС
8).
Ион флавилия
В биологии ион 2-фенилбензопирилия (2-фенилхроменилий) называется флавилием. Класс производных флавилия: антоцианидины и антоцианы, пигменты, отвечающие за окраску многих цветов.
Катион нафтоксантения
Выше полициклический производные пирилия также существуют. Хороший пример - нафтоксантений. Этот краситель очень стабильный, ароматный и плоский. Он поглощает в УФ и синем диапазоне и обладает исключительными фотофизическими свойствами. Его можно синтезировать химическими или фотохимическими реакциями.[13]
Бензопирилия хлорид (хроменилия хлорид), соль с хлористый как противоион
Смотрите также
- 6-членные ароматические кольца с заменой одного атома углерода другой группой:борабензол, силабензол, гермабензол, станнабензол, пиридин, фосфор, арсабензол, стибабензол, бисмабензол, пирилий, тиопирилий, селенопирилий, теллуропирилий
- Пиран, C
5ЧАС
6О (пироны без кетонной группы)
| Искать пирилий в Викисловаре, бесплатном словаре. |
Рекомендации
- ^ Гилкрист, Т. Гетероциклическая химия. ISBN 0-582-27843-0.
- ^ Балабан, А. Т .; Schroth, W .; Фишер, Г. (1969). Катрицки, А. Р .; Бултон, А. Дж. (Ред.). «Пирилиевые соли. I. Синтез». Достижения в химии гетероциклов. Нью-Йорк: Academic Press. 10: 241–326. Дои:10.1016 / S0065-2725 (08) 60499-7.
- ^ Балабан, А. Т .; Динкулеску, А .; Дорофеенко, Г. Н .; Fischer, G.W .; Коблик, А. В .; Межерицкий, В. В .; Шрот, В. (1982). Катрицки, А. Р. (ред.). Пирилиевые соли. Синтезы, реакции и физические свойства. Успехи химии гетероциклов: Дополнение. 2. Нью-Йорк: Academic Press. ISBN 978-0-12-020652-0.
- ^ Балабан, А. Т. (1979). «Катион пирилия как синтон в органической химии». В Mitra, R. B .; Ayyangar, N.R .; Гогте, В. Н .; Acheson, R.M .; Кромвель, Н. (ред.). Новые тенденции в химии гетероциклов. Исследования по органической химии. 3. Амстердам: Эльзевир. стр.79–111. ISBN 978-0-444-41737-4.
- ^ Балабан, А. Т. (1987). «Пирилиевые соли как полезные синтоны». В Чизове О. (ред.). Органический синтез: современные тенденции. Оксфорд: Блэквелл. С. 263–274. ISBN 0-632-02014-8.
- ^ Balaban, T. S .; Балабан, А. Т. (2003). «Пирилиевые соли». Гетарены и родственные кольцевые системы, шестичленные гетарены с одним халькогеном. Наука синтеза; Методы Губена-Вейля молекулярных превращений. 14. Штутгарт: Георг Тиме Верлаг. С. 11–200. ISBN 978-3-13-118641-6.
- ^ А. Т. Балабан и В. Рэй (1977): "13C ЯМР спектры некоторых солей пирилия и родственных соединений". Органический магнитный резонанс, том 9, выпуск 1, страницы 16-22. Дои:10.1002 / mrc.1270090105
- ^ Пан, Юэ; Мозер, Даниэль; Корнелла, Хосеп (2020). «Пирилиевые соли: селективные реагенты для активации первичных аминогрупп в органическом синтезе». Синтез. 52: 489.
- ^ Балабан, А. Т .; Бултон, А. Дж. (1973). «2,4,6-Триметил-пирилиевый тетрафторборат» (PDF). Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, стр. 1112–1113
- ^ Балабан, А. Т .; Бултон, А. Дж. (1973). «2,4,6-Триметилпирилия трифторметансульфонат» (PDF). Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, стр. 1114–1116
- ^ Андерсон, А.Г .; Стэнг, П. Дж. (1981). «2,6-Ди-терт-Бутил-4-метилпиридин » (PDF). Органический синтез. 60: 34.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 7, п. 144
- ^ Delaney, P.M .; Moore, J.E .; Харрити, Дж. П. А. (2006). "Путь циклоприсоединения алкинилборного эфира к функционализированным ароматическим бороновым эфирам". Химические коммуникации. 2006 (31): 3323–3325. Дои:10.1039 / b607322k.
- ^ Bucher, G .; Bresolí-Obach, R .; Brosa, C .; Flors, C .; Luis, J. L .; Grillo, T. A .; Нонелл, С. (2014). «Тушение β-фенилом 9-фенилфеналенонов: новая реакция фотоциклизации с биологическими последствиями». Физическая химия Химическая физика. 16: 18813–18820. Bibcode:2014PCCP ... 1618813B. Дои:10.1039 / C4CP02783C.