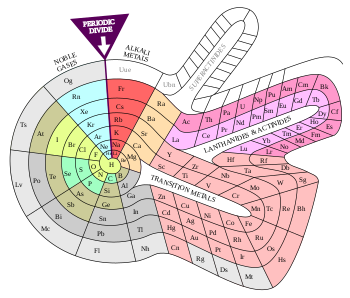
WikiDer > Альтернативные периодические таблицы
| Часть серия на |
| Периодическая таблица |
|---|
Формы периодической таблицы |
По структуре таблицы Менделеева |
Страницы данных для элементов
|
Альтернативные периодические таблицы представляют собой таблицы химические элементы отличаются по своей организации от традиционное изображение периодической системы.[1][2]
Было разработано более тысячи, часто для дидактический Причина в том, что не все корреляции между химическими элементами эффективно фиксируются стандартной периодической таблицей.
Основные альтернативные конструкции
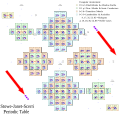
Левая ступенчатая таблица Менделеева (Джанет, 1928)
Чарльз Джанеттаблица Менделеева с левым шагом[3] является наиболее широко используемой альтернативой традиционному изображению периодической системы. Он организует элементы согласно идеализированному орбитальному заполнению (вместо валентность).[4] Например, элементы от Sc до Zn показаны как трехмерный блок, подразумевающий орбитальную занятость [Ar] 4s.2 3DИкс, хотя сейчас известно, что Cr на самом деле имеет орбитальную заселенность [Ar] 4s1 3D5 и Cu имеет [Ar] 4s1 3D10.
| ж1 | ж2 | ж3 | ж4 | ж5 | ж6 | ж7 | ж8 | ж9 | ж10 | ж11 | ж12 | ж13 | ж14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | п1 | п2 | п3 | п4 | п5 | п6 | s1 | s2 | |
| 1 с | ЧАС | Он | ||||||||||||||||||||||||||||||
| 2 с | Ли | Быть | ||||||||||||||||||||||||||||||
| 2p 3 с | B | C | N | О | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4 с | Al | Si | п | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3D 4p 5 с | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В качестве | Se | Br | Kr | Руб. | Sr | ||||||||||||||
| 4d 5p 6 с | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | Компакт диск | В | Sn | Sb | Te | я | Xe | CS | Ба | ||||||||||||||
| 4f 5d 6p 7 с | Ла | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По | В | Rn | Пт | Ра |
| 5f 6d 7p 8 с | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | 119 | 120 |
| f-блок | d-блок | p-блок | s-блок | |||||||||||||||||||||||||||||

По сравнению с обычным макетом, таблица с левым шагом имеет следующие изменения:
- Гелий относится к группе 2 (не к группе 18).
- Группы 1 и 2 (s-блок), включая элементы 119 и 120 в расширенном периоде 8, перемещаются в правую часть таблицы.
- S-блок сдвигается вверх на одну строку, и все элементы, не входящие в s-блок, теперь на одну строку ниже, чем в стандартной таблице. Например, большая часть четвертой строки стандартной таблицы является пятой строкой в этой таблице.
В результате порядок по-прежнему остается неизменным: атомный номер (Z), 1–120.
Двумерная спираль (Бенфей, 1964)
В Теодор БенфейВ периодической таблице элементы образуют двумерную спираль, начинающуюся из водорода и сворачивающуюся вокруг двух полуостровов. переходные металлы, и лантаноиды и актиниды. А суперактинид остров уже вставлен.[5]
Трехмерный, похожий на цветок (Поль Жигер, 1966)
Поль ЖигерТрехмерная таблица Менделеева состоит из четырех связанных рекламных щитов с элементами, написанными на лицевой и оборотной сторонах. На первом рекламном щите элементы группы 1 на фронте и группа 2 элементов сзади, без водорода и гелия. Под углом 90 ° второй рекламный щит содержит группы с 13 по 18 спереди и сзади. Еще два билборда с углами 90 ° содержат остальные элементы.[6][7]
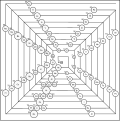
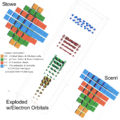
Трехмерный, физический (Тимоти Стоу, 1986)
Периодическая таблица физика Тимоти Стоу является трехмерной с тремя осями, представляющими главное квантовое число, орбитальное квантовое число, и орбитальный магнитное квантовое число.[8][9] Гелий снова элемент группы 2.
Повторяющиеся элементы (Рональд Л. Рич, 2005)
Рональд Л. Рич предложил периодическую таблицу, в которой элементы появляются более одного раза, когда это необходимо.[10] Он отмечает, что водород имеет общие свойства с элементы группы 1 на основе валентность, с участием группа 17 элементов потому что водород - неметалл, но также с углерод группа, основанная на сходстве химической связи с переходными металлами и аналогичными электроотрицательность. В этом исполнении периодической таблицы углерод и кремний также входят в ту же группу, что и титан и цирконий.
АДОМА (Валерий Циммерман, 2006)

Таблица ADOMAH представляет собой адаптацию таблицы левой ступеньки.[12] Каждый строго вертикальный столбец таблицы имеет одинаковое значение главного квантового числа п. Например, п = 3 для Fe. Каждый блок элементов имеет одинаковое значение вторичного квантового числа. л. Например, л = 2 для Fe. Каждая запись элемента вместе со всеми предыдущими элементами соответствует электронная конфигурация этого элемента (за исключением 20 из 118 известных элементов). Например, электронная конфигурация Fe определяется, начиная с H, что составляет 1 с.1и считая в порядке атомных номеров. Это дает конфигурацию 1 с2 2 с2 2p6 3 с2 3p6 4 с2 3D6 или, в краткой форме, [Ar] 4s2 3D6.
Четверка блоки стола Адома можно переставить так, чтобы они помещались на равном расстоянии внутри обычного тетраэдр. Последний, в свою очередь, укладывается в куб.[13]
Другой
Таблица химиков («Newlands Revisited») с альтернативным расположением водорода, гелия и лантаноидов была опубликована EG Marks и JA Marks в 2010 году.[14]
Варианты классической планировки
В исходной периодической таблице Менделеева элементы были в основном расположены по валентности (группы в столбцы) и их повторению (периоды в строках). С годами и с открытиями в атомной структуре эта схема была скорректирована и расширена, но не изменилась в принципе.
Самая старая таблица Менделеева - это Краткая форма таблицу (столбцы I – VIII) по Дмитрий Менделеев, который показывает вторичное химическое родство. Например, щелочных металлов и чеканка металлов (медь, серебро, золото) находятся в одном столбце, потому что обе группы имеют валентность, равную единице. Этот формат до сих пор используется многими, о чем свидетельствует этот современная русская короткая таблица, который включает все элементы и имена элементов до рентгений.
Г. Г. Деминг использовал так называемый длинная таблица Менделеева (18 столбцов) в своем учебнике «Общая химия», который впервые появился в США в 1923 г. (Wiley) и первым обозначил первые две и последние пять основных групп буквой «А», и промежуточные переходные группы с обозначением «B».
Нумерация была выбрана так, чтобы характеристические оксиды групп В соответствовали таковым из групп А. Группы железа, кобальта и никеля не были обозначены ни A, ни B. Группа благородных газов первоначально была прикреплена (Демингом) к левой стороне периодической таблицы. Позже группа была переведена на правую сторону и обычно обозначена как группа VIIIA.
Расширение таблицы Менделеева
в расширенная таблица Менделеева, предложено Гленн Т. Сиборг в 1969 г., неизвестные элементы включены до атомный номер 168. Добавляются теоретические периоды сверх обычного периода 7.
В области исследований суператомыкластеры атомов обладают свойствами отдельных атомов другого элемента. Предлагается расширить периодическую таблицу с помощью второго слоя, который будет занят этими кластерные соединения. Последним дополнением к этой многоэтажной таблице является алюминий кластерный ион Al−
7, который ведет себя как поливалентный германий атом.[15]
В октябре 2020 года ученые сообщили о неэмпирическом способе представления чисел Менделеева и организации химического пространства.[16][17][18]
Галерея
Рекомендации
- ^ Э. Р. Шерри. Периодическая таблица, ее история и ее значение. Oxford University Press, Нью-Йорк, 2006 г., ISBN 0195345673.
- ^ Генри Бент. Новые идеи в химии из свежей энергии для Периодического закона. АвторДом, 2006, ISBN 978-1-4259-4862-7.
- ^ "Периодическая таблица левой ступени". 1928. Получено 2014-02-15.
- ^ Стюарт, Филип Дж. (2009). «Чарльз Джанет: непризнанный гений периодической системы». Основы химии. 12: 5–15. Дои:10.1007 / s10698-008-9062-5. S2CID 171000209.
- ^ Таблица Бенфея фигурирует в статье Гленна Сиборга «Плутоний: элемент ужаса», Химия, Июнь 1964 г., 37 (6), 12–17, на с. 14.
- ^ Мазурс, Э. Г. (1974). Графические изображения периодической системы за сто лет. Алабама: Университет Алабамы Press. п. 111. ISBN 978-0-8173-3200-6.
- ^ Анимированное изображение периодической таблицы Жигера, широко доступное в Интернете (включая Вот) ошибочна, так как не включает водород и гелий. Жигер включал водород, а не литий, и гелий, а не бериллий. См. Giguère P. A. (1966). «Новый взгляд на периодическую систему». Химия в Канаде т. 18 (12): 36–39 (см. Стр. 37).
- ^ Стоу, Тимоти. "Периодическая таблица физика 1989". jeries.rihani.com. Получено 24 сентября 2019.
Таблица химических элементов физика
- ^ Брэдли, Дэвид (20 июля 2011 г.). "Наконец-то окончательная периодическая таблица?". Chemviews. ChemistryViews.org. Дои:10.1002 / chemv.201000107. Получено 24 сентября 2019.
- ^ Рич, Рональд Л. (2005). «Являются ли некоторые элементы более равными, чем другие?». J. Chem. Образовательный. 82 (12): 1761. Bibcode:2005JChEd..82.1761R. Дои:10.1021 / ed082p1761.
- ^ Клэнси, Кристина; и другие. (2010). Химия 11. Канада: Макгроу-Хилл Райерсон. п. 28. ISBN 978-007091575-6.
- ^ Лич, М. Р. "Периодическая таблица ADOMAH Валерия Циммермана". Интернет-база данных периодических таблиц. Получено 29 июля, 2019.; Стюарт, П. Дж. (2010). «Шарль Джанет: непризнанный гений периодической системы». Основы химии. 12 (1): 5–15. Дои:10.1007 / s10698-008-9062-5. S2CID 171000209.
- ^ Стюарт, П. (2018). «Любители и профессионалы химии: на примере таблицы Менделеева». В Scerri, E .; Рестрепо, Г. (ред.). От Менделеева до Оганессона: мультидисциплинарный взгляд на периодическую таблицу. Нью-Йорк: Издательство Оксфордского университета. С. 66–79 (76–77). ISBN 978-0-190-66853-2.; Лич, М. Р. "Стеклянный куб с периодической таблицей ADOMAH". Интернет-база данных периодических таблиц. Получено 1 августа, 2019.
- ^ Marks, E. G .; Маркс, Дж. А. (2010). «Новый взгляд на Ньюлендс: демонстрация периодичности химических элементов для химиков». Основы химии. 12: 85–93. Дои:10.1007 / s10698-010-9083-8.
- ^ Амато, Иван (21 ноября 2006 г.). «За пределами периодической таблицы. Металлические кластеры имитируют химические свойства атомов». Новости химии и машиностроения.
- ^ Норман, Ник (26 ноября 2020 г.). «Периодическая таблица: ученые предлагают новый способ упорядочивания элементов». Разговор. Получено 28 ноября, 2020.
- ^ Болл, Филипп (18 ноября 2020 г.). «Новый порядок элементов может помочь найти материалы с многообещающими свойствами». Мир химии. Получено 28 ноября, 2020.
- ^ Аллахьян, Захед; Оганов Артем Р. (20 октября 2020 г.). «Неэмпирическое определение чисел Менделеева: организация химического пространства». Журнал физической химии. 124 (43): 23867–23878. Дои:10.1021 / acs.jpcc.0c07857. Получено 28 ноября, 2020.
дальнейшее чтение
- Обзор известных тогда таблиц 1974 года считается окончательной работой по этой теме:[1] Мазурс, Э.Г. Графические представления периодической системы за сто лет. Алабама; University of Alabama Press, 1974 г., ISBN 0-8173-3200-6.
- Хьёрланд, Биргер (2011). Таблица Менделеева и философия классификации. Организация знаний, 38 (1), 9–21.
внешняя ссылка
- Представление Периодической таблицы различными способами сайт, курируемый Сетью знаний Ассоциации выпускников Университета штата Мичиган
- Современная спиральная периодическая таблица Роберта Харрисона
- Периодическая таблица левой ступени Джанет
- Поправка к периодической таблице физиков, предложенная Джерисом Рихани так как Мейтнерий занимает позицию, что Калий должен иметь.
- Связанная статья об альтернативных периодических таблицах
- Подборка периодических таблиц
- http://periodicspiral.com/ размещает периодическую таблицу в (гексагональной) спирали.
- Rotaperiod.com Новая таблица Менделеева.
- Примечание по топологии футболки Z-спирали.
- Новая Периодическая таблица элементов это в квадратно-треугольной периодической конфигурации.
- Таблица Менделеева на основе электронные конфигурации
- База данных периодических таблиц
- Периодический фрактал элементов
- Периодическая таблица элементов Боба Дойла Перегруппировка по свойствам, используемая для лучшего объяснения группировки электронов
- Периодическая таблица исследователя Земли
- ^ Кауфман, Джордж Б. (1975). «Графические изображения периодической системы за сто лет (Мазурс, Эдвард Г.)». Журнал химического образования. 52 (9): A436. Дои:10.1021 / ed052pA436.1.