WikiDer > Фактор D
| фактор комплемента D (адипсин) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | CFD | ||||||
| Альт. символы | DF, PFD | ||||||
| Ген NCBI | 1675 | ||||||
| HGNC | 2771 | ||||||
| OMIM | 134350 | ||||||
| RefSeq | NM_001928 | ||||||
| UniProt | P00746 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 19 p13.3 | ||||||
| |||||||
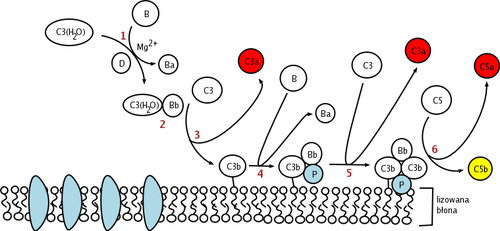
Фактор D (ЕС 3.4.21.46, Проактиватор C3 конвертазы, Пропердин фактор D эстераза, фактор D (дополнение), фактор дополнения D, CFD, адипсин) а белок который у человека кодируется CFD ген.[3] Фактор D участвует в альтернативный путь комплемента из система комплемента где он раскалывается фактор B.
Функция
В белок кодируемый этим геном, является членом трипсин семья пептидазы. Кодируемый белок является компонентом альтернативный путь комплемента наиболее известен своей ролью в гуморальном подавлении инфекционных агентов. Этот белок также является сериновой протеазой, которая секретируется адипоциты в кровоток. Наконец, кодируемый белок имеет высокий уровень экспрессии в жире, что предполагает роль жировой ткани в биологии иммунной системы.[3]
Фактор D представляет собой сериновую протеазу, которая стимулирует транспорт глюкозы для накопления триглицеридов в жировых клетках и ингибирует липолиз.[4]
Клиническое значение
Уровень фактора D снижен[5] у страдающих ожирением это снижение может быть связано с высокой активностью или резистентностью, но точная причина полностью не известна.
Структура
Все члены химотрипсин семья сериновые протеазы имеют очень похожие структуры. Во всех случаях, включая фактор D, существует два антипараллельных β-ствол домены, каждый ствол которых содержит шесть β-цепей с одинаковой типологией для всех ферментов. Основное различие в структуре скелета между фактором D и другими сериновыми протеазами семейства химотрпсина заключается в поверхностном петли соединение второстепенных элементов конструкции. Фактор D демонстрирует различные конформации основных каталитических и связывающих субстрат остатков, обычно обнаруживаемых в семействе хротрипсина. Эти особенности предполагают, что каталитическая активность фактора D запрещена, если конформационные изменения не вызваны перестройкой.[6]
Механизм действия
Фактор D представляет собой сериновую протеазу, присутствующую в крови и тканях в активной последовательности, но самоингибирующейся конформации. Единственным известным природным субстратом фактора D является фактор B, и расщепление Arg234-Lys235 ножничная связка в Факторе B приводит к двум фрагментам Фактора B, Ba и Bb. Прежде чем может произойти разрыв ножницеобразной связи в факторе B, фактор B должен сначала связываться с C3b до образования комплекса C3bB.[7] Предполагается, что это конформационное изменение фактора B в комплексе C3bB позволяет фактору B соответствовать сайту связывания фактора D.
Каталитическая триада фактора D состоит из Asp.102, Его57 и Сер195. Другими ключевыми компонентами фактора D являются Asp.189-Arg218 солевой мостик, который стабилизирует петлю самоингибирования (аминокислотные остатки с 212 по 218) и His57 боковая цепь в неканонической конформации.[8][9] В своей ингибированной форме самоингибирующая петля предотвращает доступ фактора B к фактору D. Когда комплекс C3bB приближается к самоингибированной конформации фактора D, C3bB замещает солевой мостик в факторе D и приводит к новому солевому мостику. между Арг234 фактора B и Asp189 фактора D.[10][11] Смещение солевого мостика фактора D приводит к перестройке самоингибиторной петли и вращению гистидиновой боковой цепи активного сайта, создавая каноническую форму фактора D. Затем следует расщепление ножницеобразной связи в факторе B с высвобождением фрагмента. Ba и образуя C3bBb, альтернативный путь C3-конвертаза.[12]
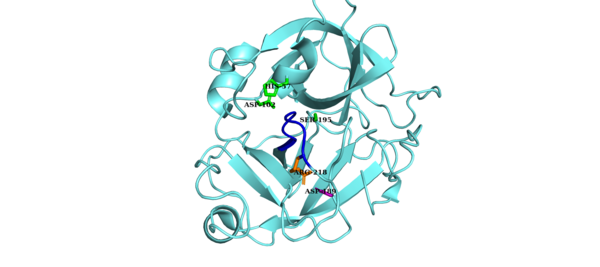 В неканоническая конформация Фактора D ингибируется петлей самоингибирования (синий). Солевой мостик Asp-Arg (пурпурные и оранжевые боковые цепи соответственно) стабилизирует петлю самоингибирования. Каталитическая триада показана зеленым цветом.[13] |  В каноническая конформация Фактора D не ингибируется. Солевой мостик Asp-Arg (пурпурная и оранжевая боковые цепи соответственно) был смещен, что привело к смещению петли самоингибирования (синий). Каталитическая триада показана зеленым цветом.[14] |
Регулирование
Фактор D синтезируется печенью и адипоцитами, причем последние являются основным источником. Секретируемая проформа фактора D расщепляется MASP-3 с образованием активной последовательности, которая циркулирует в организме.[15] Фактор D поддерживает чрезвычайно высокую субстратную специфичность и, как следствие, не имеет известных природных ингибиторов в организме.[16] Однако большая часть фактора D остается в самоингибированной форме, которая ограничивает доступ субстрата к каталитическому сайту. Фактор D имеет молекулярную массу 23,5 кДа и присутствует в концентрации 1,8 мг / л крови у здоровых людей. Скорость синтеза фактора составляет приблизительно 1,33 мг / кг / день, и большая часть фактора D выводится через почки после катаболизма в организме человека. проксимальные канальцы после реабсорбции. Чистый эффект - высокая фракционная скорость метаболизма 60% в час.[17] У пациентов с нормальной функцией почек фактор D в моче не обнаруживался. Однако у пациентов с почечной недостаточностью уровень фактора D был повышен. Альтернативный путь может работать даже при низких уровнях фактора D, а дефицит уровня фактора D встречается редко.[18][19]
Роль в болезнях
Точечная мутация, приводящая к замене серинового кодона (Ser42 в необработанной метиониновой форме фактора D) со стоп-кодоном (TAG) в гене фактора D на хромосоме 19 была задокументирована как причина дефицита фактора D.[20] Дефицит фактора D может вызвать повышенную восприимчивость к бактериальным инфекциям, в частности Neisseria инфекции. Тип наследования дефицита фактора D является аутосомно-рецессивным, и люди с мутацией только в одном аллеле могут не испытывать такой же предрасположенности к повторным инфекциям. У пациента с рецидивирующими инфекциями полное улучшение состояния было получено при введении очищенного фактора D.[21]
Заболевания с чрезмерной активацией комплемента включают: пароксизмальная ночная гемоглобинурия (ПНГ) и ингибиторы фактора D могут быть полезны при лечении ПНГ. Низкомолекулярные ингибиторы фактора D находятся в стадии разработки для лечения ПНГ, и один низкомолекулярный ингибитор, ACH-4471, показал многообещающие результаты в клинических испытаниях фазы 2 для ингибирования фактора D в сочетании с экулизумаб. Пациенты, получающие лечение ингибиторами фактора D, должны быть иммунизированы против инфекций, чтобы избежать повторных инфекций, как у пациентов с дефицитом фактора D.[22][23]
Рекомендации
- ^ PDB: 1HFD
- ^ Нараяна С.В., Карсон М., эль-Каббани О., Килпатрик Дж. М., Мур Д., Чен Х, Багг С. В., Воланакис Дж. Э., ДеЛукас Л. Дж. (1994). «Структура человеческого фактора D. Белок системы комплемента при разрешении 2,0 A». Журнал молекулярной биологии. 235 (2): 695–708. Дои:10.1006 / jmbi.1994.1021. PMID 8289289.
- ^ а б EntrezGene 1675
- ^ Ронти Т., Лупаттелли Г., Маннарино Э. (2006). «Эндокринная функция жировой ткани: обновление». Клиническая эндокринология. 64 (4): 355–65. Дои:10.1111 / j.1365-2265.2006.02474.x. PMID 16584505. S2CID 12455240.
- ^ Флиер Дж.С., Кук К.С., Ашер П., Шпигельман Б.М. (1987). «Сильно нарушенная экспрессия адипсина при генетическом и приобретенном ожирении». Наука. 237 (4813): 405–8. Bibcode:1987Научный ... 237..405F. Дои:10.1126 / science.3299706. PMID 3299706.
- ^ Воланакис Дж. Э., Нараяна С. В. (1996). «Фактор комплемента D, новая сериновая протеаза». Белковая наука. 5 (4): 553–64. Дои:10.1002 / pro.5560050401. ЧВК 2143395. PMID 8845746.
- ^ Лесавр, PH; Мюллер-Эберхард, HJ (1 декабря 1978 г.). «Механизм действия фактора D альтернативного пути комплемента». Журнал экспериментальной медицины. 148 (6): 1498–509. Дои:10.1084 / jem.148.6.1498. ЧВК 2185104. PMID 82604.
- ^ Цзин, H; Бабу Ю.С.; Мур, Д.; Килпатрик, JM; Лю, XY; Volanakis, JE; Нараяна, SV (9 октября 1998 г.). «Структуры природного и комплексного фактора комплемента D: влияние атипичной конформации His57 и самоингибиторной петли в регуляции специфической активности сериновой протеазы». Журнал молекулярной биологии. 282 (5): 1061–81. Дои:10.1006 / jmbi.1998.2089. PMID 9753554.
- ^ Цзин, H; Macon, KJ; Мур, Д.; ДеЛюкас, LJ; Volanakis, JE; Нараяна, SV (15 февраля 1999 г.). «Структурная основа активации профактора D: от очень гибкого зимогена до новой самоингибирующейся сериновой протеазы, фактора комплемента D.» Журнал EMBO. 18 (4): 804–14. Дои:10.1093 / emboj / 18.4.804. ЧВК 1171173. PMID 10022823.
- ^ Карки, Р.Г .; Пауэрс, Дж; Mainolfi, N; Андерсон, К; Belanger, DB; Лю, Д; Ji, N; Jendza, K; Гелин, CF; Мак Суини, А; Соловей, К; Дельгадо, О; Кроули, М; Liao, SM; Аргикар, UA; Flohr, S; Ла Бонте, LR; Lorthiois, EL; Вульпетти, А; Браун, А; Длинный, D; Прентисс, М; Граду, Н; де Эркенез, А; Тмин, F; Адамс, К; Джеффи, B; Моги, М. (9 мая 2019 г.). «Дизайн, синтез и доклиническая характеристика селективных ингибиторов фактора D, направленных на альтернативный путь комплемента». Журнал медицинской химии. 62 (9): 4656–4668. Дои:10.1021 / acs.jmedchem.9b00271. PMID 30995036.
- ^ Forneris, F; Риклин, Д; Ву, Дж; Цеку, А; Уоллес, РС; Lambris, JD; Gros, P (24 декабря 2010 г.). «Структуры C3b в комплексе с факторами B и D дают представление об образовании конвертазы комплемента». Наука. 330 (6012): 1816–20. Bibcode:2010Sci ... 330.1816F. Дои:10.1126 / science.1195821. ЧВК 3087196. PMID 21205667.
- ^ Вульпетти, А; Randl, S; Рюдиссер, S; Остерманн, Н; Эрбель, П; Мак Суини, А; Золлер, Т; Салем, Б; Герхарц, B; Тмин, F; Hommel, U; Dalvit, C; Lorthiois, E; Майбаум, Дж. (9 марта 2017 г.). «Структурный дизайн библиотеки и скрининг фрагментов для идентификации обратимых ингибиторов протеазы фактора комплемента D». Журнал медицинской химии. 60 (5): 1946–1958. Дои:10.1021 / acs.jmedchem.6b01684. PMID 28157311.
- ^ Майбаум, Дж; Liao, SM; Вульпетти, А; Остерманн, Н; Randl, S; Рюдиссер, S; Lorthiois, E; Эрбель, П; Кинзель, Б; Колб Ф.А.; Барбьери, S; Вагнер, Дж; Дюран, К; Феттис, К; Dussauge, S; Hughes, N; Дельгадо, О; Hommel, U; Гулд, Т; Мак Суини, А; Герхарц, B; Тмин, F; Flohr, S; Шубарт, А; Джеффи, B; Харрисон, Р. Ризитано, AM; Эдер, Дж; Андерсон, К. (декабрь 2016 г.). «Низкомолекулярные ингибиторы фактора D, направленные на альтернативный путь комплемента». Природа Химическая Биология. 12 (12): 1105–1110. Дои:10.1038 / nchembio.2208. PMID 27775713.
- ^ Вульпетти, А; Остерманн, Н; Randl, S; Юн, Т; Мак Суини, А; Тмин, F; Lorthiois, E; Рюдиссер, S; Эрбель, П; Майбаум, Дж. (10 мая 2018 г.). «Открытие и дизайн первых лигандов на основе бензиламина, связывающихся с разблокированной конформацией фактора комплемента D.» Письма о медицинской химии ACS. 9 (5): 490–495. Дои:10.1021 / acsmedchemlett.8b00104. ЧВК 5949727. PMID 29795765.
- ^ Хаяси, М; Мачида, Т; Исида, Й; Огата, Y; Омори, Т; Такасуми, М; Эндо, Y; Сузуки, Т; Секимата, М; Homma, Y; Икава, М; Охира, H; Fujita, T; Sekine, H (15 сентября 2019 г.). «Передний край: роль MASP-3 в физиологической активации фактора D альтернативного пути комплемента». Журнал иммунологии. 203 (6): 1411–1416. Дои:10.4049 / jimmunol.1900605. PMID 31399515. S2CID 199518699.
- ^ Lorthiois, E; Андерсон, К; Вульпетти, А; Рогель, О; Тмин, F; Остерманн, Н; Steinbacher, S; Мак Суини, А; Дельгадо, О; Liao, SM; Randl, S; Рюдиссер, S; Dussauge, S; Феттис, К; Киффер, Л; де Эркенез, А; Ян, Л; Hartwieg, C; Аргикар, UA; Ла Бонте, LR; Ньютон, R; Kansara, V; Flohr, S; Hommel, U; Джеффи, B; Майбаум, Дж. (13 июля 2017 г.). «Открытие сильнодействующих и селективных обратимых маломолекулярных ингибиторов фактора D, демонстрирующих ингибирование альтернативного пути комплемента in vivo». Журнал медицинской химии. 60 (13): 5717–5735. Дои:10.1021 / acs.jmedchem.7b00425. PMID 28621538.
- ^ Dobó, J; Кочиш, А; Гал, П (2018). «Будьте на высоте: стратегии нацеливания на альтернативные компоненты и компоненты лектинового пути при комплемент-опосредованных заболеваниях». Границы иммунологии. 9: 1851. Дои:10.3389 / fimmu.2018.01851. ЧВК 6092519. PMID 30135690.
- ^ Volanakis, JE; Barnum, SR; Гидденс, М; Галла, Дж. Х. (14 февраля 1985 г.). «Почечная фильтрация и катаболизм белка комплемента D.». Медицинский журнал Новой Англии. 312 (7): 395–9. Дои:10.1056 / NEJM198502143120702. PMID 3844050.
- ^ Паскуаль, М; Steiger, G; Estreicher, J; Macon, K; Volanakis, JE; Шифферли, Дж. А. (октябрь 1988 г.). «Метаболизм фактора комплемента D при почечной недостаточности». Kidney International. 34 (4): 529–36. Дои:10.1038 / ки.1988.214. PMID 3199673.
- ^ Biesma, DH; Hannema, AJ; van Velzen-Blad, H; Малдер, Л; van Zwieten, R; Kluijt, I; Роос, Д. (июль 2001 г.). «Семья с дефицитом фактора комплемента D». Журнал клинических исследований. 108 (2): 233–40. Дои:10.1172 / JCI12023. ЧВК 203023. PMID 11457876.
- ^ Hiemstra, PS; Langeler, E; Compier, B; Хранители, Y; Leijh, PC; van den Barselaar, MT; Овербош, Д; Даха, MR (декабрь 1989 г.). «Полный или частичный дефицит фактора комплемента D в голландской семье». Журнал клинических исследований. 84 (6): 1957–61. Дои:10.1172 / JCI114384. ЧВК 304077. PMID 2687330.
- ^ Юань, X; Гавриилаки, Э; Thanassi, JA; Ян, G; Бейнс, AC; Подос, СД; Хуанг, Y; Хуанг, М; Бродский Р.А. (март 2017 г.). «Ингибиторы низкомолекулярного фактора D избирательно блокируют альтернативный путь комплемента при пароксизмальной ночной гемоглобинурии и атипичном гемолитико-уремическом синдроме». Haematologica. 102 (3): 466–475. Дои:10.3324 / haematol.2016.153312. ЧВК 5394948. PMID 27810992.
- ^ Ризитано, AM (январь 2014 г.). «Лечение антикомплементом при пароксизмальной ночной гемоглобинурии: где мы находимся и куда идем». Трансляционная медицина @ UniSa. 8: 43–52. ЧВК 4000462. PMID 24778997.
внешняя ссылка
- Дополнение + Фактор + D в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.