WikiDer > Гемолитическая болезнь новорожденного
| Гемолитическая болезнь новорожденного | |
|---|---|
| Другие имена | HDN |
 | |
| Специальность | Педиатрия, Иммуногематология |
| Осложнения | сердечная недостаточность, спленомегалия |
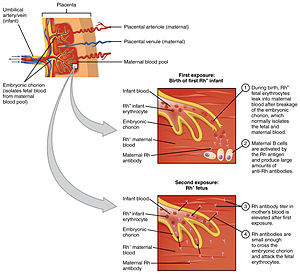
Гемолитическая болезнь новорожденного, также известный как гемолитическая болезнь плода и новорожденного, HDN, HDFN, или же эритробластоз плода,[1] является аллоиммунный состояние, которое развивается в плод при рождении или около него, когда IgG молекулы (один из пяти основных типов антитела) произведенные матерью проходят через плацента. Среди этих антител есть такие, которые атакуют антигены на красные кровяные тельца в кровообращение плода, разрушая и разрушая клетки (гемолиз). Плод может развиваться ретикулоцитоз и анемия. Это заболевание плода варьируется от легкого до очень тяжелого, а смерть плода от сердечной недостаточности (водянка плода) может случиться. При средней или тяжелой форме заболевания многие эритробласты (незрелые эритроциты) присутствуют в крови плода, поэтому эти формы заболевания можно назвать эритробластоз плода (или же эритробластоз плода).
HDFN представляет собой нарушение иммунная привилегия для плода или какой-либо другой формы поражения иммунная толерантность к беременности. Классифицируются различные типы HDFN, по которым аллоантиген вызывает ответ. В порядке заболеваемость, типы включают ABO, анти-RhD, анти-RhE, анти-Rhc, комбинации анти-Rhe, анти-RhC, мультиантигены и анти-келл.[нужна цитата]
Признаки и симптомы
Признаки гемолитической болезни новорожденного включают положительный прямой тест Кумбса (также называемый тестом прямой агглютинации), повышенный уровень билирубина пуповины и гемолитическая анемия. У новорожденного с этим заболеванием возможно наличие нейтропения и неонатальная аллоиммунная тромбоцитопения также. Гемолиз приводит к повышенным билирубин уровни. После родов билирубин больше не выводится (через плаценту) из крови новорожденного и симптомы из желтуха (желтоватая кожа и желтое изменение цвета белков глаз, или желтуха) увеличиваются в течение 24 часов после рождения. Как и другие формы тяжелых неонатальная желтуха, есть вероятность развития у новорожденного острого или хронического ядерная желтухаоднако риск ядерной желтухи при ГБН выше из-за быстрого и массивного разрушения клеток крови. Важно отметить, что изоиммунизация является фактором риска нейротоксичности и снижает уровень ядерной желтухи. При отсутствии лечения тяжелая анемия может вызвать повышенную выработку сердечная недостаточность, с бледность, увеличенная печень и / или селезенка, обобщенный припухлость, и респираторный дистресс.
HDN может быть причиной водянка плода, часто тяжелая форма пренатальной сердечная недостаточность что вызывает у плода отек.[2]
Осложнения
Осложнения HDN могут включать: ядерная желтуха, гепатоспленомегалиясиндром уплотненной (утолщенной или высушенной) желчи и / или зеленоватое окрашивание зубы, гемолитическая анемия и повреждение печени из-за избытка билирубина. Состояния, которые могут вызывать подобные симптомы в период новорожденности, включают: приобретенная гемолитическая анемия, врожденный токсоплазма, врожденный сифилис инфекция, врожденная непроходимость желчный проток, и цитомегаловирус (ЦМВ) инфекция.
- Высокий при рождении или быстро повышающийся билирубин[3]
- Длительная гипербилирубинемия[3]
- Неврологическая дисфункция, вызванная билирубином[4]
- Церебральный паралич[5]
- Kernicterus[6]
- Нейтропения[7][8]
- Тромбоцитопения[7]
- Гемолитическая анемия - НЕЛЬЗЯ лечить железом[9]
- Поздняя анемия - НЕЛЬЗЯ лечить железом. Может сохраняться до 12 недель после рождения.[10][11][12]
Патофизиология
Антитела вырабатываются, когда организм подвергается воздействию антиген чуждый составу тела. Если мать подвергается воздействию чужеродного антигена и вырабатывает IgG (в отличие от IgM который не проникает через плаценту), IgG будет нацеливаться на антиген, если он присутствует у плода, и может повлиять на него в утробе и сохраняются после родов. Три наиболее распространенные модели, в которых женщина становится сенсибилизированной (т. Е. Производит IgG антитела против) конкретного антигена - кровотечение, переливание крови и несовместимость по системе АВО.[нужна цитата]
Кровоизлияние у плода и матери, которое представляет собой движение клеток крови плода через плаценту, может происходить во время аборт, внематочная беременность, роды, разрывы в плацента в течение беременность (часто вызванные травмой) или медицинские процедуры, проводимые во время беременности, которые приводят к повреждению стенки матки. При последующих беременностях, если наблюдается аналогичная несовместимость у плода, эти антитела могут проникать через плаценту в кровоток плода и прикрепляться к красные кровяные тельца и вызвать их разрушение (гемолиз). Это основная причина ГБН, потому что 75% беременностей приводят к контакту между кровью плода и матери, а у 15–50% беременностей наблюдаются кровотечения с потенциалом иммунной сенсибилизации. Количество крови плода, необходимое для сенсибилизации матери, зависит от иммунной системы человека и колеблется от 0,1 мл до 30 мл.[2]
Женщина могла получить терапевтическое переливание крови. Система групп крови ABO и антиген D Резус (Rh) система групп крови типирование перед переливанием является обычным делом. Было высказано предположение, что женщинам детородного возраста или молодым девушкам не следует делать переливание Rhc-положительной крови или крови. Келл1-положительная кровь, чтобы избежать возможной сенсибилизации, но это приведет к перегрузке ресурсов служб переливания крови, и в настоящее время считается неэкономичным проводить скрининг на эти группы крови. HDFN также может быть вызвана антителами ко множеству других система группы крови антигены, но наиболее часто встречаются Kell и Rh.[нужна цитата]
Третья модель сенсибилизации может возникнуть у женщин с группой крови О. иммунная реакция к антигенам A и B, которые широко распространены в окружающей среде, обычно приводит к продукции IgM или IgG анти-A и анти-B антител в раннем возрасте. Женщины с группой крови O более склонны, чем женщины с типом A и B, к выработке IgG-антител к A и анти-B, и эти IgG-антитела способны проникать через плаценту. По неизвестным причинам частота материнских антител против антигенов типа A и B типа IgG, которые потенциально могут вызвать гемолитическую болезнь новорожденного, выше, чем наблюдаемая частота «болезни АВО». Около 15% беременностей происходят от матери типа O и ребенка типа A или типа B; только 3% этих беременностей заканчиваются гемолитической болезнью из-за несовместимости A / B / O. В отличие от антител к антигенам A и B, резус-антитела обычно не образуются при воздействии антигенов окружающей среды.[нужна цитата] В случаях несовместимости по системе АВО и несовместимости по резус-фактору риск аллоиммунизации снижается, поскольку эритроциты плода удаляются из материнского кровообращения благодаря антителам против АВО, прежде чем они могут вызвать ответ против резус-фактора.[2]
Специфические антитела
- Anti-D - единственная предотвратимая форма ГБН. С момента появления в 1968 г. иммуноглобулина Rho-D (Рогам), который предотвращает выработку материнских антител Rho-D, частота анти-D HDN резко снизилась.[2][13]
- И анти-C, и анти-c могут показывать отрицательный DAT, но все же имеют тяжелое поражение младенца.[14][15] Непрямой Кумбс также необходимо запустить.
- Anti-M также рекомендует тестирование на антигены, чтобы исключить наличие HDN, поскольку прямые половые клетки могут дать отрицательный результат у серьезно пораженного ребенка.[16]
- Anti-Kell может вызвать тяжелую анемию независимо от титра.[17] Anti-Kell подавляет костный мозг,[18] путем ингибирования клеток-предшественников эритроидов.[19][20]
- Антигены Kidd также присутствуют на эндотелиальных клетках почек.[21][22]
- Одно исследование, проведенное Мораном и др., Показало, что титры анти-E ненадежны. Их наиболее тяжелый случай гемолитической болезни новорожденных произошел с титрами 1: 2. Моран заявляет, что было бы неразумно отвергать анти-Е как имеющий незначительные клинические последствия.[23]
Диагностика
В диагноз HDN основана на анамнезе и лабораторных данных:
Анализы крови новорожденного
- Биохимические тесты для желтуха в том числе общие и прямые билирубин уровни.
- Полный анализ крови (CBC), который может показывать уменьшенное гемоглобин и гематокрит из-за разрушения красных кровяных телец
- Ретикулоцит количество эритроцитов, которое обычно увеличивается по мере того, как костный мозг вырабатывает новые эритроциты взамен разрушаемых, и мазок периферической крови для изучения клеток морфология. При наличии значительных гемолиз мазок покажет шистоциты (фрагментированные эритроциты), ретикулоцитоз, а в тяжелых случаях Эритробласты (также известные как ядерные эритроциты).
- Положительный прямой тест Кумбса (может быть отрицательным после переливания межматочной крови плода)
Анализы крови матери
- Положительный непрямой тест Кумбса
Анализы крови отца (требуется редко)
- Статус антигена эритроцитов
Типы (классифицируются по серологии)
Типы ГБН классифицируются по типу задействованных антигенов. Основные типы - это ABO HDN, Rhesus HDN, Kell HDN и другие антитела. АВО гемолитическая болезнь новорожденных может варьироваться от легкой до тяжелой, но обычно это легкое заболевание. Это может быть вызвано антителами к А и В. Резус D гемолитическая болезнь новорожденных (часто называемая резус-болезнью) - наиболее распространенная форма тяжелой ГБН. Резус c гемолитической болезнью новорожденного может варьироваться от легкой до тяжелой формы заболевания - это третья по частоте форма тяжелой ГБН.[24] Резус Е и резус С гемолитической болезни новорожденных встречаются редко. Комбинации антител, например анти-Rhc и анти-RhE, встречающиеся вместе, могут быть особенно серьезными.
Анти-Келлская гемолитическая болезнь новорожденных чаще всего вызывается анти-K 1 антитела, вторая по распространенности форма тяжелой ГБН. Более половины случаев анти-К 1 связанные HDN вызваны множественными переливаниями крови. Антитела к другим антигенам Kell встречаются редко.[24]
Профилактика
В случае несовместимости Rho (D), Rho (D) иммуноглобулин дается для предотвращения сенсибилизации. Однако не существует сопоставимой иммунотерапии при несовместимости других групп крови.[2]
Ранняя беременность
- ВВИГ - ВВИГ означает внутривенный иммуноглобулин. Он используется в случаях предыдущей потери, высоких материнских титров, известных агрессивных антител и в случаях, когда религия препятствует переливанию крови. ВВИГ может быть более эффективным, чем только ВМИ.[25] Смертность плода снизилась на 36% в группе ВВИГ и ВМИ, чем в группе только ВМО. Совместное использование ВВИГ и плазмафереза может снизить или исключить необходимость проведения ВМИ.[26]
- Плазмаферез - плазмаферез направлен на снижение материнского титра путем прямого замещения плазмы и физического удаления антител.[16] Плазмаферез и ВВИГ вместе можно использовать даже у женщин с ранее отечным плодом и потерей плода.[27][28]
Средние и поздние сроки беременности
- IUT - Внутриматочное переливание (IUT) проводится либо путем внутрибрюшинного переливания (IPT), либо внутривенного переливания (IVT).[29] IVT предпочтительнее IPT.[30] ВМС проводятся только до 35 недель. После этого риск ВМС больше, чем риск послеродового переливания.[31]
- Стероиды - стероиды иногда назначают матери перед ВМС и ранними родами для созревания легких плода.[31][32]
- Фенобарбитал - иногда фенобарбитал назначают матери, чтобы помочь созреть печень плода и уменьшить гипербилирубинемию.[32][33]
- Ранняя доставка - доставка может произойти в любое время после достижения возраста жизнеспособности.[30] Возможны экстренные роды из-за отказа IUT, а также индукция родов в 35–38 недель.[31][34]
Резус-отрицательным матерям, беременным резус-положительным младенцем, предлагается иммунитет к Rho (D). глобулин (RhIG или RhoGam) на 28 неделе беременности, на 34 неделе и в течение 48 часов после родов, чтобы предотвратить сенсибилизацию к антигену D. Он работает путем связывания любых эритроцитов плода с антигеном D до того, как мать сможет вызвать иммунный ответ и сформировать анти-D IgG.[2] Недостатком дородового введения RhIG является то, что он вызывает положительный скрининг на антитела при тестировании матери, что может быть трудно отличить от естественных иммунологических ответов, которые приводят к продукции антител.[нужна цитата] Без иммуноглобулина Rho (D) риск изоиммунизации составляет примерно 17%; при правильном применении риск снижается до менее 0,1–0,2%.[2]
Тестирование после рождения
- Кумбс - в определенных случаях (например, когда есть опасения по поводу несовместимости групп крови между мамой и ребенком) после рождения ребенку будет проведен прямой тест Кумбса, чтобы подтвердить наличие антител, прикрепленных к эритроцитам ребенка. Этот тест проводится на пуповинной крови младенца.[3]
В некоторых случаях прямой результат Кумбса будет отрицательным, но может произойти тяжелая, даже фатальная ГБН.[14] Непрямой Кумбс необходимо запускать в случаях анти-C,[15] анти-с,[15] и анти-М. Младенцам с анти-М также рекомендуется пройти тестирование на антиген, чтобы исключить наличие ГБН.[16] Приведенные ниже тесты часто полезны в случаях гемолитической болезни новорожденных, но не требуются для лечения всех новорожденных.
- Hgb - гемоглобин младенца следует исследовать из пуповинной крови.[3]
- Количество ретикулоцитов - количество ретикулоцитов повышается, когда младенец производит больше эритроцитов в ответ на анемию.[3] Повышение ретикологического показателя может означать, что ребенку могут не потребоваться дополнительные переливания.[35] Низкая ретикулярность наблюдается у младенцев, получавших IUT, и у детей с HDN от Anti-Kell.[15]
- Нейтрофилы - поскольку нейтропения является одним из осложнений ГБН, необходимо проверить количество нейтрофилов.[7][8]
- Тромбоциты - поскольку тромбоцитопения является одним из осложнений ГБН, необходимо проверить количество тромбоцитов.[7]
- Билирубин следует анализировать из пуповинной крови.[3]
- Ферритин - поскольку у большинства детей грудного возраста, страдающих ГБН, имеется перегрузка железом, перед тем, как давать ребенку дополнительное количество железа, необходимо пройти курс ферритина.[9]
- Скрининговые тесты новорожденных - переливание донорской крови во время беременности или вскоре после родов может повлиять на результаты скрининговых тестов новорожденных. Рекомендуется подождать и повторить анализ через 10–12 месяцев после последнего переливания. В некоторых случаях анализ ДНК слюны может быть использован для исключения определенных состояний.
Уход
После рождения лечение зависит от тяжести состояния, но может включать стабилизацию температуры и мониторинг, фототерапия, переливание совместимой упакованной красной крови, обменное переливание, бикарбонат натрия для исправления ацидоз и / или вспомогательная вентиляция легких.[нужна цитата]
- Фототерапия - воздействие ультрафиолетового света (фототерапия) рекомендуется, когда билирубин пуповины равен 3 или выше. Некоторые врачи используют его на более низких уровнях, ожидая результатов лабораторных исследований.[36] Это превращает неконъюгированный билирубин в конъюгированную форму, от которой младенцу легче избавиться.
- ВВИГ - ВВИГ использовался для успешного лечения многих случаев ГБН. Его использовали не только против D, но и против E.[37] ВВИГ можно использовать для уменьшения потребности в обменном переливании крови и для сокращения продолжительности фототерапии.[38] AAP рекомендует: «При изоиммунной гемолитической болезни рекомендуется введение γ-глобулина внутривенно (0,5–1 г / кг в течение 2 часов), если TSB повышается, несмотря на интенсивную фототерапию, или если уровень TSB находится в пределах 2–3 мг / дл (34– 51 мкмоль / л) обменного уровня. При необходимости эту дозу можно повторить через 12 часов (качество доказательств B: польза превышает вред). Внутривенное введение гамма-глобулина снижает потребность в обменных переливаниях при гемолитическом Rh и ABO болезнь."[36]
- Обменное переливание крови - Обменное переливание используется, когда билирубин достигает линии высокого или среднего риска на нонограмме, предоставленной Американской академией педиатрии (рис. 4).[36] Билирубин пуповины> 4 также указывает на необходимость обменного переливания крови.[39]
Трансфузионные реакции
Когда у женщины появляются антитела, она подвергается высокому риску реакции на переливание в будущем, если она нуждается в переливании крови.[40] По этой причине она должна всегда иметь при себе карточку медицинского предупреждения и информировать всех врачей и персонал неотложной помощи о своем статусе антител. Однако отсутствие антител не препятствует возникновению у женщины реакции на переливание крови:
«Острые гемолитические трансфузионные реакции могут быть иммуноопосредованными или неиммунопосредованными. Иммуноопосредованные гемолитические трансфузионные реакции, вызванные иммуноглобулином M (IgM), анти-A, анти-B или анти-A, B, обычно приводят к тяжелым, потенциально смертельным Комплемент-опосредованный внутрисосудистый гемолиз. Иммуноопосредованные гемолитические реакции, вызванные IgG, Rh, Kell, Duffy или другими не-ABO антителами, обычно приводят к внесосудистой секвестрации, сокращению выживаемости переливаемых эритроцитов и относительно легким клиническим реакциям. Острые гемолитические реакции при переливании крови из-за иммунного гемолиза может возникать у пациентов, у которых не обнаруживаются антитела с помощью обычных лабораторных процедур ».[41]
Для получения сводной информации о трансфузионных реакциях в США см. Ссылку.[42]
Эпидемиология
В 2003 г. частота сенсибилизации Rh (D) в США составляла 6,8 на 1000 живорождений; 0,27% женщин с резус-несовместимым плодом проходят аллоиммунизацию.[2]
Другие животные
Гемолитическая болезнь новорожденных чаще всего встречается у котят (известная как «синдром увядающего котенка») и жеребят. Об этом также сообщалось в щенки.[нужна цитата]
Смотрите также
- Обменное переливание
- Резус-болезнь
- Аллоиммунизация
- Гемолитическая болезнь новорожденных (анти-Келл)
- Гемолитическая болезнь новорожденных (анти-Rhc)
- Гемолитическая болезнь новорожденных (анти-RhE)
- Гемолитическая болезнь новорожденных (АВО)
- Переливание неонатальных эритроцитов
Рекомендации
- ^ "эритробластоз плода" в Медицинский словарь Дорланда
- ^ а б c d е ж грамм час Арро, Амариллис (09.03.2017). «Аллоиммунизация эритроцитов и беременность: обзор, история вопроса, патофизиология». Medscape.
- ^ а б c d е ж Мюррей, Н. А; Робертс, И.А.Г. (2007). «Гемолитическая болезнь новорожденных». Архивы болезней детства: издание для плода и новорожденного. 92 (2): F83–8. Дои:10.1136 / adc.2005.076794. ЧВК 2675453. PMID 17337672.
- ^ Шапиро, Стивен М (2004). «Определение клинического спектра ядерной желтухи и билирубин-индуцированной неврологической дисфункции (BIND)». Журнал перинатологии. 25 (1): 54–9. Дои:10.1038 / sj.jp.7211157. PMID 15578034. S2CID 19663259.
- ^ Блэр, Ева; Уотсон, Линда (2006). «Эпидемиология церебрального паралича». Семинары по фетальной и неонатальной медицине. 11 (2): 117–25. Дои:10.1016 / j.siny.2005.10.010. PMID 16338186.
- ^ Ланде, Лотти (1948). «Клинические признаки и развитие выживших после ядерной желтухи из-за сенсибилизации Rh». Журнал педиатрии. 32 (6): 693–705. Дои:10.1016 / S0022-3476 (48) 80225-8. PMID 18866937.
- ^ а б c d Koenig, J.M .; Кристенсен, Р. Д. (1989). «Нейтропения и тромбоцитопения у младенцев с резус-гемолитической болезнью». Журнал педиатрии. 114 (4 Pt 1): 625–31. Дои:10.1016 / s0022-3476 (89) 80709-7. PMID 2494315.
- ^ а б Lalezari, P; Нуссбаум, М; Гельман, С; Спает, Т. Х. (1960). «Неонатальная нейтропения вследствие изоиммунизации матери». Кровь. 15 (2): 236–43. Дои:10.1182 / blood.V15.2.236.236. PMID 14413526.[постоянная мертвая ссылка]
- ^ а б Rath, M.E.A .; Smits-Wintjens, V.E.H.J .; Oepkes, D .; Вальтер, Ф. Дж .; Лоприоре, Э. (2013). «Уровень железа у младенцев с аллоиммунной гемолитической болезнью в первые три месяца жизни». Vox Sanguinis. 105 (4): 328–33. Дои:10.1111 / vox.12061. PMID 23802744.
- ^ Mitchell, S; Джеймс, А (1999). «Тяжелая поздняя анемия гемолитической болезни новорожденных». Педиатрия и здоровье детей. 4 (3): 201–3. Дои:10.1093 / пч / 4.3.201. ЧВК 2828194. PMID 20212966.
- ^ Аль-Алайян, С .; Аль Омран, А. (1999). «Поздняя гипорегенеративная анемия у новорожденных с резус-гемолитической болезнью». Журнал перинатальной медицины. 27 (2): 112–5. Дои:10.1515 / JPM.1999.014. PMID 10379500. S2CID 32155893.
- ^ Джадала, Хариш; v., Пуджа; к., Рагхавендра; м., Притхвиш; б., Шринивас (2016). «Поздняя тяжелая анемия из-за изоиммунизации резус». Международный журнал современной педиатрии: 1472–3. Дои:10.18203 / 2349-3291.ijcp20163704.
- ^ Басу, Сабита; Каур, Равнит; Каур, Гагандип (2011). «Гемолитическая болезнь плода и новорожденного: современные тенденции и перспективы». Азиатский журнал науки о переливании крови. 5 (1): 3–7. Дои:10.4103/0973-6247.75963. ЧВК 3082712. PMID 21572705.
- ^ а б Heddle, N.M .; Wentworth, P; Андерсон, Д. Р .; Эммерсон, Д; Kelton, J. G .; Блайхман, М. А. (1995). «Три примера резус-гемолитической болезни новорожденных с отрицательным прямым антиглобулиновым тестом». Трансфузионная медицина. 5 (2): 113–6. Дои:10.1111 / j.1365-3148.1995.tb00197.x. PMID 7655573.
- ^ а б c d Гемолитическая болезнь новорожденных ~ обследование в eMedicine
- ^ а б c Арора, Сатьям; Дода, Вина; Мария, Арти; Котвал, Урверши; Гоял, Саураб (2015). «Материнская анти-М-индуцированная гемолитическая болезнь новорожденных с последующей длительной анемией у новорожденных близнецов». Азиатский журнал науки о переливании крови. 9 (1): 98–101. Дои:10.4103/0973-6247.150968. ЧВК 4339947. PMID 25722586.
- ^ Van Wamelen, D J .; Klumper, F J .; Де Хаас, М. Meerman, RH .; Van Kamp, I L .; Oepkes, D (2007). «Акушерский анамнез и титр антител в оценке тяжести аллоиммунизации Kell при беременности». Акушерство и гинекология. 109 (5): 1093–8. Дои:10.1097 / 01.AOG.0000260957.77090.4e. PMID 17470588. S2CID 24848319.
- ^ Гоури, Вайдьянатан; Аль-Дугайши, Тамима; Аль-Рубхи, Ихлас; Аль-Духли, Меймуна; Аль-Харраси, Юсра (2015). «Аллоиммунизация за счет антител к эритроцитам у резус-положительных оманских беременных женщин: материнский и перинатальный исход». Азиатский журнал науки о переливании крови. 9 (2): 150–4. Дои:10.4103/0973-6247.162710. ЧВК 4562135. PMID 26420934.
- ^ Vaughan, Janet I .; Мэннинг, Моника; Warwick, Ruth M .; Letsky, Elizabeth A .; Мюррей, Нил А .; Робертс, Ирен А.Г. (1998). «Ингибирование эритроидных клеток-предшественников анти-Kell антителами при аллоиммунной анемии плода». Медицинский журнал Новой Англии. 338 (12): 798–803. Дои:10.1056 / NEJM199803193381204. PMID 9504940.
- ^ «Сенсибилизация келла также может вызвать анемию плода». Современный акушер-гинеколог. UBM Medica. 1 сентября 2008 г.. Получено 23 мая 2018.
- ^ Цюнь Лу, доктор медицины (5 февраля 2009 г.), Система групп крови Кидда (PDF), Лос-Анджелес, Калифорния: Департамент патологии и лабораторной медицины, Калифорнийский университет в Лос-Анджелесе, Школа медицины, получено 23 мая 2018
- ^ Дин, Л. (2005). «Глава 10: Группа крови Кидда». Группы крови и антигены эритроцитов. Бетесда, Мэриленд: Национальный центр биотехнологической информации. Получено 23 мая 2018.
- ^ Moran, P .; Robson, S.C .; Рид, М. М. (2000). «Анти-Е при беременности». BJOG. 107 (11): 208–11. Дои:10.1111 / j.1471-0528.2000.tb11662.x. PMID 11117776.
- ^ а б Де Хаас, М .; Thurik, F. F .; Koelewijn, J.M .; Ван дер Шут, CE (2015). «Гемолитическая болезнь плода и новорожденного». Vox Sanguinis. 109 (2): 99–113. Дои:10.1111 / vox.12265. PMID 25899660.
- ^ Voto, L. S .; Mathet, E. R .; Zapaterio, J. L .; Орти, Дж; Lede, R. L .; Маргулис, М. (1997). «Высокие дозы гаммаглобулина (ВВИГ) с последующими внутриматочными трансфузиями (ВМС): новая альтернатива для лечения тяжелой гемолитической болезни плода». Журнал перинатальной медицины. 25 (1): 85–8. Дои:10.1515 / jpme.1997.25.1.85. PMID 9085208. S2CID 22822621.
- ^ Новак, Дебора Дж .; Тайлер, Лиза Н .; Редди, Рамакришна Л .; Барсум, Майкл Дж. (2008). «Плазмаферез и внутривенное введение иммуноглобулина для лечения аллоиммунизации D при беременности». Журнал клинического афереза. 23 (6): 183–5. Дои:10.1002 / jca.20180. PMID 19003884.
- ^ Палфи, Миодраг; Хильден, Ян-Олоф; Маттиесен, Лейф; Селбинг, Андерс; Берлин, Gösta (2006). «Случай тяжелой аллоиммунизации Rh (D), леченный интенсивным плазмообменом и высокими дозами внутривенного иммуноглобулина». Наука о переливании и аферезе. 35 (2): 131–6. Дои:10.1016 / j.transci.2006.07.002. PMID 17045529.
- ^ Рума, Майкл С .; Moise, Kenneth J .; Ким, Ынхи; Мурта, Эми П .; Пруцман, Венди Дж .; Hassan, Sonia S .; Любарский, Сюзанна Л. (2007). «Комбинированный плазмаферез и внутривенное введение иммуноглобулина для лечения тяжелой материнской аллоиммунизации эритроцитов». Американский журнал акушерства и гинекологии. 196 (2): 138.e1–6. Дои:10.1016 / j.ajog.2006.10.890. PMID 17306655.
- ^ Дека, Дипика (2016). «Внутриматочное переливание». Журнал медицины плода. 27 (3): 13–17. Дои:10.1007 / s40556-016-0072-4. PMID 26811110. S2CID 42005756.
- ^ а б Аллоиммунизация эритроцитов и беременность в eMedicine
- ^ а б c Мойс-младший, Кеннет Дж. (15 марта 2018 г.). «Внутриутробное переливание эритроцитов плода». Своевременно. UpToDate, Inc. Получено 31 марта 2018.
- ^ а б Гемолитическая болезнь новорожденных ~ лечение в eMedicine
- ^ UNC Detection & Prevention: протокол изоиммунизации (PDF), Университет Северной Каролины, Медицинский факультет в Чапел-Хилл, Октябрь 2001 г., получено 23 мая 2018
- ^ Rimon, E .; Peltz, R .; Gamzu, R .; Ягель, С .; Фельдман, Б .; Chayen, B .; Achiron, R .; Липиц, С. (2006). «Управление изоиммунизацией Kell - оценка подхода под контролем Доплера». Ультразвук в акушерстве и гинекологии. 28 (6): 814–20. Дои:10.1002 / uog.2837. PMID 16941575.
- ^ «Гемолитическая болезнь новорожденных» (PDF), Руководство для персонала питомника интенсивной терапии, Детская больница при г. Калифорнийский университет, Сан-Франциско, Медицинский центр, стр. 121–124, получено 23 мая 2018
- ^ а б c Подкомитет Американской академии педиатрии по гипербилирубинемии. (2004). «Лечение гипербилирубинемии у новорожденного на сроке 35 недель и более». Педиатрия. 114 (1): 297–316. Дои:10.1542 / педс.114.1.297. PMID 15231951.
- ^ Онисимо, Роберта; Риццо, Даниэла; Руджеро, Антонио; Валентини, Пьеро (2010). «Внутривенная иммуноглобулиновая терапия анти-Е гемолитической болезни у новорожденных». Журнал материнско-фетальной и неонатальной медицины. 23 (9): 1059–61. Дои:10.3109/14767050903544751. PMID 20092394. S2CID 25144401.
- ^ Готтштейн, Р. (2003). «Систематический обзор внутривенного иммуноглобулина при гемолитической болезни новорожденных». Архивы болезней детства: издание для плода и новорожденного. 88 (1): F6–10. Дои:10.1136 / fn.88.1.F6. ЧВК 1755998. PMID 12496219.
- ^ Гемолитическая болезнь новорожденных ~ наблюдение в eMedicine
- ^ Штробель, Эрвин (2008). «Гемолитические трансфузионные реакции». Трансфузионная медицина и гемотерапия. 35 (5): 346–353. Дои:10.1159/000154811. ЧВК 3076326. PMID 21512623.
- ^ Трансфузионные реакции в eMedicine
- ^ «FDA сообщило о смертельных случаях после сбора и переливания крови: годовой отчет за 2011 финансовый год», Вакцины, кровь и биопрепараты, НАС. Управление по контролю за продуктами и лекарствами, 8 мая 2012 г., архивировано из оригинал 11 ноября 2012 г.
дальнейшее чтение
- Гейфмангольцман, О; Войтович, М; Kosmas, E; Артал, Р. (1997). «Женская аллоиммунизация антителами, вызывающими гемолитическую болезнь». Акушерство и гинекология. 89 (2): 272–5. Дои:10.1016 / S0029-7844 (96) 00434-6. PMID 9015034. S2CID 36953155.
- Mollison, PL; Engelfriet CP; Контрерас М (1997). Переливание крови в клинической медицине (10-е изд.). Оксфорд, Великобритания: Blackwell Science. ISBN 978-0-86542-881-2.
- Группы крови и антигены красных кровяных телец: гемолитическая болезнь новорожденных
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |